骶尾部畸胎瘤(sacrococcygeal teratoma,SCT)是一种罕见的肿瘤,据报道其发病率为1/40 000~1/35 000[1]。SCT是婴幼儿时期最常见的生殖细胞肿瘤(germ call tumor, GCT),一般需要手术治疗。尽管本病的诊断和治疗流程已经相当规范,但因SCT生长特性及位置特点存在特殊性,术后常出现长期排便功能性后遗症[2]。本研究旨在评估畸胎瘤手术后远期肛门直肠功能,并探讨其影响因素。
材料与方法 一、一般资料回顾性分析天津市儿童医院新生儿外科2013年8月至2018年2月期间收治并接受手术的97例骶尾部畸胎瘤患者临床资料。研究正式开始前已获得患者家属知情同意,并通过天津市儿童医院伦理委员会的审核批准。纳入标准:①接受手术治疗且手术年龄≤28天;②术后病理活检证实为骶尾部畸胎瘤。排除标准:①合并消化道畸形;②术前、术中及术后死亡;③合并泌尿系畸形;④合并恶性生殖细胞瘤;⑤随访依从性差。
二、肿瘤标志物患者入院后均采用放射免疫法检测血清甲胎蛋白(alpha-fetoprotein,AFP)。行畸胎瘤术后第一年,前6个月每个月采集1次AFP,6个月后改为每2个月采集1次,2~3年后改为每3个月采集1次。血清AFP诊断标准:正常值范围0~25 g/L,>25 g/L判定为阳性,在正常范围内判定为阴性。
三、影像学检查术前行腹盆腔B超和MRI检查,根据MRI结果进行Altman分型。Altman肿瘤分型是术前决定手术方式的重要依据。Ⅰ型肿瘤的瘤体大部分突出于骶尾部,小部分位于骶前;Ⅱ型肿瘤横跨骶骨,主要位于骶骨之外,骶前部分未进入腹腔;Ⅲ型肿瘤同Ⅱ型,但瘤体主要位于骶前,可至腹腔;Ⅳ型肿瘤主要位于骶前,体表一般不可见[3]。
四、手术方法患者取俯卧位,手术前先行直肠指检,确定瘤体范围,经骶尾部作倒“V”状或横梭型切口,逐层切开各层组织,沿肿瘤包膜行钝性或锐性分离,为避免直肠壁损伤,于直肠内置入手指进行标记,行肿物前壁分离。寻找肿瘤分界线及直肠后壁,分离肿瘤侧壁及上极。均采取尾骨切除,并尽量切除卫星病灶。若肿瘤深入盆腔,经骶尾部作切口无法切除完整瘤体者,需先于腹部做手术切口,分离腹腔内瘤体,再于骶尾部做一切口,游离会阴部瘤体,直至肿瘤被完整切除,切除瘤体后检查有无神经损伤及活动出血情况,逐层缝合直肠侧壁,缝合肛门括约肌,关闭盆腔,肛管置入负压胶质引流管。记录术中畸胎瘤大小、是否完整切除以及术中肿瘤实质的溢漏情况。
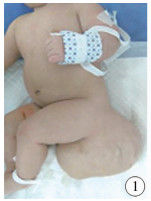
|
图 1 新生儿骶尾部畸胎瘤Ⅰ型 Fig.1 Neonatal sacrococcygeal teratoma Ⅰ type |
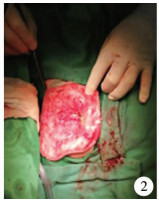
|
图 2 术中所见 Fig.2 Sacrococcygeal teratoma surgery |
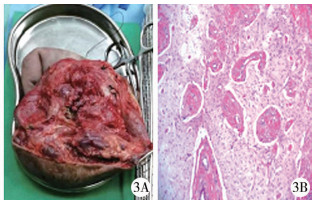
|
图 3 病理学检查3A:病变组织外观;3B:病变组织镜下观察(HE染色,×100) Fig.3 Histopathological examination. (H & E stain, ×100) |
收集并记录患者瘤体体积、瘤体处理和病理类型。瘤体体积分级:小于8 cm×4 cm×5 cm者判定为小瘤体,介于8 cm×4 cm×5 cm至11 cm×8 cm×9 cm之间者判定为中等大小瘤体,而超过11 cm×8 cm×9 cm者为大瘤体。
病理分型:良性和恶性。恶性畸胎瘤包括胚胎癌、内胚窦瘤、绒毛膜癌和多胚瘤。
(二)肛门直肠功能障碍影响因素的评价
采用Krickenbeck分类法[4],该分类法主要从自愿排便、污粪、便秘三方面进行评价。每方面分为3个等级,等级越高则代表肛门直肠功能越差。自愿排便被定义为排便的急迫感及控制排便的能力,是否自愿分别计1分和0分。污粪1级:偶尔出现污粪(1~2次/周),计3分;污粪2级:每日出现污粪组无社会问题,计2分,污粪3级:每日出现污粪且同时存在社会问题,计1分。便秘1级:通过饮食调节缓解,计3分;便秘2级:通过泄药缓解,计2分;便秘3级:对药物和饮食治疗抵抗,计1分。根据总得分进行等级判定:5~7分判定为优,3~4分判定为良,0~2分判定为差。
(三)随访情况
术后随访观察,每3个月行1次血清AFP化验及超声检查,恶性畸胎瘤患者在肿瘤切除后每隔半年行腹部CT扫描。评估患者术后肛门直肠功能恢复情况。
六、统计学处理应用SPSS 24.0进行数据收集和统计分析,计量资料以(x±s)表示,组间比较采用独立样本t检验,采用Logistic回归分析模型对肛门直肠功能恢复情况进行相对风险分析。P<0.05认为差异有统计学意义。
结果 一、一般资料详见表 1。
| 表 1 97例SCT患者临床资料 Table 1 Clinical data of 97 cases |
|
|
依据Krickenbeck分类法对所有患者术后肛门直肠功能进行评估,其中13例(13.40%)发现肛门直肠功能障碍。Logistic回归分析结果显示,Altman分型、肿瘤体积、是否完整切除与肛门直肠功能恢复相关(P < 0.05)。而性别、术后9个月血清AFP水平、肿瘤性状和病理类型均不是肛门直肠功能障碍的危险因素(P>0.05)。见表 2。
| 表 2 SCT患者肛门直肠功能障碍影响因素的Logistic回归分析 Table 2 Multivariate Logistic regression analysis of prognostic factors of anorectal dysfunctions in SCT children |
|
|
Altman分型为Ⅰ型骶尾部畸胎瘤患者中,术后出现肛门直肠功能障碍和未出现肛门直肠功能障碍的患者比较,肿瘤体积差异没有统计学意义(P>0.05);Ⅱ型和Ⅲ型新生儿术后出现肛门直肠功能障碍和未出现肛门直肠功能障碍者比较,畸胎瘤体积差异具有统计学意义(P < 0.05)。见表 3。
| 表 3 不同分型及有不同肛门直肠功能障碍患者肿瘤体积的比较(cm,x±s) Table 3 Comparisons of tumor volumes for different types and presence oor absence of anorectal dysfunctions (cm, x±s) |
|
|
新生儿骶尾部畸胎瘤常以骶尾部肿块就诊,女性多见,多数属于良性,恶性少见[5, 6]。在本研究中,女性发病率为男性的2.23倍, 与文献报道一致。所有患者均行一期手术,手术日龄(21±5.4)d, 术后病理类型96.91%为良性。但文献报道部分畸胎瘤具有恶变倾向,且恶变倾向随着年龄增长而增加,所以确诊后应尽早手术[7]。
此外,畸胎瘤的生物学特征之一是可以产生甲胎蛋白(Alpha-fetoprotein,AFP),但并非所有畸胎瘤都产生甲胎蛋白[8]。良性畸胎瘤中约50%的患者甲胎蛋白阳性,在生后9个月内,新生儿存在AFP的生理性升高,所以术前AFP的鉴定并不准确[9]。
畸胎瘤手术后常见并发症包括切口感染、肠功能障碍、肿瘤复发等[10, 11]。切口感染是畸胎瘤手术后最常见的并发症。为减少切口感染,本研究中纳入的患者术后均采取俯卧位,可有效减少术后伤口感染的发生。术中常规留置胶管引流,加强患者伤口护理及加压,促进伤口内渗液引流,同时加强患者粪便的及时清理。但是,预防粪便污染的措施对降低术后伤口感染率并没有明显作用。针对该现象产生原因及预防对策的深入研究目前相对缺乏。良性肿瘤的复发原因可能与畸胎瘤的神经组织成分有关。本研究中患者均行尾骨切除,并尽可能完整切除肿瘤组织,对降低术后肿瘤复发率有明显作用。针对骶尾部畸胎瘤切除术后功能性后遗症(如肛门直肠功能障碍)的研究相对较少,且不同文献结论存在显著性差异。然而,骶尾部畸胎瘤术后肛门直肠功能障碍的发生率并不低, 在多中心研究中,约36%的新生儿术后会发生肠功能障碍,严重影响生活质量,甚至有持续到成年的可能[12]。我们观察到肛管直肠并发症的发生率高达33%,与Partridge[13]报道的发生率(35%)相似。
二、肛门直肠功能障碍畸胎瘤手术后肛门直肠功能障碍可能与肿瘤体积、肿瘤压迫导致神经丛受损、周围组织压迫牵拉及手术创伤等因素有关[14]。有文献报道,新生儿骶尾部畸胎瘤体积越大,Altman分型越复杂,越有可能对直肠后方及两侧区域造成长期挤压,进而影响直肠周围及盆底肌肉和神经的发育[15, 16]。然而,其他一些研究的结论并不支持Altman分型和手术后肛门直肠并发症的相关性[12, 17]。本文依据Krickenbeck分类法对所有患者进行肛门直肠功能评估,这是一种更科学、更标准的术后肛门直肠功能效果评价体系[11]。本研究发现,Altman分型、肿瘤体积、是否完整切除与肛门直肠功能障碍均存在很强的相关性,可作为直肠肛门功能障碍的预测因素。我们还观察到,在Ⅱ型和Ⅲ型患者中,术后出现肛门直肠功能障碍和未出现功能障碍者畸胎瘤体积大小存在差异,瘤体越大,肛门直肠功能障碍越明显,更加提示了肿块效应在骶尾部畸胎瘤肛门直肠功能并发症中所起的作用。这一现象的形成机制可能是:AltmanⅡ型、Ⅲ型畸胎瘤进行手术时,盆底肌肉受较大瘤体的压迫导致手术视野不清晰,术中容易受到损伤,使肛门直肠部位对排便的感知能力下降,从而造成不能完全控制排便或者排便完全失去控制,形成污粪[18]。所以,术中除完整切除瘤体外,应尽可能保护肛周、盆底的肌肉和神经,避免广泛分离;需要在瘤体移除后识别盆底肌肉并进行对位缝合,重建盆底肌群的正常结构,从而减少术后肛门直肠功能障碍等并发症的发生,同时术后应采取俯卧位减少切口感染的发生。这与Partridge等[13]所报道的Altman型可作为术后肛门直肠功能障碍的预测因子以及肿瘤体积可影响肛门直肠功能预后的结果一致。此外,Kremer等[18]认为,即使内部肿瘤体积不一定能预测肠功能性并发症,但对于大型肿瘤而言,手术切除时间越长,对排便的生理影响可能越大,进一步支持术前通过影像学诊断,明确对肿瘤分型、体积以及肿瘤与直肠等重要脏器位置关系的预判,制定详尽的手术计划,术中在尽可能保证完整切除的情况下注意对重要脏器及盆底神经肌肉的保护,避免过度清扫造成组织损伤,是改善患者远期排便功能和提高日后生活质量的关键。
早期发现肛门直肠功能障碍对预防长期功能性并发症具有特别重要的意义,早期引入科学的排便训练、术后肛周皮肤规范化护理和个体化饮食干预是优化这些患者预后的关键。我们认识到,科学的排便训练对改善长期肠道功能至关重要,建议采用大便软化剂以达到定期排便的目的。早期干预可达到控制排便的目的,可减少大便失禁造成的心理和社会负担,提高患者生活质量。然而,我们针对骶尾部畸胎瘤术后患者的随访平均时间为36个月,而肛门直肠功能障碍对患者的影响则可能是终身的。
综上,本次单中心回顾性研究的结果支持骶尾部畸胎瘤患者肛门直肠功能障碍的高发生率,并确定了Altman分型、肿瘤体积和术中残余肿瘤体积对手术后肛门直肠并发症具有重要预测价值,提供了一个新颖的预测工具来识别高危病人,同时实现术前对Altman分类、肿瘤体积和肿瘤位置关系的准确预判,可有效避免肿瘤生长、瘤体对盆底、肛门直肠周围组织及神经的压迫和侵犯,也可避免术中对重要组织脏器的损伤,并预防终末器官损害,改善患者的远期预后。
| [1] |
Yao W, Li K, Zheng S, et al. Analysis of recurrence risks for sacrococcygeal teratoma in children[J]. J Pediatr Surg, 2014, 49(12): 1839-1842. DOI:10.1016/j.jpedsurg.2014.09.036 |
| [2] |
Hambraeus M, Al-Mashhadi A, Wester T, et al. Functional outcome and health-related quality of life in patients with sacrococcygeal teratoma-a Swedish multicenter study[J]. J Pediatr Surg, 2019, 54(8): 1638-1643. DOI:10.1016/j.jpedsurg.2018.10.044 |
| [3] |
Altman RP, Randolph JG, Lilly JR. Sacrococcygeal teratoma:American Academy of Pediatrics Surgical Section Survey-1973[J]. J Pediatr Surg, 1974, 9(3): 389-398. DOI:10.1016/s0022-3468(74)80297-6 |
| [4] |
Holschneider A, Hutson J, Pena A, et al. Preliminary report on the International Conference for the Development of Standards for the Treatment of Anorectal Malformations[J]. J Pediatr Surg, 2005, 40(10): 1521-1526. DOI:10.1016/j.jpedsurg.2005.08.002 |
| [5] |
Huddart SN, Mann JR, Robinson K, et al. Sacrococcygeal teratomas:the UK Children's Cancer Study Group's experience.I.Neonatal[J]. Pediatr Surg Int, 2003, 19(1-2): 47-51. DOI:10.1007/s00383-002-0884-2 |
| [6] |
Van Mieghem T, Al-Ibrahim A, Deprest J, et al. Minimally invasive therapy for fetal sacrococcygeal teratoma:case series and systematic review of the literature[J]. Ultrasound Obstet Gynecol, 2014, 43(6): 611-619. DOI:10.1002/uog.13315 |
| [7] |
Frazier AL, Weldon C, Amatruda J. Fetal and neonatal germ cell tumors[J]. Semin Fetal Neonatal Med, 2012, 17(4): 222-230. DOI:10.1016/j.siny.2012.05.004 |
| [8] |
Barreto MW, Silva LV, Barini R, et al. Alpha-fetoprotein following neonatal resection of sacrococcygeal teratoma[J]. Pediatr Hematol Oncol, 2006, 23(4): 287-291. DOI:10.1080/08880010600629056 |
| [9] |
Berger M, Heinrich M, Lacher M, et al. Postoperative bladder and rectal function in children with sacrococcygeal teratoma[J]. Pediatr Blood Cancer, 2011, 56(3): 397-402. DOI:10.1002/pbc.22887 |
| [10] |
Buyukpamukcu M, Varan A, Kupeli S, et al. Malignant sacrococcygeal germ cell tumors in children:a 30-year experience from a single institution[J]. Tumori, 2013, 99(1): 51-56. DOI:10.1700/1248.13788 |
| [11] |
Sarbu I, Socolov D, Socolov R, et al. Hydrocephalus secondary to chemotherapy in a case of prenatally diagnosed giant immature grade 3 sacrococcygeal teratoma:A case report and literature review[J]. Medicine (Baltimore), 2016, 95(43): e5244. DOI:10.1097/md.0000000000005244 |
| [12] |
Derikx JP, Backer A, van de Schoot L, et al. Long-term functional sequelae of sacrococcygeal teratoma:a national study in the Netherlands[J]. J Pediatr Surg, 2007, 42(6): 1122-1126. DOI:10.1016/j.jpedsurg.2007.01.050 |
| [13] |
Partridge EA, Canning D, Long C, et al. Urologic and anorectal complications of sacrococcygeal teratomas:prenatal and postnatal predictors[J]. J Pediatr Surg, 2014, 49(1): 139-143. DOI:10.1016/j.jpedsurg.2013.09.042 |
| [14] |
Wang Y, Wu Y, Wang L, et al. Analysis of recurrent sacrococcygeal teratoma in children:Clinical features, relapse Risks, and anorectal functional sequelae[J]. Med Sci Monit, 2017, 23: 17-23. DOI:10.12659/msm.900400 |
| [15] |
王乐纯, 杨强, 马成海. 小儿骶尾部畸胎瘤的手术治疗[J]. 临床肿瘤学杂志, 2009, 14(3): 242-244. Wang LC, Yang Q, Ma CH. Experiences of surgical treatment of sacrococcygeal teratoma in children[J]. Journal of clinical oncology, 2009, 14(3): 242-244. DOI:10.3969/j.issn.1009-0460.2009.03.014 (in Chinese) |
| [16] |
Cost NG, Geller JI, Le LD, et al. Urologic co-morbidities associated with sacrococcygeal teratoma and a rational plan for urologic surveillance[J]. Pediatr Blood Cancer, 2013, 60(10): 1626-1629. DOI:10.1002/pbc.24627 |
| [17] |
Le LD, Alam S, Lim FY, et al. Prenatal and postnatal urologic complications of sacrococcygeal teratomas[J]. J Pediatr Surg, 2011, 46(6): 1186-1190. DOI:10.1016/j.jpedsurg.2011.03.045 |
| [18] |
Kremer ME, Derikx JP, van Baren R, et al. Patient-reported defecation and micturition problems among adults treated for sacrococcygeal teratoma during childhood-The need for new surveillance strategies[J]. Pediatr Blood Cancer, 2016, 63(4): 690-694. DOI:10.1002/pbc.25857 |
 2021, Vol. 20
2021, Vol. 20


