单独肝脏尾叶切除术可应用于转移性肝肿瘤、尾状叶肿瘤、肝脏良性病变、血管瘤、FNH以及肝腺瘤等部位的切除[1]。随着腹腔镜技术的发展(尤其是3D腹腔镜的应用),腹腔镜下肝尾叶切除术已经在国内大多数肝胆中心得到开展[2]。手术入路包括左侧入路、右侧背侧入路以及前入路(经肝入路)几种,目前国内少数医疗中心已开展经前入路肝正中裂劈开尾叶肿瘤切除术,但在儿童3D腹腔镜手术领域报道甚少[3]。笔者团队近期对1例累及腔静脉旁部的肝肿瘤患儿采用3D腹腔镜下前入路经肝正中裂劈开的手术方式,对肝尾状叶肿瘤进行切除,取得良好疗效,现报道如下。
材料与方法 一、一般资料患儿女,2岁,12 kg,因“上腹部疼痛1个月”入院,当地医院腹部B超检查提示肝脏各叶大小、形态正常,肝尾状叶可见一实性肿块,大小约6.0 cm×4.1 cm×5.0 cm,边界尚清,形态较规则,内回声尚均匀,于2019年12月23日以“肝尾状叶占位性病变”收入湖南省儿童医院治疗。既往无肝炎病史,查体可见腹部平软,右上腹有深压痛,未扪及明显包块,皮肤巩膜无黄染。血常规:RBC 4.5×1012/L,Hb 120 g/L,WBC 8.24×109/L,PLT 247×109/L。肝功能:ALT 30.5 U/L,AST 32.1 U/L,TB 6.6 μmol/L,DB 1.3 μmol/L,ALB 44.5 g/L。凝血功能:PT 14.1 s,乙肝五项阴性,AFP 4.04 μg/L,CEA 0.97 μg/L。肝功能评估为Child-Pugh分级A级。心脏超声提示卵圆孔未闭,心电图无异常。入院后患儿监护人签署由医院伦理委员批准的知情同意书,符合医学伦理学规定。
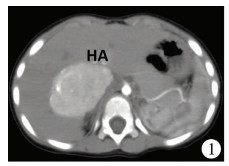
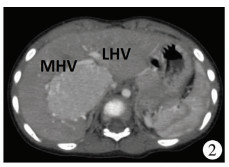
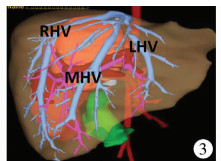
二、术前影像学评估完善影像学检查,CT见肝尾叶内巨大异常密度肿块影,大小约50 mm×45 mm×63 mm,边界较清楚,其内密度不均,未见钙化灶和脂肪灶,肿块上至右肝顶部,下至右肾前方。增强后动脉期肿块呈明显强化;静脉期强化程度略低于邻近肝实质,下腔静脉位于其后,与肿块分界较清晰,门静脉、下腔静脉受压变形(图 1、图 2)。本中心术前均完善基于增强CT数据的三维重建图像(图 3)。
|
图 1 肝尾状叶占位,动脉期强化 Fig.1 Space occupying lesion of caudate lobe of liver, arterial phase enhancement |
|
图 2 肿瘤前方上抬肝中静脉,静脉期强化减弱 Fig.2 Tumor anterior ascending MHV, the enhancement of venous phase is weakened |
|
图 3 三维重建图像显示肿瘤位置 Fig.3 3D reconstruction image showing tumor location |
五孔法建立操作空间,分别于剑突下置操作孔两个,脐部置观察孔一个,右上腹置操作孔两个。
二 肝周和尾状叶的游离超声刀离断肝圆韧带,分离镰状韧带至第二肝门。切断左右三角韧带,完全游离肝周直到暴露第二肝门肝静脉根部。将右肝向左侧翻转,电凝钩将右侧肾上腺与右肝分离,由下向上沿着下腔静脉右侧向头侧分离,Hem-o-lok结扎肝短静脉,超声刀离断Makuuchi韧带,直至完全暴露肝后下腔静脉的右侧壁和肝右静脉的汇入处。同法牵拉左三角韧带,翻转肝脏,离断Aruntius管,结扎下腔静脉右侧肝短静脉,暴露肝左静脉汇入下腔静脉处,使尾状叶和下腔静脉分离。
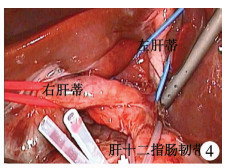
三 鞘外分离肝蒂,控制下腔静脉于第一肝门处下降肝门板,经正中分叉处鞘外分离,分别悬吊左右Glisson肝蒂,经文氏孔套带肝十二指肠韧带(图 4);于肝下下腔静脉、右肾静脉上方2 cm处将阻断带绕过下腔静脉,用于控制肝下下腔静脉的血流。
|
图 4 第一肝门鞘外分离套带技术 Fig.4 First porta sheath detachable cuff |
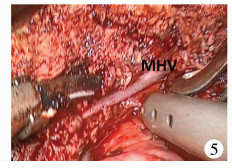
将胆囊游离,用腔镜“哈巴狗”钳阻断右侧Glisson肝蒂,出现的半肝缺血线和术中B超标记肝中静脉走行一致。沿标记线经胆囊床中点向头侧切开肝实质,遇肝中静脉末梢支后沿其左侧寻其主干,沿主干向头侧打开肝实质至肝中静脉汇入处(图 5)。紧贴肝中静脉下方向右侧分离肝实质至肝右静脉下方,于左肝断面肝中静脉水平方向,朝向Aruntius管方向分离肝实质。
|
图 5 循肝中静脉左侧劈开肝实质 Fig.5 Split the left side of the liver along the MHV |
经胆囊床向第一肝门正中点方向切开肝实质,当抵达肝门附近时,于左右Glisson鞘外分离,结扎离断尾叶Glisson鞘,将尾状叶与第一肝门完全分离。
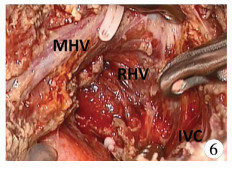
六 游离肝尾状叶,移除标本将右肝向左侧翻转,紧贴肝右静脉分离尾状叶,直至尾状叶与肝静脉完全分离。将肝右叶向左侧翻转,沿着肝左静脉的后壁离断尾状叶与左肝外叶之间的肝实质,移除尾状叶肿瘤。在肝断面上可以清楚地看到肝左静脉主干、肝右静脉主干(图 6)。双极电凝止血创面,B超监测入肝及出肝血流是否通畅。
|
图 6 肿瘤切除后显露肝中静脉、肝右静脉 Fig.6 Exposure of MHV and RHV after tumor resection |
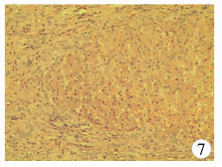
术中出血量200 mL,输同型浓缩红细胞1 U,患儿术后返回重症医学科治疗,术后第2天转回普通外科病房,恢复顺利,未发生出血或胆漏,B超监测肝血管血流通畅,于第13天痊愈出院。病理诊断检查结果示局灶结节性增生(图 7)。
|
图 7 病理切片:局灶结节性增生,MS(+),VG(+) Fig.7 Pathological:Focal nodular hyperplasia, MS(+), VG(+) |
尾状叶分为三个部分:Spiegelian叶、腔静脉旁部、尾状突三部分,在肝脏背面部分,以半环状包绕肝后下腔静脉。尾状叶位于肝内大血管之间,其后方是下腔静脉,下方是门管三联系统,上方是三支肝静脉至下腔静脉汇合处。尾状叶血流通过一系列肝短静脉回流至肝后下腔静脉[4, 5]。因此,尾状叶被重要的、术中易引发出血的血管结构所包绕,并且它深藏在肝脏的中心位置。由于其独特的解剖结构位置,尾状叶切除一直被认为是儿童肝胆外科技术上的一项挑战[6]。
一、前入路法手术适应证随着儿童腹腔镜肝切除技术的不断进步,腹腔镜肝叶切除已得到逐步开展和应用,目前国内外关于儿童3D腹腔镜肝尾状叶切除的报道极少[7]。针对尾状叶不同部位起源的肿瘤,可选择不同的手术路径。比如,Spiegelian叶肿瘤常采用左侧入路,尾状突肿瘤采用右侧入路,而针对Spiegelian叶和尾状突部位巨大肿瘤,有时为了更好的暴露常常需联合行肝叶切除[8-10]。而前入路法全尾叶切除的适应证则累及腔静脉旁部的肿瘤,手术过程中需劈开正中裂,暴露肿瘤,部分病例有时甚至需联合左右侧入路进行切除。
二、第一肝门肝蒂鞘外分离套带技巧腹腔镜肝切除多数需进行第一肝门的鞘外分离和套带,以利于手术操作。全尾状叶的切除则更需要进行此步骤。根据我中心腔镜肝切除经验,肝门板下降有助于左右肝蒂的鞘外分离套带,通常锐性剪开肝门板后,使用分离钳经第一肝门中点绕过肝蒂从尾状突处穿出,控制右侧肝蒂,朝向背裂左侧穿出则控制左侧肝蒂,此过程需注意经Glisson蒂主干发向尾状叶的分支,应选择避开,否则容易出血,且难以精准缝合。左右肝蒂的套带优势在于:其一可进行悬吊来处理第一肝门发向尾状叶的数支Glisson鞘,其二可阻断来判断半肝缺血线,其三在不影响全肝缺血时间的前提下,半肝血流阻断可大大减少术中出血[11]。
三、前入路法尾状叶的界限确定技巧儿童肝脏肿瘤较少合并乙肝肝硬化[12]。尾状突和Spiegelian叶大部分突出肝外,而腔静脉旁部被肝实质深藏其中,尤其与S7段的分界线在肝脏表面上没有任何解剖学标志[13]。此病例肿瘤主要位于腔静脉旁部,巨大且向上压迫肝右和肝中静脉,想要进行安全的肝切除,如何保护肝静脉不损伤出血以及肿瘤边界的界定是两个关键点。经前入路法可选择保留胆囊,胆囊的保留对于儿童肝脏手术第一肝门鞘外分离影响不大,且保留了胆汁的浓缩和储存功能。我们的体会是经胆囊床中点位置,超声刀切开肝实质,寻找出肝中静脉末梢支,循支而定其主干,沿半肝缺血线打开肝实质至肝中静脉水平面,结扎肝中静脉的左侧汇入静脉支,紧贴左侧壁分离至第二肝门,获得与S4切除相近的手术视野。Spiegelian叶因向左侧游离,界限较易确定,经肝中静脉水平面向左侧分离,方向朝向Aruntius管。而右侧尾状叶因无明显解剖学标志,难以确定界限。日本学者提出经门静脉右后支穿刺染色S6、S7,来确定腔静脉旁部的界线,但在儿童腹腔镜肝脏手术中,操作复杂,配合腔镜B超进行穿刺较困难[14, 15];国内有学者[16]采用阻断右肝后叶Glisson鞘显示缺血线来判断与尾状叶分界线,但若遇尾状叶的蒂经右后叶蒂发出的病例,我们认为即使阻断后也难以判断界限,通常的做法是紧帖在肝中静脉后壁向右侧分离,暴露肝右静脉后壁后向尾状突与右肝交汇点分离。在儿童肝切除术中,靠近第二肝门的肝中、右静脉距离较近,分离时需注意辨清识别。通过向头侧悬吊左右两侧Glisson鞘,在其后方可轻松结扎离断尾状叶的Glisson鞘,将尾状叶下端完全游离,最后分离肿瘤与下腔静脉前壁粘连,完整切除肝尾状叶[17]。
四、腹腔镜肝切除的特点儿童腹腔镜肝尾状叶切除手术要求手术团队具备熟练的开腹肝尾状叶切除技术及儿童腹腔镜操作技术,且有长期默契的配合经验。Trocar位置的选择要考虑到能够更好地从两侧游离肝周围韧带和第一、第二肝门位置的处理。手术中重视肝脏的翻转和肿瘤的解剖显露方法,儿童肝脏质地柔软,易于翻转和牵拉,有助于术野的暴露,操作过程中应注意防止肝组织人为损伤。术中出血是腹腔镜肝脏手术难点之一,也是中转开腹最常见的原因。我们的经验提示,创面渗血多可用双极电凝配合吸引器止血,肝静脉属支出血可使用5 - 0 Prolene线缝扎或结扎夹处理,肝静脉主干或下腔静脉主干的出血,建议采用Prolene线精确缝合。其次在减少术中出血的方面,我们常采用第一肝门阻断或行区域性半肝血流阻断,减少全肝缺血时间。联合麻醉师药物控制低中心静脉压或改变患儿体位来降低CVP减少肝静脉出血。3D腹腔镜具有立体放大视角的功能,在切除尾状叶的“隧道术野”中操作有一定优势,能够给术者和助手很好的层次感和纵深感,感受深度和周围的结构距离,在肝后下腔静脉前方处理可避免对肝脏的多翻转和游离。腔镜独特视野使肝实质离断和肝血管与Glisson鞘缝合更加精细和精准,有效减少了术中出血,缩短手术时间,降低术后胆漏发生率。其次3D腹腔镜手术Trocar切口小,对腹腔内环境干扰破坏小,可明显缩短患儿术后康复时间[18, 19]。
术后应观察引流管引流液的量和性状,注意胆漏的发生。早期B超监测入肝血流及出肝血流通畅情况,防止肝蒂的损伤。监测S4血液回流和肝实质回声变化,离断肝S4汇入肝中静脉的V4后,回流主要依靠叶间裂静脉和肝左静脉代偿[20]。术后B超监测数据提示S4段有不同程度的淤血改变,主要取决于叶间裂静脉和肝左静脉属支是否属于优势支,但短期内多数可以代偿,S4的肝功能几乎没有丧失。
综上所述,针对儿童肝尾状叶肿瘤(尤其是位于腔静脉旁部的巨大肿瘤),在严格掌握手术适应证、充分的围手术期准备、术中有效的显露分离和精准的出血控制、手术团队的配合和体位入路(布孔)设计的条件下,采用3D腹腔镜下前入路经肝正中裂劈开肝尾状叶切除术是腹腔镜下尾状叶肿瘤切除一种有效手术入路。
| [1] |
Abdalla EK, Vauthey JN, Couinaud C. The caudate lobe of the liver:implications of embryology and anatomy for surgery[J]. Surg Oncol Clin N Am, 2002, 11(4): 835-848. DOI:10.1016/s1055-3207(02)00035-2 |
| [2] |
Liu P, Qiu BA, Bai G, et al. Choice of approach for hepatectomy for hepatocellular carcinoma located in the caudate lobe:isolated or combined lobectomy?[J]. World J Gastroenterol, 2012, 18(29): 3904-3909. DOI:10.3748/wjg.v18.i29.3904 |
| [3] |
Abu Hilal M, Aldrighetti L, Dagher I, et al. The Southampton consensus guide-lines for laparoscopic liver surgery:from indication to implementation[J]. Ann Surg, 2018, 268(1): 11-18. DOI:10.1097/SLA.0000000000002524 |
| [4] |
Higaki T, Takayama T, Midorikawa Y. Ventral approach for resecting hepato-cellular carcinoma in the caval portion of the caudate lobe[J]. Surgery, 2018, 163(6): 1245-1249. DOI:10.1016/j.surg.2018.01.002 |
| [5] |
Hawkins WG, DeMatteo RP, Cohen MS, et al. Caudate hepatectomy for cancer:a single institution experience with 150 patients[J]. J Am Coll Surg, 2005, 200(3): 345-352. DOI:10.1016/j.jamcollsurg.2004.10.036 |
| [6] |
Araki K, Fuks D, Nomi T, et al. Feasibility of laparoscopic liver resection for caudate lobe:technical strategy and comparative analysis with anteroinferior and posterosuperior segments[J]. Surg Endosc, 2016, 30(10): 4300-4306. DOI:10.1007/s00464-016-4747-7 |
| [7] |
郑百俊, 程继文, 高亚, 等. 腹腔镜肝切除术与开腹肝切除术治疗肝母细胞瘤的临床效果比较[J]. 临床小儿外科杂志, 2019, 18(11): 935-940. Zheng BJ, Chen JW, Gao Y, et al. Safety, feasibility and short-term outcome of laparoscopic liver resection versus open liver resection for hepatoblastoma[J]. J Clin Sur, 2019, 18(11): 935-940. DOI:10.3969/j.issn.1671-6353.2019.11.008 (in Chinese) |
| [8] |
De Lu C, Huang J, Wu SD, et al. Total hilar en bloc resection with left hemihepatectomy and caudate lobectomy:a novel approach for treatment of left-sided perihilar cholangiocarcinoma (with video)[J]. J Gastrointest Surg, 2017, 21(11): 1906-1914. DOI:10.1007/s11605-017-3561-4 |
| [9] |
Jin Y, Wang L, Yu YQ, et al. Anatomic isolated caudate lobectomy:is it possible to establish a standard surgical flow?[J]. World J Gastroenterol, 2017, 23(41): 7433-7439. DOI:10.3748/wjg.v23.i41.7433 |
| [10] |
Shindoh J, Mise Y, Satou S, et al. The intersegmental plane of the liver is not always flat-tricks for anatomical liver resection[J]. Ann Surg, 2010, 251(5): 917-922. DOI:10.1097/SLA.0b013e3181d773ae |
| [11] |
袁妙贤, 尹强, 刘朝阳. 肝脏中叶切除术治疗小儿肝脏肿瘤的疗效与安全性分析[J]. 临床小儿外科杂志, 2019, 18(10): 859-863. Yuan MX, Yin Q, Liu CY. Experience of mesohepatectomy in the treatment of hepatic tumors in children[J]. J Clin Sur, 2019, 18(10): 859-863. DOI:10.3969/j.issn.1671-6353.2019.10.012 (in Chinese) |
| [12] |
Dutta S, Nehra D, Woo R, et al. Laparoscopic resection of a benign liver tumor in a child[J]. J Pediatr Surg, 2007, 42(6): 1141-1145. DOI:10.1016/j.jpedsurg.2007.01.045 |
| [13] |
Kogure K, Kuwano H, Yorifuji H, et al. The caudate processus hepatic vein:a boundary hepatic vein between the caudate lobe and the right liver[J]. Ann Surg, 2008, 247(2): 288-293. DOI:10.1097/SLA.0b013e31815efd8d |
| [14] |
Wang XY, Gao Q, Zhu XD, et al. Laparoscopic anatomical hepatectomy with ICG fluorescence staining by lap-ultrasound and 3D visualization guided portal branch puncture approach[J]. HPB, 2019, 21(Supl.2). DOI:10.1016/j.hpb.2019.10.1818 |
| [15] |
彭宇明, 尹强, 高红强, 等. 吲哚菁绿荧光染色引导下解剖性右半肝切除治疗儿童肝脏肿瘤[J]. 临床小儿外科杂志, 2018, 17(8): 597-599. Peng YM, Yin Q, Gao HQ, et al. Anatomic right-half of indocyanine green fluorescent staining hepatectomy for children with liver tumors[J]. J Clin Ped Sur, 2018, 17(8): 597-599. DOI:10.3969/j.issn.1671-6353.2018.08.010 (in Chinese) |
| [16] |
骆乐, 吴泓, 黄纪伟, 等. 腹腔镜单纯肝尾状叶切除经验总结[J]. 中华肝脏外科手术学电子杂志, 2019, 8(4): 311-314. Luo L, Wu H, Huang JW, et al. Experience of laparoscopic caudate lobe resection[J]. Chinese Journal of Hepatic Surgery, 2019, 8(4): 311-314. DOI:10.3877/cma.j.issn.2095-3232.2019.04.008 (in Chinese) |
| [17] |
彭淑牖, 洪德飞, 许斌, 等. 经正中裂入路单独完整肝尾状叶切除术的策略探讨(附19例报告)[J]. 中华外科杂志, 2007, 45(19): 1321-1314. Peng SY, Hong DF, Xu B, et al. The strategy of isolated complete resection of the caudate lobe of the liver through the anterior liversplitting approach:a report of 19 cases[J]. Chinese Journal Of Surgery, 2007, 45(19): 1321-1314. DOI:10.3760/j.issn:0529-5815.2007.19.009 (in Chinese) |
| [18] |
Cipriani F, Ratti F, Cardella A, et al. Laparoscopic Versus Open Major Hepatectomy:Analysis of Clinical Outcomes and Cost Effectiveness in a High-Volume Center[J]. J Gastrointest Surg, 2019, 23(11): 2163-2173. DOI:10.1007/s11605-019-04112-4 |
| [19] |
Kumon M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application[J]. Liver Cancer, 2017, 6(2): 161-170. DOI:10.1159/000454682 |
| [20] |
Hibi T, Kitagawa Y. Laparoscopic liver resection for hepatocellular carcinoma in cirrhotic patients:a potential game changer toward global standardization of care[J]. Hepatobiliary Surg Nutr, 2017, 6(3): 203-204. DOI:10.21037/hbsn.2017.04.02 |
 2020, Vol. 19
2020, Vol. 19


