国际儿童尿控协会(International Children's Continence Society,ICCS)定义的逼尿肌过度活跃(detrusor overactivity,DO)是指在膀胱充盈过程中逼尿肌出现压力大于15 cm H2O的不自主收缩,可导致尿频、尿急及尿失禁等下尿路症状(lower urinary tract symptoms,LUTS)。有神经疾患称神经源性DO,非神经源性即特发性DO,是有创尿动力学检查中膀胱充盈期的异常表现,可用于尿动力学诊断[1]。无创尿流率测定是LUTS患儿首选检查,可协助诊断潜在的下尿路功能异常(lower urinary tract dysfunction,LUTD),以避免有创尿动力学检查,同步盆底肌电图的应用范围也在扩大[2]。盆底肌电图分针刺与体表两种,体表盆底肌电图为无创性,通常用于无创尿流率测定与有创尿动力学检查中[3]。本院有创尿动力学检查常规采用经尿道置管膀胱测压,根据我们的临床实践经验,尽管充分解释、心理沟通及使用局部麻醉药能够在一定程度上减轻插管造成的不适感,但患儿对有创尿动力学检查仍有抵触、恐惧心理,导致有创尿动力学检查费时、费力,甚至失败[4, 5]。无创尿流率/盆底肌电图测定相比则具有患儿配合度高、省时省力的优点,但目前无创盆底肌电图在临床的应用仍有限,因此,本研究通过分析本院泌尿外科门诊非神经性LUTD患儿尿动力学检查结果,以经尿道置管膀胱测压检查结果为诊断金标准,旨在明确无创尿流率/盆底肌电图测定中缩短的盆底肌电图滞后时间对儿童特发性DO的诊断价值,以期减少此类患儿的有创尿动力学检查次数。
材料与方法 一、研究对象收集2017年12月至2019年12月因LUTS就诊于我院,并于泌尿外科门诊尿动力室同时行无创尿流率/盆底肌电图测定、经尿道置管膀胱测压尿动力学检查的病例。排除有神经疾患、下尿路解剖异常、多动症、抽动症、智力障碍及使用抗胆碱药物治疗的病例;包茎、尿道口狭窄的男性病例;排尿时盆底肌电图提示盆底肌收缩的病例;盆底肌电图图像因伪影干扰无法准确读数的病例;资料记录不全的病例。最终纳入非神经性LUTD患儿69例并回顾性分析其尿动力学检查结果。其中男50例,女19例,年龄3.0~13.0岁,平均(8.40±2.21)岁。请一名对无创尿流率/盆底肌电图测定中盆底肌电图滞后时间结果未知,经验丰富的泌尿外科主任医师,根据患儿经尿道内置管膀胱测压检查时膀胱充盈期和排尿期表现及开放时间作出DO诊断,并以此为金标准,根据是否存在DO分为DO组(31例)与非DO组(38例)。再由另一名对膀胱充盈期结果未知且经验丰富的泌尿外科主任医师根据无创尿流率/盆底肌电图测定中的盆底肌电图滞后时间(<2 s)作出DO诊断。考虑患儿排尿时尿流出尿道口至尿流率计的时间大约为1 s,因此计算开放时间及盆底肌电图时间时,在读图基础上减去1 s。研究者根据两位医师的诊断结果,研究无创尿流率/盆底肌电图测定中盆底肌电图替代有创尿动力检查诊断儿童特发性DO的可能性,评估两种诊断方法的一致性以及盆底肌电图滞后时间诊断的敏感性和特异性,并比较两组主要尿动力学参数。
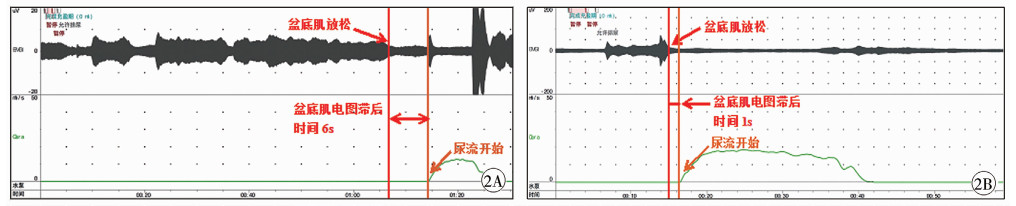
正常排尿过程中,盆底肌放松和逼尿肌自主收缩几秒之后尿流开始,逼尿肌自主收缩开始到尿流开始的时间为开放时间(opening time)。依据开放时间这一概念,Combs等提出盆底肌电图滞后时间(pelvic floor electromyographic lag time),即盆底肌放松到尿流开始的时间(图 1)。特发性DO患儿在无创尿流率/盆底肌电图测定中表现为盆底肌电图滞后时间缩短(正常范围:2 s~6 s)且排尿时盆底肌安静(图 2)。

|
图 1 非DO/DO患儿经尿道置管膀胱压力测定曲线图 1A:非DO患儿,男,6岁,尿频伴漏尿20 d,充盈期膀胱逼尿肌稳定,排尿时盆底肌安静,盆底肌电图滞后时间2 s,开放时间5 s;1B:DO患儿,男,4岁,尿频尿急伴夜间遗尿,充盈期膀胱逼尿肌不稳定,排尿时盆底肌安静,盆底肌电图滞后时间0 s,开放时间0 s Fig.1 1A:Curve of transurethral catheter cystometry of children without DO; 1B:Curve of transurethral catheter cystometry of children with DO |
|
图 2 非DO/DO患儿无创尿流率/盆底肌电图测定曲线图 2A:非DO患儿,男,6岁,尿频伴漏尿,排尿时盆底肌安静,盆底肌电图滞后时间6 s 2B:DO患儿,男,7岁,尿频伴尿失禁,排尿时盆底肌安静,盆底肌电图滞后时间1 s Fig.2 2A:Curve of noninvasive uroflowmetry/pelvic floor EMG of children without DO; 2B:Curve of noninvasive uroflowmetry/pelvic floor EMG of children with DO |
采用荷兰MMS(Medical Measurement Systems)尿动力仪,型号Sloar blus,配套MMS Stationary Mea-surement & Analysis Software软件,版本9.3q(December 11,2014)。
三、尿动力学检查方法及测量参数参照ICCS尿动力学检查标准方法,对已进行排尿训练并能自主排尿的患儿进行无创尿流率/盆底肌电图测定、经尿道置管膀胱压力测定(充盈期膀胱压力测定、排尿期压力-流率测定、尿道压力测定)[1, 6]。①常规检查前准备:病史采集、体格检查、辅助检查等资料收集;告知患儿及家长检查目的、过程,取得家长及患儿的理解同意与配合;同期进行肠道准备。②无创尿流率/同步盆底肌电图测定:检查前嘱患儿适量饮水,待出现强烈尿意时,于肛周3点、9点位置及大腿前侧各贴1枚体表电极片,患儿取舒适体位排尿,记录最大尿流率、平均尿流率、尿量、尿流时间、尿流曲线、盆底肌电活动情况,计算盆底肌电图滞后时间。③残余尿量测定:经尿道留置双腔测压管,经肛门留置腹压测压管,抽出膀胱残余尿量并记录。④充盈期膀胱压力测定:患儿取坐位,灌注37℃左右生理盐水,记录膀胱顺应性、膀胱感觉、有效膀胱容量、有无逼尿肌收缩、有无漏尿。⑤排尿期压力-流率测定:灌注停止后嘱患儿排尿,记录排尿期最大逼尿肌压力、盆底肌电活动情况、有无腹压参与排尿,计算开放时间。⑥尿道压力测定:抽出膀胱残余尿液后,再行尿道压力测定,记录最大静态尿道压、最大尿道闭合压。
四、定义及标准[1, 7]① ICCS定义的特发性DO:有创尿动力学检查中膀胱充盈期出现逼尿肌大于15 cm H2O的不自主收缩,非神经源性因素所致称特发性DO。②无创尿流率/盆底肌电图测定中儿童LUTD诊断(无神经疾患或泌尿系解剖异常):特发性逼尿肌过度活跃(idiopathic detrusor overactivity disorder,IDOD),与DO有关的持续性LUTS,盆底肌电图滞后时间缩短,排尿时盆底肌安静。③最大尿流率:排尿过程中测得尿流率最大值。④膀胱顺应性:描述膀胱容积变化与逼尿肌压力变化之间的关系,用膀胱容积变化值除以逼尿肌压力变化值,< 20 mL/cm H2O为降低。⑤最大膀胱测压容积:膀胱充盈过程中患儿无法再延迟排尿时的膀胱容积。⑥钟形尿流曲线:正常尿流曲线呈钟形,其余均为异常尿流曲线(包括staccato曲线、低平曲线、间断曲线、塔形曲线)。
五、统计学分析采用SPSS23.0进行统计学分析,正态分布数据以(x±s)表示,采用两独立样本t检验进行组间比较;非正态分布数据以M(P25,P75)表示,采用两独立样本非参数检验进行组间比较;计数资料采用χ2检验进行组间比较;采用Kappa检验进行一致性检验(Kappa值结果判定:>0.8判定为一致性非常好;0.6~0.8判定为一致性较好;0.41~0.6判定为一致性中等;0.21~0.4判定为一致性勉强可接受;< 0.2判定为几乎没有一致性),采用Spearman相关进行相关性分析。ROC曲线绘制采用Medcac 19.0。Spearman相关分析中P < 0.01认为差异有统计学意义,其余情况下P < 0.05认为差异有统计学意义。
结果 一、盆底肌电图滞后时间与经尿道置管膀胱测压诊断结果的比较以经尿道置管膀胱测压检查充盈期检查结果为诊断DO的金标准,无创尿流率/盆底肌电图测定中缩短的盆底肌滞后时间(< 2 s判定为阳性)诊断敏感性为93.5%(29/31),特异性为63.2%(24/38),准确性为76.8%(53/69),阳性预测值为67.4%(29/43),阴性预测值为92.3%(24/26),阳性似然比为2.54,阴性似然比为0.10(表 1)。Kappa值=0.548,遂认为两种诊断方法得到的结果具有中等一致性(P < 0.001)。
| 表 1 缩短的盆底肌电图滞后时间与经尿道置管膀胱测压诊断结果的比较 Table 1 Comparison between the results of short pelvic floor EMG lag time and transurethral catheter cystometry |
|
|
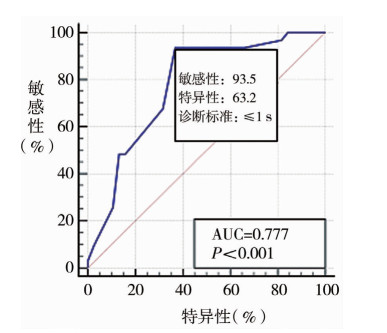
盆底肌电图滞后时间诊断儿童特发性DO的ROC曲线见图 3,最佳诊断标准为滞后时间≤1 s,该诊断标准对应的敏感性为93.5%,特异性为63.2%。曲线下面积(AUC)=0.777,≤1 s的盆底肌电图滞后时间对儿童特发性DO具有中等诊断价值(P < 0.01)。
|
图 3 盆底肌电图滞后时间诊断儿童特发性DO的ROC曲线 Fig.3 ROC curve of pelvic floor EMG lag time in the diagnosis of pediatric idiopathic DO |
本组共纳入以下尿路症状就诊的LUTD患儿69例,其中男50例,年龄3.0~12.2岁,平均(8.21±2.16)岁;女19例,年龄4.6~13.0岁,平均(8.91±2.32)岁。DO组与非DO组之间性别、年龄、最大尿流率、膀胱顺应性降低发生率、钟形尿流曲线比例的分布情况差异无统计学意义。DO组最大膀胱测压容积明显低于非DO组(t=5.299,P < 0.001),无创尿流率/盆底肌电图测定结果中的盆底肌电图滞后时间、开放时间均明显短于非DO组(P < 0.001),见表 2。
| 表 2 DO组与非DO组主要尿动力学表现 Table 2 Major urodynamic parameters of DO and non-DO groups |
|
|
根据目前ICCS的定义,儿童特发性DO只能通过充盈期膀胱测压检查结果作出诊断,此为有创尿动力学检查。DO常与膀胱过度活动症(overactive bladder,OAB)相联系。OAB临床常见,会对患儿的生活质量造成负面影响,主要表现为尿急,通常伴有尿频和夜尿症,伴或不伴尿失禁,无尿路感染或其他明显病理特征,OAB儿童通常有DO。OAB为症状诊断,只要患儿存在主观尿急,无论是否存在DO,均可诊断为OAB[8]。有人认为OAB的非手术和外科治疗的成功并不取决于是否可通过尿动力学检查发现DO的存在,遂不推荐常规尿动学检查[9]。但OAB病因多样,除DO外,许多患者可能表现为膀胱颈功能障碍、外括约肌协调失调[10]。因此,根据尿动力学检查结果可以明确引起OAB尿动力学异常表现的原因,从而指导治疗。无创尿流率/盆底肌电图评价儿童盆底肌和外尿道括约肌活动的重要性与日俱增,无创体表盆底肌电图已被证明在儿童排尿功能障碍中是适用并且可解释的,但在泌尿外科患儿中的应用尚未普及[11]。研究发现无创尿流率/盆底肌电图测定中盆底肌电图滞后时间可用于诊断PBND并监测疗效[4, 12, 13]。进一步研究发现,在大多数存在LUTS和排尿时盆底肌安静的儿童中,盆底肌电图滞后时间能可靠地诊断儿童特发性DO。他们发现,以0 s及以下的盆底肌电图滞后时间作为筛检标准时间对诊断DO具有100%的特异性和70%的敏感性(如果以少于2 s作为筛检标准,则敏感性为88%),最终患儿均可诊断为IDOD[14]。为了进一步证实无创盆底肌电图对儿童特发性DO的诊断价值,我们纳入神经、泌尿系解剖正常的患儿进行研究。盆底肌电图可记录患儿排尿时盆底肌电活动,机能失调性排尿(dysfunctional voiding,DV)患儿排尿时盆底肌收缩,和DO属于两种不同的下尿路异常表现,而非彼此的过渡阶段,且治疗方法不同,因此本研究未纳入DV患儿[15]。最终发现,无创尿流率/盆底肌电图测定中盆底肌电图滞后时间最佳诊断标准为≤1 s,此标准下诊断敏感性为93.5%,特异性为63.2%,ROC曲线下面积为0.777,说明缩短的盆底肌电图滞后时间对儿童特发性DO诊断价值良好,且缩短的盆底肌电图滞后时间与经尿道置管膀胱测压诊断儿童特发性DO一致性良好(Kappa=0.548)。无创尿流率/盆底肌电图测定较有创尿动力学检查简单易行,但结果仍可能受外界因素干扰,包括噪音、患儿哭闹、移动、尿液沾湿电极片等,虽然我们已排除检查时伪影干扰读数的病例,但仍有可能对结果造成影响,导致本研究结果的特异性较低。因此,并非所有盆底肌电图滞后时间缩短的患儿均存在DO,应结合患儿病史、检查时情况和监测疗效综合考虑,避免误诊。≤1 s的盆底肌电图滞后时间能将DO患儿较为准确地识别出来,漏诊率低。Combs等[16]的团队随后研究发现,盆底肌电图滞后时间还可作为客观监测治疗反应的替代指标。DO患儿经有效治疗后,盆底肌电图滞后时间和膀胱容量恢复正常。随着盆底肌电图研究不断深入,无创尿流率/盆底肌电图测定中的盆底肌电图滞后时间结合排尿时盆底肌电活动情况还可诊断机能失调性排尿(dysfunctional voiding,DV)、逼尿肌利用不足症(detrusor underutilization disorder, DUD)及原发性膀胱颈功能障碍(primary bladder neck dysfunction,PBND)[17]。因此我们认为,对于排尿时盆底肌安静的特发性DO患儿,无创尿流率结合同步体表盆底肌电图测定结果可作为初步诊断工具,有替代有创尿动力学检查识别特发性DO患儿的可能,但应结合患儿病史、检查时情况及监测疗效综合评估,以避免误诊。检查时应注意患儿的配合及周围环境因素,避免出现伪影干扰读数。
比较两组主要尿动力学参数发现,DO组无创尿流率/盆底肌电图测定中的盆底肌电图滞后时间、开放时间均明显短于非DO组,这个发现印证了我们采用缩短的盆底肌电图时间来诊断DO的合理性。此外,DO组最大膀胱测压容积明显低于非DO组,DO可导致患儿膀胱容量下降。尿急感促使患儿习惯性保持防止尿液渗漏的体位,导致逼尿肌肥大,也可导致膀胱容量降低,并且膀胱容量随LUTS复杂而降低[18]。膀胱容量降低的患儿较容量正常的患儿而言,对泌尿治疗的反应较差[19]。因此,应根据尿动力学检查结果及时调整治疗方案。DO患儿采用行为、饮食治疗失败后,可口服抗胆碱药、β-3受体激动剂,若口服药物症状无改善,再考虑微创性治疗(如逼尿肌内注射肉毒杆菌毒素A、骶神经刺激、胫后神经刺激等),最后选择泌尿外科手术治疗(如膀胱成形术、尿流改道术等)[20]。
本研究虽然基本达到了预期研究目的,但存在以下局限:①无法结合患儿检查时盆底肌电活动的具体情况考虑盆底肌电图滞后时间;②可能存在选择偏倚;③盆底肌电图检查受限于尿动力仪本身,对图形可能产生影响;④需要更多病例的随机对照试验证明我们的结论。此外,本研究对象均为治疗前LUTD患儿,后续我们将进一步研究此类患儿治疗后相关尿动力学指标的变化。
综上,无创尿流率结合同步体表盆底肌电图测定中缩短的盆底肌电图滞后时间诊断儿童特发性DO特异性高,可用于DO患儿筛查,应用前景广泛,但应结合患儿病史、检查时情况及监测疗效避免误诊。DO患儿盆底肌电图滞后时间、开放时间明显短于非DO组,最大膀胱测压容积明显低于非DO组,尿动力学指标可指导治疗和监测疗效。
| [1] |
Austin PF, Bauer SB, Bower W, et al. The standardization of terminology of lower urinary tract function in children and adolescents:Update report from the standardization committee of the International Children's Continence Society[J]. Neurourol Urodyn, 2016, 35(4): 471-481. DOI:10.1002/nau.22751 |
| [2] |
Van Batavia JP, Combs AJ. The role of non-invasive testing in evaluation and diagnosis of pediatric lower urinary tract dysfunction[J]. Curr Urol Rep, 2018, 19(5): 34. DOI:10.1007/s11934-018-0784-1 |
| [3] |
Krhut J, Zachoval R, Rosier PF WM, et al. ICS Educational Module:Electromyography in the assessment and therapy of lower urinary tract dysfunction in adults[J]. Neurourol Urodyn, 2017, 37(1): 27-32. DOI:10.1002/nau.23278 |
| [4] |
Combs AJ, Grafstein N, Horowitz M, et al. Primary bladder neck dysfunction in children and adolescents I:pelvic floor electromyography lag time-a new noninvasive method to screen for and monitor therapeutic response[J]. J Urol, 2005, 173(1): 207-211. DOI:10.1097/01.ju.0000147269.93699.5a |
| [5] |
Glassberg KI, Combs AJ, Horowitz M. Nonneurogenic voiding disorders in children and adolescents:clinical and videourodynamic findings in 4 specific conditions[J]. J Urol, 2010, 184(5): 2123-2127. DOI:10.1016/j.juro.2010.07.011 |
| [6] |
Drzewiecki BA, Bauer SB. Urodynamic testing in children:indications, technique, interpretation and significance[J]. J Urol, 2011, 186(4): 1190-1197. DOI:10.1016/j.juro.2011.02.2692 |
| [7] |
Van Batavia JP, Combs AJ, Hyun G, et al. Simplifying the diagnosis of 4 common voiding conditions using uroflow/electromyography, electromyography lag time and voiding history[J]. J Urol, 2011, 186(4 Suppl): 1721-1726. DOI:10.1016/j.juro.2011.04.020 |
| [8] |
Dmochowski RR, Gomelsky A. Update on the treatment of overactive bladder[J]. Curr Opin Urol, 2011, 21(4): 286-290. DOI:10.1097/MOU.0b013e3283468da3 |
| [9] |
Rovner ES, Goudelocke CM. Urodynamics in the evaluation of overactive bladder[J]. Curr Urol Rep, 2010, 11(5): 343-347. DOI:10.1007/s11934-010-0130-8 |
| [10] |
Franco I. Overactive bladder in children.Part 2:Management[J]. J Urol, 2007, 178(3 Pt 1): 769-774. DOI:10.1016/j.juro.2007.05.076 |
| [11] |
Pekbay Y, Ergin O, Topuz B, et al. The effects of pelvic floor muscle therapy on symptoms, voiding, and pelvic floor muscle activity parameters in children with overactive bladder[J]. Neurourol Urodyn, 2019, 38(5): 1430-1442. DOI:10.1002/nau.24007 |
| [12] |
Donohoe JM, Combs AJ, Glassberg KI. Primary bladder neck dysfunction in children and adolescents II:results of treatment with alpha-adrenergic antagonists[J]. J Urol, 2005, 173(1): 212-216. DOI:10.1097/01.ju.0000135735.49099.8c |
| [13] |
Van Batavia JP, Combs AJ, Horowitz M, et al. Primary bladder neck dysfunction in children and adolescents III:results of long-term alpha-blocker therapy[J]. J Urol, 2010, 183(2): 724-730. DOI:10.1016/j.juro.2009.10.032 |
| [14] |
Combs AJ, Van Batavia JP, Horowitz M, et al. Short pelvic floor electromyographic lag time:a novel noninvasive approach to document detrusor overactivity in children with lower urinary tract symptoms[J]. J Urol, 2013, 189(6): 2282-2286. DOI:10.1016/j.juro.2013.01.011 |
| [15] |
Glassberg KI, Van Batavia JP, Combs AJ. Can children with either overactive bladder or dysfunctional voiding transition from one into the other:Are both part of a single entity?[J]. J Pediatr Urol, 2016, 12(4): 211-217. DOI:10.1016/j.jpurol.2016.05.024 |
| [16] |
Van Batavia JP, Combs AJ, Glassberg KI. Short pelvic floor EMG lag time II:use in management and follow-up of children treated for detrusor overactivity[J]. J Pediatr Urol, 2014, 10(2): 255-261. DOI:10.1016/j.jpurol.2013.10.013 |
| [17] |
Van Batavia JP, Combs AJ, Fast AM, et al. Use of non-invasive uroflowmetry with simultaneous electromyography to monitor patient response to treatment for lower urinary tract conditions[J]. J Pediatr Urol, 2014, 10(3): 532-537. DOI:10.1016/j.jpurol.2013.11.015 |
| [18] |
Van Batavia JP, Combs AJ, Fast AM, et al. Overactive bladder (OAB):A symptom in search of a disease-Its relationship to specific lower urinary tract symptoms and conditions[J]. J Pediatr Urol, 2017, 13(3): 271-277. DOI:10.1016/j.jpurol.2017.02.010 |
| [19] |
Wei C, Gao J, Kou L, et al. Can Urodynamic Findings of Overactive Bladder Determine the Treatment Effect of Urotherapy in Children?[J]. J Coll Physicians Surg Pak, 2020, 30(1): 41-45. DOI:10.29271/jcpsp.2020.01.41 |
| [20] |
Chermansky C, Schurch B, Rahnama'I MS, et al. How can we better manage drug-resistant OAB/DO? ICI-RS2018[J]. Neurourol Urodyn, 2019, 38(supp15): S46-S55. DOI:10.1002/nau.24055 |
 2020, Vol. 19
2020, Vol. 19


