骨髓炎是由细菌感染骨髓、骨皮质和骨膜引起的炎症性疾病, 急性起病时表现为高热、局部红肿热痛, 转为慢性骨髓炎时局部溃破、流脓、有死骨或空洞形成。治疗上急性期以应用足量敏感的抗生素、脓肿形成时切开引流为主; 慢性期以手术清除死骨为主, 辅以敏感抗生素治疗。万古霉素作为临床抗生素治疗的“最后一道屏障”, 在骨关节感染的治疗中有广泛的应用, 长时间应用, 尤其在3周以后会出现伴嗜酸性粒细胞增多和系统症状的药疹(drug reaction with eosinophilia and systemic symptoms, DRESS)综合征, 该病在药物说明书中已明确指出, 但其发生率低, 临床医生未予重视。本文介绍一例慢性骨髓炎患儿长期应用万古霉素治疗后出现反复高热, 同时血液及影像学检查未能提示相符的感染表现, 符合DRESS综合征的临床诊断, 对临床有一定的借鉴意义, 现报道如下。
患儿, 男, 14岁, 因“右侧髋关节疼痛1个月, 加重伴发热2周”于2018年11月10日就诊于山东大学齐鲁医院小儿外科, 入院前于当地医院行血培养提示金黄色葡萄球菌感染(未见报告), 给予青霉素及头孢类抗生素治疗, 效果欠佳。入院体格检查:患儿一般情况尚可, 营养状况良好, 发育正常, 全身皮肤黏膜无黄染及出血点, 头颈、双肺、心脏、腹部查体无异常, 右下肢无畸形, 无静脉曲张, 无杵状指, 无浮肿; 右侧髋关节处无红肿, 皮肤温度稍高, 右侧腹股沟处压痛(+), 大转子叩击痛明显, 髋关节屈伸旋转活动明显受限, 4字实验(+)。入院当天血液检查结果:超敏C反应蛋白111.96 mg/L, 白细胞19.05×109/L (中性粒细胞71.70%, 淋巴细胞17.60%, 单核细胞9.80%, 嗜酸性粒细胞0.30%, 嗜碱性粒细胞0.60%), 血沉68 mm/h, MRI检查结果(图 1)提示右侧髂骨及髋臼骨髓水肿并周围软组织肿胀, 右侧髋关节腔及周围滑囊积液, 给予万古霉素500 mg 8 h一次静脉滴注治疗。

|
图 1 DRESS综合征患儿入院当天MRI表现, 右侧髂骨及髋臼骨髓水肿并周围软组织肿胀, 右侧髋关节腔及周围滑囊积液 Fig.1 MRI findings on the day of admission hinted at edema of right ilium and acetabulum bone marrow, surrounding soft tissue swelling and right hip joint cavity and surrounding synovial effusion |
入院第1~5天:体温波动于35.5~39.0℃, 第5天血液检查结果:超敏C反应蛋白69.68 mg/L, 白细胞20.94×109/L(中性粒细胞胞0.60%), 血沉85 mm/h。
入院第6~10天:体温波动在36.0~39.4℃, 第7天时, 患儿出现咳嗽及咳痰。胸部CT提示双肺纹理增多, 右肺可见两个泡状影, 左肺见数个软组织密度团块, 最大2.4 cm×2.2 cm, 双肺存在索条影及小斑片, 左侧胸腔积液。
入院第11~21天:体温波动在36.0~39.4℃, 在应用万古霉素第11天时, 复查血液指标:超敏C反应蛋白38.68 mg/L, 白细胞5.37×109/L(中性粒细胞64.30%, 淋巴细胞24.00%, 单核细胞9.50%, 嗜酸性粒细胞1.50%, 嗜碱性粒细胞0.70%), 血沉98 mm/h; 骨髓穿刺结果:粒系增生活跃, 比值偏高, 考虑为炎性骨髓象。入院14 d后复查MRI(图 2)提示右侧髂骨及髋臼骨髓水肿并周围软组织感染, 髋关节腔及滑囊积液较前略有改善。

|
图 2 DRESS综合征患儿入院14 d后复查MRI表现为右侧髂骨及髋臼骨髓水肿并周围软组织感染, 髋关节腔及滑囊积液较前略有改善 Fig.2 MRI re-examination at Day 14 post-admission indicated edema of right ilium and acetabulum bone marrow, surrounding soft tissue infection and hip joint cavity and slippery bursa effusion improved slightly |
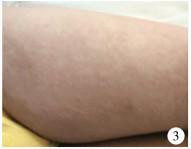
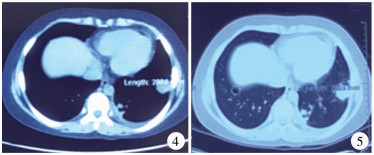
在应用万古霉素治疗第21天, 患儿出现全身散在多发的红色皮疹(图 3), 同时咳嗽、咳痰症状加重, 伴有持续高热, 最高体温39.6℃。查体:全身散在多发红色皮疹, 平均大小约0.1 cm×0.1 cm, 无皮肤破溃及出血点, 双肺呼吸音增粗, 可闻及少量湿啰音, 右侧腹股沟区压痛及大转子处压痛叩击痛较前改善, 右侧髋关节屈伸(10° ~50°)旋转(内旋45° ~外旋45°)活动改善。实验室检查:抗肺炎支原体抗体(MP-Ab) 1 : 40, 抗结核抗体(TB-Ab)阴性, 感染T细胞监测(ESAT-6/CFP10)阴性, 风湿免疫系列阴性, 半乳甘露聚糖血清指数阴性。同时复查血液指标:超敏C反应蛋白7.35 mg/L, 白细胞2.19×109/L(中性粒细胞73.40%, 淋巴细胞17.40%, 单核细胞5.50%, 嗜酸性粒细胞3.20%, 嗜碱性粒细胞0.50%), 血沉19 mm/h, 谷丙转氨酶(glutamic-pyruvic transaminase, ALT) 392 U/L, 谷草转氨酶(glutamic-oxaloacetic transaminase, AST) 349 U/L, γ-谷丙酰基转肽酶119 U/L; 胸部CT检查结果(图 4、图 5)提示双肺下叶见小片状密度增高影, 部分内见空洞, 右肺下叶见薄壁透光区, 左侧胸膜增厚。在应用万古霉素治疗第25天时停用。
|
图 3 DRESS综合征患儿入院21 d时出现双下肢及躯干部多发散在红色皮疹 Fig.3 At Day 21 post-admission, multiple diffuse red rashes on both lower limbs and trunk |
|
图 4~5 图 4~图 5 肺部CT图 Fig.4~5 Figs. 4&5 Lung CT manifestations showed small patches of higher-density opacity with partial cavity in both lower lobes. A thin-walled translucent zone in right lower lobe and space-occupying lesion in left lower lobe were probably of inflammatory nodules 注 双肺下叶见小片状密度增高影, 部分内见空洞, 右肺下叶见薄壁透光区, 左下肺占位, 考虑为炎性结节 |
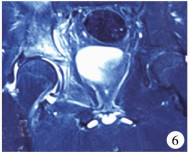
入院第26~32天:患儿体温波动于36.0~36.7℃, 在停用万古霉素的第2天, 患儿的咳嗽、咳痰及皮疹症状有所改善。体格检查:全身皮肤黏膜无黄染、瘀斑、皮疹及出血点, 双肺呼吸音略粗, 未闻及干湿性啰音, 右侧髋关节处无红肿, 皮温正常, 右腹股沟区淋巴结肿大, 腹股沟及大转子处压痛(-), 无明显叩击痛, 髋关节屈伸旋转活动好, 4字实验(-)。复查血液指标:超敏C反应蛋白1.65 mg/L, 白细胞6.60×109/L(中性粒细胞30.70%, 淋巴细胞55.30%, 单核细胞8.20%, 嗜酸性粒细胞5.20%, 嗜碱性粒细胞0.47%)。复查MRI(图 6)提示右侧髂骨及髋臼骨髓水肿并周围软组织感染, 髋关节腔及滑囊积液较前明显改善。
|
图 6 DRESS综合征患儿入院30 d后MRI检查 Fig.6 At Day 30 after admission, MRI re-examination indicated significant improvements of edema of right ilium and acetabulum bone marrow and surrounding soft tissue infection, hip joint cavity and slippery bursa effusion 注 右侧髂骨及髋臼骨髓水肿并周围软组织感染, 髋关节腔及滑囊积液较前明显改善 |
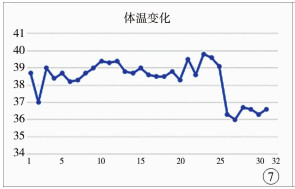
在停用万古霉素第5天, 患儿皮疹完全消退, 体温恢复正常(图 7), 咳嗽及咳痰症状较前明显减轻。再次复查血液指标(图 8):超敏C反应蛋白0.85 mg/L, 白细胞7.13×109/L(中性粒细胞42.70%, 淋巴细胞32.00%, 单核细胞12.60%, 嗜酸性粒细胞11.60%, 嗜碱性粒细胞1.10%), 血沉9.00 mm/h, ALT 99 U/L, AST 27 U/L, GGT 98 U/L; MRI检查提示右侧髂骨及髋臼骨髓水肿并周围软组织感染, 髋关节腔及滑囊积液较前明显改善。
|
图 7 住院期间每日最高体温变化折线图, 第25天停用万古霉素, 停用后第2天体温即恢复正常 Fig.7 Daily highest temperature change graph during hospitalization.Vancomycin was withdrawn at Day 25 after admission and body temperature returned to normal the next day |
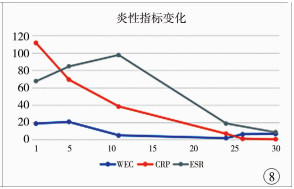
|
图 8 住院期间外周血中炎性指标变化图, 在第24天(即停药前)这些炎性指标已经明显下降 Fig.8 Changes of inflammatory parameters in peripheral blood(WBC, CRP & ESR)during hospitalization:At Day 24, these parameters declined markedly before drug withdrawal |
“DRESS综合征”这个词最早由Bocquet等于1996年提出, 典型症状为皮疹、发热、嗜酸性粒细胞增多症、非典型淋巴细胞增多症和多器官功能衰竭(肝脏、肾脏和肺)[1, 2]。DRESS综合征有较长的潜伏期, 一般用药2~6周后出现症状。目前, 该病确切的发病机制尚不清楚, 但一般和免疫抑制药物过敏反应有关, 与潜在的病毒感染(如人类疱疹病毒6)也有一定的关系[3]。这种免疫抑制可反过来导致更严重的全身药物反应。可能引起DRESS综合征的药物包括抗惊厥药、抗生素、抗病毒药和抗抑郁药[4]。
万古霉素是一种糖肽类抗生素, 半衰期为6~10 d, 对革兰氏阳性菌及黄杆菌属的革兰氏阴性菌敏感。在过去的几十年, 由于耐甲氧西林金黄色葡萄球菌的出现, 万古霉素越来越多地被应用于治疗脓肿、肺炎、蜂窝织炎、心内膜炎及脑膜炎等感染性疾病。与此同时, 万古霉素引起的药物反应报道越来越多, 其中包括线状IgA大疱性皮病、DRESS综合征、Steven-Johns综合征等。万古霉素致DRESS综合征发生的平均时间为3周, 与文献报道的复方新诺明引起DRESS综合征的发生时间一致[5]。
万古霉素一般较少引起DRESS综合征, 到目前为止国内外仅有25例确诊的报告, 具体机制不明, 最初表现为急性呼吸窘迫综合征, 然后出现皮疹、发烧和急性间质性肾炎等[4]。在反应的早期, 会出现血液循环中的B淋巴细胞减少及血清免疫球蛋白降低, 同时可能合并炎性细胞因子的升高, 特别是白介素-5在嗜酸性粒细胞升高前已经达到峰值[6]。据推测, 炎性细胞因子的升高会导致器官的损害, 最终导致嗜酸性粒细胞升高。
一、诊断及鉴别诊断鉴于DRESS综合征表现的多样性, 欧洲严重皮肤不良反应登记处制作了《欧洲皮肤不良反应标准量表》(RegiSCAR)[7], 帮助临床工作中对可疑情况进行鉴别(表 1)。根据量化指标, 总分为7分, 其中包括发热(1分)、嗜酸性粒细胞增高(2分)、皮肤改变和活检(2分)、肝脏或肾脏损害(2分), 同时还需要血清抗核抗体及血培养阴性, 排除肝炎的可能才能诊断为DRESS综合征。本例患儿出现高热(最高39.4℃), 右侧腹股沟区淋巴结肿大, 皮疹面积大于体表面积的50%, 皮疹表现为多形性红斑及多发散在红疹, 符合DRESS综合征的诊断, 虽未行皮肤活检, 但病程>15 d, 嗜酸性粒细胞11.60%, 累及肝脏, 抗核抗体、血培养、肝炎指标检测均为阴性, 综合评分为7分, 故结论为“肯定有关”。
| 表 1 欧洲严重皮肤不良反应登记处(regiSCAR)DRESS综合征确认评分系统 Table 1 RegiSCAR scoring system for confirming DRESS syndrome |
|
|
需要注意的是, 还有几种可以引起嗜酸性粒细胞增高和多器官功能损害的情况需要鉴别。①嗜酸性血管炎性肉芽肿(eosinophilic granulomatosis with polyangiitis, EGPA)是一种合并哮喘和嗜酸性粒细胞增高的坏死性血管炎, 特点包括抗中性粒细胞浆抗体阳性、肺泡冲洗液中嗜酸性粒细胞增多以及皮肤活检可见微血管血栓及类纤维坏死[8]。②继发性嗜酸性粒细胞增多症(hypereosinophilic syndrome, HES)可能有很多不同的诱因, 包括寄生虫感染、过敏或者药物反应等[9]。目前本研究认为可以把DRESS综合征归为药物引起的嗜酸性粒细胞增多症的一种。相反地, 原发性嗜酸性粒细胞增多症是一种骨髓及髓外的增生异常, 包括异常增生的嗜酸性粒细胞和细胞基因的异常。本例患儿骨髓穿刺结果:粒细胞系增生活跃, 比值偏高, 考虑为炎性骨髓象, 可以排除原发性嗜酸性粒细胞的可能。③川崎病是另一种可以引起发热、皮疹及多器官损害的疾病, 通过特征性的多形性红斑、结膜改变及淋巴结病变可以确诊[10]。
二、治疗DRESS综合征的治疗包括相关药物的停用和应用类固醇激素[11]。同时由于万古霉素的半衰期很长, 一些病情较重的患儿可能需要透析治疗, 一次透析治疗即可清除血液中50%以上的万古霉素。类固醇激素早期需要静脉应用, 待发热及皮疹症状控制后, 改为口服4~6周, 并逐步减少药物剂量[12]。如果停药过快, 会导致症状反复及住院时间延长。本例患儿停万古霉素后未再发热、皮疹逐渐消退, 肝功能较前明显好转, 故未予激素治疗, 仅给予保肝药物对症治疗。
三、局限与不足① 治疗过程中, 未行肝肾等脏器彩超检查。虽然查血结果提示肝功能损害, 但如果同时行彩超等相关检查, 更能支持肝肾功能损害的诊断; ②肺部CT提示双肺下叶小片病灶, 需要鉴别是DRESS综合征的表现还是肺部感染的症状。本例患儿入院前血培养检查即提示金黄色葡萄球菌感染, 考虑为肺部感染的可能性大, 但尚缺少决定性的证据, 如有可能可行穿刺活检等检查明确诊断; ③结合患儿病史、血液及影像学检查, 考虑髂骨骨髓炎、髂窝脓肿形成诊断明确, 早期有明确的手术指征, 但入院前已有2周病史, 考虑迁延为慢性骨髓炎, 且髋关节积液量不多, 建议行髋关节切开引流术, 患儿家属坚持要求继续保守治疗, 导致用药时间明显延长, 而长期应用万古霉素引起DRESS综合征的平均时间为3周, 故早期未行手术治疗是引起本例不良反应的可能原因。
综上所述, DRESS综合征是一种药物引起的严重过敏反应, 长时间静脉应用万古霉素, 如出现与感染症状不符的发热、皮疹及淋巴结肿大等表现, 需要警惕DRESS综合征的可能。对于万古霉素致DRESS综合征患儿, 应及时停药, 并系统使用糖皮质激素治疗, 病情严重者可给予透析治疗, 病情稳定后加强长期随访。在临床工作中, 需要注意减少用药时长, 如有明确的手术指征, 需早期行手术引流等, 以避免发生相关并发症。
| [1] |
Bocquet H, Bagot M, Roujeau JC, et al. Drug-induced pseudolymphoma and drug hypersensitivity syndrome(drug rash with eosinophilia and systemic symptoms:DRESS)[J]. Semin Cutan Med Surg, 1996, 15(4): 250-257. DOI:10.1016/S1085-5629(96)80038-1 |
| [2] |
Chen YC, Cho YT, Chang CY, et al. Drug reaction with eosinophilia and systemic symptoms:a drug-induced hypersensitivity syndrome with variable clinical features[J]. Dermatol Sin, 2013, 31(4): 196-204. DOI:10.1016/j.dsi.2013.09.006 |
| [3] |
Hirahara K, Kano Y, Mitsuyama Y, et al. Differences in immunological alterations and underlying viral infections in two well-defined severe drug eruptions[J]. Clin Exp Dermatol, 2010, 35(8): 863-868. DOI:10.1111/j.1365-2230.2010.03820.x |
| [4] |
Olivia W, Mohamed H, John A, et al. Case report:atypical presentation of vancomycin induced DRESS syndrome:a case report and review of the literature[J]. BMC Pulmonary Medicine, 2017, 17(1): 217-223. DOI:10.1186/s12890-017-0564-6 |
| [5] |
Hiransuthikul A, Rattananupong T, Klaewsongkram J, et al. Drug-induced hypersensitivity syndrome/drug reaction with eosinophilia and systemic symptoms(DIHS/DRESS):11 years retrospective study in Thailand[J]. Allergol Int, 2016, 65(4): 432-438. DOI:10.1016/j.alit.2016.04.001 |
| [6] |
Choquet-Kastylevsky G, Intrator L, Chenal C, et al. Increased levels of interleukin 5 are associated with the generation of eosinophilia in drug-induced hypersensitivity syndrome[J]. Br J Dermatol, 1998, 139(6): 1026-1032. DOI:10.1046/j.1365-2133.1998.02559.x |
| [7] |
Kardaun SH, Sidoroff A, Valeyrie-Allanore L, et al. Variability in the clinical pattern of cutaneous side-effects of drugs with systemic symptoms:Does a DRESS syndrome really exist?[J]. Br J Dermatol, 2007, 156(3): 609-611. DOI:10.1111/j.1365-2133.2006.07704.x |
| [8] |
Groh M, Pagnoux C, Baldini C, et al. Eosinophilic granulomatosis with polyangiitis(Churg-Strauss)(EGPA)consensus task force recommendations for evaluation and management[J]. Eur J Intern Med, 2015, 26(7): 545-553. DOI:10.1016/j.ejim.2015.04.022 |
| [9] |
Gotlib J. World Health Organization-defined eosinophilic disorders:2017 update on diagnosis, risk stratification, and management[J]. Am J Hematol, 2017, 92(11): 1243-1259. DOI:10.1002/ajh.24880 |
| [10] |
Newburger JW, Takahashi M, Gerber MA, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association[J]. Pediatrics, 2004, 114(6): 1708-1733. DOI:10.1542/peds.2004-2182 |
| [11] |
Funck-Brentano E, Duong TA, Bouvresse S, et al. Therapeutic management of DRESS:a retrospective study of 38 cases[J]. J Am Acad Dermatol, 2015, 72(2): 246-252. DOI:10.1016/J.JAAD.2014.10.032 |
| [12] |
Criado PR, Avancini J, Santi CG, et al. Drug reaction with eosinophilia and systemic symptoms(DRESS):a complex interaction of drugs, viruses and the immune system[J]. Isr Med Assoc J, 2012, 14(9): 577-582. |
 2020, Vol. 19
2020, Vol. 19


