2. 天津肿瘤医院(天津市,300060)
2. Tianjin Medical University Cancer Institute & Hospital, Tianjin 300060, China
神经母细胞瘤(neuroblastoma,NB)是最常见的儿童期颅外实体肿瘤。该病起源于神经嵴细胞,可发生于交感神经系统的任何部位,最多见于腹膜后。目前整体治愈率不甚理想,手术仍是儿童腹膜后神经母细胞瘤治疗的重要一环,但其安全性不可忽视。近年国际上对于神经母细胞瘤治疗的分期逐渐从术后的国际神经母细胞瘤临床分期(International Neuroblastoma Staging System, INSS)模式改进为术前的国际神经母细胞瘤危险度分级协作组(international neuroblastoma risk group,INRG)分期。国际上有报道以INRG中的影像学危险因素(image defined risk factor, IDRF)为标准对肿瘤的手术风险进行预测[1]。本研究通过总结2016年6月至2017年6月首都医科大学附属北京儿童医院收治的腹膜后神经母细胞瘤患儿的影像学资料,探讨术前IDRF数目与手术并发症的相关性及临床意义。
材料与方法 一、研究对象纳入与排除标准回顾性分析2016年6月至2017年6月在首都医科大学附属北京儿童医院肿瘤外科行肿瘤切除手术并诊断为神经母细胞瘤患儿的影像学及临床资料。研究对象纳入标准:①病理诊断为神经母细胞瘤; ②肿瘤发病于腹膜后区域; ③年龄 < 18岁; ④患儿术前生命体征平稳,体温、血压、脉搏在正常范围内; ⑤手术前后接受肿瘤内科团队规范化评估与治疗。排除标准:①合并肿瘤破裂; ②合并风湿免疫病或其他遗传代谢病; ③治疗或评估过程不完整的患儿。
二、评估与治疗术前针对病灶的影像学评估采用低剂量增强CT检查,CT图像为轴位图像,经多平面重组方式重建为冠状位图像,所有图像传输至专业影像工作站(Carestream PACS11.0工作站,Carestream Health公司),由一名高年资影像科医师及一名儿童肿瘤外科医师共同阅片,出具INRG报告,包括具体IDRF条目及数量。全身评估及术前化疗参照BCH-NB-2007方案进行[2]。
手术由具有10年以上经验的儿童肿瘤外科专业医生主刀完成,手术无固定术式,所有肿瘤均一次性肉眼直视下完整切除。手术原则:需探查肿瘤表面的出血趋势与解剖关系,设计分离步骤,在充分暴露直视下分离瘤体与大血管,术中常规结扎可疑乳糜管,探查对侧及腹部可疑淋巴结[3]。
术后标本经4%甲醛溶液固定,石蜡包埋切片,HE染色,光镜观察组织病理学特征,由2名经验丰富的病理科医师进行阅片。
三、肿瘤分期及影像学危险因素肿瘤分期标准按神经母细胞瘤INSS分期执行[4, 5]。腹部神经母细胞瘤影像学危险因素以INRG报告为准[6]。
四、手术并发症的定义与记录术中或术后发生的需要处理的不利结果为手术并发症(operative complication)[7, 8]。本研究根据文献纳入下列并发症进行研究,并按照与手术本身的相关性分为直接并发症(direct operative complication, DOC)和间接并发症(indirect operative complication, IOC),记录各例患儿手术中及手术后出现的并发症项数。直接手术并发症:①实质脏器术中切除及术后损伤(如术中肝、肾切除,术后肾缺血萎缩); ②严重血管损伤(主动脉损伤及再吻合,肾动脉损伤及再吻合); ③严重神经损伤(交感神经等损伤或Horner征); ④术后乳糜瘘或乳糜腹; ⑤术中失血导致输血; ⑥术后肾上腺功能异常。间接手术并发症为:①术后电解质紊乱; ②术后感染或持续高热; ③术后肠梗阻或肠套叠; ④术后切口积液、血肿、延迟愈合。
五、并发症的处理方式术后予一级护理,观察生命体征、检查结果、引流液量与性状等。实质脏器损伤者监测对应指标(肝功能、血肌酐等),定期影像学复查,予以保肝扩容等对症治疗。血管损伤及再吻合术后患儿予抗凝,定期复查超声了解血流情况。术后乳糜瘘或乳糜腹者予保持引流、无脂饮食及肠外营养等支持治疗。
六、随访出院后随访通过电话、门诊进行,随访内容以腹部原位超声等影像学检查为主,随访时间16~29个月,中位随访时间22个月。
七、统计学处理采用SPSS20.0统计学软件进行数据整理与分析,符合正态分布的计量资料以均数加减标准差(x±s)表示,不符合正态分布的计量资料采用中位数和四分位间距表示,计数资料以频数或百分数表示。采用Spearman相关分析术前IDRF数量与并发症项数的相关性。相关系数r取绝对值后:0~0.09为没有相关性; 0.1~0.3为弱相关; 0.3~0.5为中等相关; 0.5~1.0为强相关。以P<0.05为差异有统计学意义。以IDRF数目为检验变量,以并发症发生与否为状态变量,绘制ROC曲线确定术前IDRF数目预测手术并发症发生的临界值,并计算灵敏度、特异度、阳性预测值、阴性预测值、阳性似然比和阴性似然比。
结果 一、临床特征本研究共收集68例神经母细胞瘤患儿,男童32例,女童36例,发病年龄为0~148个月,中位年龄33个月。其中59例以腹部膨隆等非特异性症状为主,4例为转移性骨痛,4例为眼痉挛-肌肉痉挛-共济失调综合征(opsoclonus-myoclonus syndrome, OMS)或顽固性腹泻等伴瘤综合症,1例为神经母细胞瘤眼转移“熊猫眼”。根据INSS分期标准,Ⅰ期4例,Ⅱ期5例,Ⅲ期21例,Ⅳ期35例,4S期3例。肿瘤局部存在IDRF 53例,不存在IDRF 15例; 术后肿瘤组织NMYC基因扩增阳性11例。
二、手术并发症的处理及预后68例患儿各存在并发症0~4项(中位数1项)。共39例患儿出现并发症76项。其中36例肿瘤局部存在IDRF,3例不存在IDRF,详见表 1。15例无IDRF患儿术后并发症发生率为20.00%(3/15),有IDRF患儿术后并发症发生率为67.92%(36/53),差异有统计学意义(χ2=10.98,P < 0.05)。直接和间接并发症具体例数及处理方法详见表 2和表 3。所有并发症经过治疗后均好转或无继续进展,无死于手术并发症者。
| 表 1 68例儿童腹膜后神经母细胞瘤有无IDRF与并发症的关系[n(%)] Table 1 Relationship between IDRF and complications in 68 children with retroperitoneal neuroblastoma [n(%)] |
|
|
| 表 2 直接并发症发生例数及处理 Table 2 Incidence and management of direct operative complications |
|
|
| 表 3 间接并发症发生例数及处理 Table 3 Incidence and management of indirect operative complications |
|
|
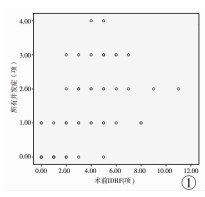
68例患儿术前存在IDRF共计194项,见表 4。各例患儿术前IDRF数目0~11项,中位数2项,与各例手术并发症发生项数(中位数1项,范围0~4项)存在强相关(r=0.713,P < 0.05),见图 1。
| 表 4 68例儿童腹膜后神经母细胞瘤术前IDRF及数目 Table 4 Preoperative IDRF of 68 Children with Retroperitoneal Neuroblastoma |
|
|
|
图 1 IDRF与所有并发症的散点图及趋势线 Fig.1 Scatter plots and trend lines between IDRFs and all operative complications |
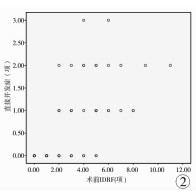
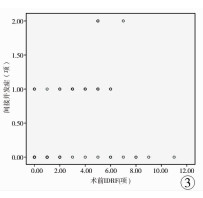
各例肿瘤患儿术前IDRF数目(中位数2项, 范围0~11项),与各例直接并发症发生项数(中位数0项,范围0~3项)存在强相关(r=0.700,P < 0.05);与各例间接并发症发生项数(中位数0项,范围0~2项)存在中等相关(r=0.420,P < 0.05)。两组散点图及趋势线分别见图 2及图 3。
|
图 2 IDRF与直接并发症的散点图及趋势线 Fig.2 Scatter plots and trend lines between IDRFs and direct operative complications |
|
图 3 IDRF与间接并发症的散点图及趋势线 Fig.3 Scatter plots and trend lines between IDRFs and indirect operative complications |
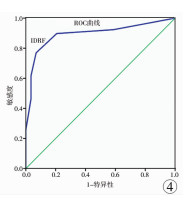
ROC曲线见图 4。曲线下面积(area under curve, AUC)为0.894(95%CI:0.813~0.975),IDRF数目的临界值为2项,灵敏度85.4%,特异度为85.2%,阳性似然比为5.8,阴性似然比为0.17,阳性预测值为89.7%,阴性预测值为79.3%。
|
图 4 术前IDRF数目与有无手术并发症的ROC曲线 Fig.4 ROC curve of preoperative IDRF number and operative complications or not |
儿童腹膜后神经母细胞瘤常体积较大且易侵犯周围组织及血管,导致手术难度大,术后发生并发症的风险大,因此,术前评估手术风险对该类患儿预后有至关重要的作用。影像学风险因素(image defined risk factor, IDRF)由欧洲Cecchetto等[9]于2005年首次提出,同时Monclair等[10]据此基础制定了INRG分期,这两项研究对于儿童神经母细胞瘤手术具有重要指导意义。此外,腹膜后神经母细胞瘤常侵犯肾蒂或肾动脉,导致术后肾萎缩或术中肾切除。因此,Brisse等[6]于2011年首次提出将“接触肾动脉(contact)而非包绕(encase)”这一影像学表现列入IDRF之中。经验证实这一做法提高了IDRF对于术后并发症的预测敏感性,但同时也降低了特异性和准确性[8]。Fumino等[11]认为此法有可能降低手术积极性,延长住院时间,导致不必要的化疗。本研究按最新共识将“与肾动脉接触”考虑为IDRF[6]。
在预测价值方面,欧洲多中心研究纳入无IDRF患者291例,其中IDRF患者243例,发现前者并发症发生率(5%)显著少于后者(17%)(P<0.05)[12]。同样,Günther等[13]报道在神经母细胞瘤术后并发症的病例中每1例至少存在1项IDRF。除此以外,Yoneda等[8]研究显示IDRF对于预测并发症灵敏度也达到了100%。本研究中无IDRF患儿组无一例出现直接并发症,仅3例出现间接并发症,手术风险远远低于存在IDRF的患儿[14]。存在IDRF对预测腹膜后NB患儿术后发生直接并发症的灵敏度为100%,预测间接并发症灵敏度为89.7%,结果与文献相符。Avanzini等[15]分析IDRF数据提示IDRF最多时(n=3),出现手术并发症亦最多(n=4)。本研究进一步分析IDRF数目与并发症项数相关性,发现IDRF项数与手术并发症的项数成正相关。经ROC曲线分析发现IDRF数目可以预测术后并发症的发生(AUC=0.894),其灵敏度为85.4%,特异度为85.2%。即整体上IDRF存在数目越多,手术危险度的增加越显著。
二、低危险度组更需影像学评估神经母细胞瘤往往临床症状不典型,就诊时已有转移,首诊时以Ⅳ期或高危患儿多见。对于高危神经母细胞瘤的手术切除率目前尚存在争议,有研究认为高危神经母细胞瘤切除率≥90%的患儿生存率优于切除率<90%者,但也有文献报道完整切除更易造成Ⅲ或Ⅳ期患儿的手术并发症,且对生存率改善无意义[16, 17]。本研究采取肉眼直视下肿瘤全切(gross total resection, GTR),力争R0级切除病灶或最大程度减少肿瘤负荷[18]。随访至2019年1月,7例患儿因复发而死亡,其中NMYC基因扩增阳性者4例,占整体57.1%。因此,对于NMYC阴性的INSS分期Ⅰ、Ⅱ期患儿,手术是影响预后的主要治疗手段,术前影像学评估更有意义,通过准确的IDRF评估可能使患儿避免不必要的化疗[11]。
三、并发症的处理神经母细胞瘤手术中较受关注的主要并发症(major complication)有肾脏损伤、血管损伤及乳糜瘘,整体发生率约20%[8]。本研究中31例肿瘤侵犯肾蒂,约占45.5%,术中行肾脏全切或部分切除者5例,约占7.4%,与文献报道基本一致[19, 20]。既往研究及本组病例在肾脏受损后肾功能显著异常者少见,但仍需注意患儿成年后潜在肾功能减退的风险[21]。腹部大血管损伤甚至断裂亦有报道,可危及患儿生命。Paran等[22]对5例术中血管破裂患者采用人工血管或补片对主动脉进行吻合修补,灌注效果满意。本研究仅1例患儿因腹主动脉断裂使用人工血管连接断裂血管的2个断端,术后患儿经治疗后恢复良好,人工血管的应用给术中血管破裂的处理提供了新的技术支持。目前,针对术后乳糜瘘以保守治疗为主,即严格无脂或低脂饮食、肠外营养和持续引流[23]。整体疗效较好,但必要时需开腹行乳糜管结扎术[24]。对于电解质紊乱、感染、输血等并发症给予对症抗感染等支持治疗均可好转。肠梗阻作为腹部手术的常见并发症,需要临床及时发现问题,保守治疗无效时及时手术,尽可能及早发现绞窄征象[25]。本研究根据临床上与手术的相关性分为直/间接并发症,发现神经母细胞瘤IDRF数目与肾脏切除等直接并发症的相关性明显强于与术后电解质紊乱、肠梗阻等间接并发症的相关性,这对后期的手术风险预测模型研究具有重要的提示意义。
综上所述,IDRF评估系统的提出对于手术风险的评估具有重要意义,值得继续推广应用。
| [1] |
Yoneda A, Nishikawa M, Uehara S, et al. Can neoadjuvant chemotherapy reduce the surgical risks for localized neuroblastoma patients with image-defined risk factors at the time of diagnosis?[J]. Pediatr Surg Int, 2016, 32(3): 209-214. DOI:10.1007/s00383-016-3858-5 |
| [2] |
马晓莉, 金眉, 张大伟, 等. 多学科联合诊治神经母细胞瘤91例临床特征及近期疗效分析[J]. 中华实用儿科临床杂志, 2013, 28(3): 178-182. Ma XL, Jin M, Zhang DW, et al. Clinical features and efficacy of recent treatment analysis of multimodality treatment for 91 children with neuroblastoma[J]. J Appl Clin Ped, 2013, 28(3): 178-182. DOI:10.3760/cma.j.issn.2095-428X.2013.03.007 (in Chinese) |
| [3] |
张金哲. 小儿肿瘤外科手术技术规范[J]. 临床小儿外科杂志, 2008, 7(5): 66-68. Zhang JZ. Technical specifications for pediatric oncological surgery[J]. J Clin Ped Sur, 2008, 7(5): 66-68. DOI:10.3969/j.issn.1671-6353.2008.05.023 (in Chinese) |
| [4] |
Brodeur GM, Pritchard J, Berthold F, et al. Revisions of the international criteria for neuroblastoma diagnosis, staging and response to treatment[J]. Prog Clin Biol Res, 1993, 385(11): 363-369. |
| [5] |
张广超, 王景福. 国际神经母细胞瘤危险度分级(INRG)协作组最新共识[J]. 中国肿瘤临床, 2012, 39(15): 1003-1007. Zhang GC, Wang JF. Latest staging consensus of International Neuroblastoma Risk Group[J]. Chin J Clin Onc, 2012, 39(15): 1003-1007. DOI:10.3969/j.issn.1000-8179.2012.15.001 (in Chinese) |
| [6] |
Brisse HJ, McCarville MB, Granata C, et al. Guidelines for Imaging and Staging of Neuroblastic Tumors:Consensus Report from the International Neuroblastoma Risk Group[J]. Radiol, 2011, 261(1): 243-257. DOI:10.1148/radiol.11101352 |
| [7] |
Davidoff AM, Fernandez-Pineda I. Complications in the surgical management of children with malignant solid tumors[J]. Semin Pediatr Surg, 2016, 25(6): 395-403. DOI:10.1053/j.sempedsurg.2016.10.003 |
| [8] |
Akihiro Y, Masanori N, Shuichiro U, et al. Can Image-Defined Risk Factors Predict Surgical Complications in Localized Neuroblastoma?[J]. Eur J Pediatr Surg, 2016, 26(1): 117-122. DOI:10.1055/s-0035-1566100 |
| [9] |
Cecchetto G, Mosseri V, De Bernardi B, et al. Surgical risk factors in primary surgery for localized neuroblastoma:the LNESG1study of the European International Society of Pediatric Oncology Neuroblastoma Group[J]. J Clin Oncol, 2005, 23(33): 8483-8489. DOI:10.1200/JCO.2005.02.4661 |
| [10] |
Cohn SL, Pearson AD, London WB, et al. The International Neuroblastoma Risk Group (INRG) classification system:an INRG Task Force report[J]. J Clin Oncol, 2009, 27(2): 289-297. DOI:10.1200/JCO.2008.16.6875 |
| [11] |
Fumino S, Kimura K, Iehara T, et al. Validity of image-defined risk factors in localized neuroblastoma:A report from two centers in Western Japan[J]. J Ped Surg, 2015, 50(12): 2102-2106. DOI:10.1016/j.jpedsurg.2015.08.039 |
| [12] |
Monclair T, Mosseri V, Cecchetto G, et al. Influence of image-defined risk factors on the outcome of patients with localised neuroblastoma.A report from the LNESG1 study of the European International Society of Paediatric Oncology Neuroblastoma Group[J]. Pediatr Blood Cancer, 2015, 62(9): 1536-1542. DOI:10.1002/pbc.25460 |
| [13] |
Günther P, Holland-cunz S, Schupp CJ, et al. Significance of image-defined risk factors for surgical complications in patients with abdominal neuroblastoma[J]. Eur J Pediatr Surg, 2011, 21(5): 314-317. DOI:10.1055/s-0031-1280824 |
| [14] |
Simon T, Hero B, Benzbohm G, et al. Review of image defined risk factors in localized neuroblastoma patients:Results of the GPOH NB97 trial[J]. Pediatr Blood Cancer, 2010, 50(5): 965-969. DOI:10.1002/pbc.21343 |
| [15] |
Avanzini S, Pio L, Erminio G, et al. Image-defined risk factors in unresectable neuroblastoma:SIOPEN study on incidence, chemotherapy-induced variation, and impact on surgical outcomes[J]. Pediatr Blood Cancer, 2017, 64(11): e26605. DOI:10.1002/pbc.26605 |
| [16] |
Mullassery D, Farrelly P, Losty PD. Does aggressive surgical resection improve survival in advanced stage 3 and 4neuroblastoma? A systematic review and meta-analysis[J]. Pediatr Hematol Oncol, 2014, 31(8): 703-716. DOI:10.3109/08880018.2014.947009 |
| [17] |
Englum BR, Rialon KL, Speicher PJ, et al. Value of surgical resection in children with high-risk neuroblastoma[J]. Pediatr Blood Cancer, 2015, 62(9): 1529-1535. DOI:10.1002/pbc.25504 |
| [18] |
王焕民. 神经母细胞瘤外科治疗的技术与原则[J]. 中国小儿血液与肿瘤杂志, 2014, 19(1): 7-9. Wang HM. Techniques and principles of surgical treatment of neuroblastoma[J]. China Pediatr Blood Cancer, 2014, 19(1): 7-9. DOI:10.3969/j.issn.1673-5323.2014.01.003 (in Chinese) |
| [19] |
Brisse HJ, Mccarville MB, Granata C, et al. Guidelines for Imaging and Staging of Neuroblastic Tumors:consensus report from the International Neuroblastoma Risk Group Project[J]. Radiol, 2011, 261(1): 243-257. DOI:10.1148/radiol.11101352 |
| [20] |
Lim Ⅱ, Goldman DA, Farber BA, et al. Image-defined risk factors for nephrectomy in patients undergoing neuroblastoma resection[J]. J Pediatr Surg, 2016, 51(6): 975-980. DOI:10.1016/j.jpedsurg.2016.02.069 |
| [21] |
Ibrahim D. Indications for nephrectomy in children:a report on 119 cases[J]. Saudi J Kidney Dis Transpl, 2012, 23(6): 1221-1226. DOI:10.4103/1319-2442.103563 |
| [22] |
Paran TS, Corbally MT, Gross-Rom E, et al. Experience with aortic grafting during excision of large abdominal neuroblastomas in children[J]. J Pediatr Surg, 2008, 43(2): 335-340. DOI:10.1016/j.jpedsurg.2007.10.045 |
| [23] |
Liu Y, Pan C, Tang JY, et al. What is the result:chylous leakage following extensive radical surgery of neuroblastoma[J]. World J Pediatr, 2012, 8(2): 151-155. DOI:10.1007/s12519-011-0296-2 |
| [24] |
Chui CH. Mesenteric lymphatic ligation in the prevention of chylous fistulae in abdominal neuroblastoma surgery[J]. Pediatr Surg Int, 2014, 30(10): 1009-1012. DOI:10.1007/s00383-014-3581-z |
| [25] |
齐立行, 李志霞. 术后早期肠梗阻及其治疗策略[J]. 中华普通外科杂志, 2000, 15(2): 95-97. Qi LX, Li ZX. Early postoperative intestinal obstruction and its therapeutic strategies[J]. Chin J Gener Surg, 2000, 15(2): 95-97. DOI:10.3760/j.issn:1007-631X.2000.02.010 (in Chinese) |
 2020, Vol. 19
2020, Vol. 19


