2. 中国医科大学附属盛京医院小儿外科(辽宁省沈阳市,110004);
3. 北京协和医学院(北京市,100071)
2. Department of Pediatric Surgery, Affiliated Shengjing Hospital, China Medical University, Shenyang 110004, China;
3. Peking Union Medical College, Beijing 100020, China
肛周肌肉的解剖学对于指导肛门直肠畸形(anorectal malformations, ARMs)患儿的外科治疗有重要意义。1953年,在29例ARMs患儿尸体解剖的基础上,Stephen[1]首次提出耻骨直肠肌是肛门成形术后唯一可用于控制排便的括约肌,并提出了腹骶会阴肛门成形术[2]。1982年,Peña[3]强调了肛门括约肌复合体在排便控制中的重要性,该复合体由肛提肌、肛门外括约肌(external anal sphincter, EAS)和纵行的横纹肌纤维组成。根据这一理论,Peña提出后矢状入路肛门成形术(posterior sagittal anorectoplasty,PSARP),使用电刺激仪,在骶正中平面切断辨别并分离肛门括约肌复合体。在过去的30年,PSARP已成为治疗高、中位ARMs的主流术式[4, 5]。然而,多项研究表明,PSARP术后的排便功能仍不尽人意,术后便秘的发生率接近40%,其原因可能与肛门括约肌复合体损伤以及瘢痕有关[6, 7]。为了治疗高位ARMs并避免损伤控制排便的肌肉,1998年Willita[8]首先报道了腹腔镜辅助肛门成形术(laparoscopic-assisted anorectoplasty,LAARP),Georgeson[9]改进了这一术式并使其得到推广。此后,许多中心获得了腹腔镜治疗ARMs的经验,并证实了其优势[7, 10-12]。但由于肛周肌肉中心的精准解剖特点尚不明确,限制了这项技术的进展和疗效的提高。本研究旨在对比正常新生儿和ARMs患儿的肛周肌肉解剖结构,了解其异常改变,探讨其对手术改进的意义。
材料与方法 一、一般资料本研究共纳入新生儿尸体解剖标本33例,ARMs患儿尸体解剖标本13例,均来自中国医科大学附属盛京医院。33例新生儿均排除盆腔及腰骶部病变,其中男童20例,女童13例。13例ARMs患儿中男童11例,女童2例; 12例为新生儿,另1例为6月龄婴儿; 其中高位ARMs 8例,中位ARMs 5例。
二、大体观察10%福尔马林心脏灌注,浸泡固定3个月以上。经腰2、股骨上1/3处离断,取盆腔为解剖标本。其中3例高位ARMs和1例中位ARMs为术后标本,盆腔结构被破坏,其余标本行正中矢状断面。在正中矢状面上,对新生儿及ARMs患儿盆腔进行解剖剥离,对纵肌管、耻骨直肠肌及肛门外括约肌等组织进行观察,用游标卡尺测量,重复测量3次,取其平均值。
三、组织学观察在盆腔正中矢状断面上,平切6例新生儿及9例ARMs患儿的盆底会阴部大块组织。制作大块组织切片。将每块组织连续切片10张,切片厚度10 μm左右。根据需要分别行HE、Van-Giesons和改良Bielschowsky[13]染色用于组织学观察。
四、统计学方法采用SPSS 21.0统计学软件进行数据的整理与分析。计量资料以均数加减标准差(x±s)表示,组间比较采用独立样本t检验。P<0.05表示差异有统计学意义。
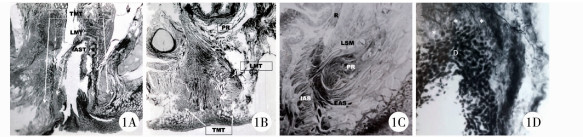
结果 一、新生儿肛周肌肉的结构观察新生儿肛门周围的肌肉由内向外可分为3个管状结构:内括约肌管(internal sphincter tube,IAST)、纵肌管(longitudinal muscle tube,LMT)和横肌管(transverse muscle tube, TMT)。IAST是由直肠壁内环肌层增厚并延续而成,其下界清晰,上界与直肠环肌延续。LMT是位于IAST与TMT之间的纵行肌肉组织(图 1A~图 1C)。LMT向内延伸至IAST中,终止于肛管的黏膜下层。新生儿LMT由肛提肌的肌纤维和直肠外层纵行平滑肌的肌纤维组成(图 1A、1C),两纵向纤维在齿状线水平以下相互融合,穿过外括约肌浅部,末端纤维散开成特征性的“鹰爪”结构,终止于真皮深层(图 1C、1D)。TMT由耻骨直肠肌和EAS组成。耻骨直肠肌起自耻骨背侧,呈“U”形向后走行包绕LMT。EAS沿耻骨直肠肌下缘向肛缘延伸,在新生儿中,二者无明显界限(图 1B)。
|
图 1 正常新生儿肛周肌肉结构 Fig.1 Normal anorectal musculature in neonates 注 1A:新生儿骨盆正中矢状面,显示IAST和TMT之间的LMT(改良Bielshowsky染色,×4); 1B:新生儿骨盆侧矢状面,显示耻骨直肠肌、EAS和终止于肛周皮肤的纵肌纤维(改良Bielshowsky染色,×4); 1C:肛管后壁下部的矢状面,显示主要来自直肠的纵向平滑肌层与来自盆底的纵向横纹肌融合形成的联合纵肌,穿透EAS浅部,终止于肛周真皮深层(Van-Gieson染色,×10); 1D:会阴皮肤,显示终末纵肌纤维分散成“鹰爪”状(改良Bielshowsky染色,×400) IAST:内括约肌管; TMT:横肌管; LMT:纵肌管; PR,耻骨直肠肌; R:直肠; LSM:来自盆底的纵向横纹肌; IAS:肛门内括约肌; *区域表示连接真皮深层; D:丰富的神经支配 |
在正中矢状面,纵肌管后壁厚度平均为(0.09±0.06)cm,长度(从耻骨直肠肌上缘至肛周皮肤)平均为(1.80±0.29)cm; 会阴部纵肌管长度(从尿道球部至肛周皮肤)平均为(1.02±0.25)cm; 后方EAS厚度平均为(0.58±0.16)cm,长度平均为(1.12±0.19)cm; 耻骨直肠肌长度平均为(2.29±0.22)cm。
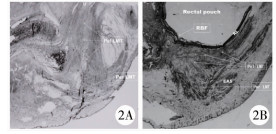
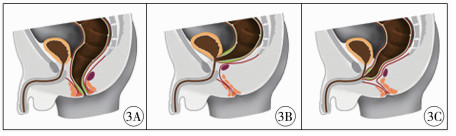
二、ARMs患儿肛周肌肉的结构观察在高、中位ARMs患儿中,直肠没有穿过肛周肌肉至会阴,IAST缺如; 直肠来源的纵肌纤维与肠壁延伸至瘘管的管壁。LMT仅由来自盆底的纵肌组成,其被分为盆腔部LMT(pelvic LMT)和会阴部LMT(perineal LMT)两部分。对于高位ARMs患儿,其直肠盲端位于盆底肌上方,盆腔部LMT向前向上移位至后尿道的后方(图 2A、图 2B)。对于中位ARMs患儿,其直肠盲端沿后尿道延伸至盆底肌,因此盆部LMT紧贴着直肠盲端后壁和瘘管壁向下延伸。高、中位ARMs患儿中,由于会阴部纵肌纤维中心没有直肠通过,故两侧会阴部纵肌相互融合成柱状,形成闭合的肌管,向下延伸,穿过EAS浅部,终止于肛周真皮深层,形成“肛穴”。肛穴代表了会阴部肛周肌肉的中心(图 3)。与正常新生儿相比,ARMs患儿的EAS发育较差,仅在皮下部可见部分EAS纤维。
|
图 2 ARMs患儿肛周肌肉结构(HE染色,×4) Fig.2 Anorectal musculature in ARM (HE stain, ×4) 注 2A:直肠膀胱瘘的骨盆正中矢状面,显示LMT连续性被破坏,盆腔部LMT向前移位至后尿道后方; 2B:直肠尿道球部瘘的骨盆正中矢状面,显示直肠盲端扩张,直肠纵行被膜延伸至瘘管处。盆腔部LMT包绕直肠盲端和直肠尿道瘘管,会阴部LMT相互融合,呈柱状向下延伸至肛穴; U:尿道; RBF:直肠尿道球部瘘; RL:直肠纵行被膜; Pel LMT:盆腔部LMT; Per LMT:会阴部纵肌管 |
|
图 3 肛门直肠肌群示意图 Fig.3 Diagrams of anorectal musclature in normal neonates (A), rectobladerneck fistula (B) and rectobbulbar fistula (C) 注 3A:正常新生儿的LMT来自直肠纵向平滑肌和肛提肌纵向横纹肌; 3B、3C:直肠膀胱颈瘘及直肠尿道球部瘘患儿的LMT被分为两部分,盆腔部LMT由于直肠盲端的存在而被拓宽,会阴部LMT融合成柱状 |
在正中矢状面,高、中位ARMs的LMT长度平均为(2.66±0.31)cm和(2.34±0.54)cm,高位ARMs患儿的纵肌管长度长于正常新生儿(P<0.05),低位ARMs患儿与高位ARMs患儿及正常新生儿的纵肌管后壁长度无差异(P>0.05);高、中位ARMs患儿会阴部纵肌管平均长度分别为(2.08±0.51)cm、(1.24±0.15)cm,高位ARMs患儿的会阴部纵肌管长度长于正常新生儿及中位ARMs患儿(P<0.05),中位ARMs患儿与正常新生儿的会阴部纵肌管长度无显著差异(P>0.05);ARMs患儿的TMT走行于纵肌外侧,由耻骨直肠肌和EAS组成。ARMs患儿的耻骨直肠肌环较窄、较短,并向前上移位。高、中位ARMs患儿的耻骨直肠肌平均长度分别为(1.49±0.40)cm和(2.13±0.25)cm,高位ARMs患儿的耻骨直肠肌长度短于正常新生儿及中位ARMs患儿(P<0.05),正常新生儿与中位ARMs患儿的耻骨直肠肌长度无差异(P>0.05),见表 1。
| 表 1 新生儿及ARMs患儿的耻骨直肠肌长度及纵肌管长度(x±s, cm) Table 1 Length of puborectalis and LMT in neonates and ARMs (x±s, cm) |
|
|
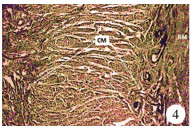
组织学上,与正常新生儿相比,ARMs患儿的纵肌纤维数量明显减少,且其肌束间未发现感觉神经末梢,这一现象在高位ARMs患儿中更明显。ARMs患儿直肠远端明显扩张,直肠黏膜下层与平滑肌纤维束的纤维化组织明显增生(图 4)。末端扩张直肠的肠壁神经节细胞明显减少。在对正常新生儿及ARMs患儿肛周组织的改良Bieishowsky染色中发现,新生儿肛周组织中存在多种感觉神经末梢。位于内、外括约肌的纵肌管间隔中含丰富的感觉神经末梢,如Pacinian小体。而ARMs患儿肛周组织中神经末梢较正常新生儿发育差,EAS中感觉神经末梢几乎缺如,仅耻骨直肠肌中存在一定数量的肌梭。但在对ARMs患儿瘘管组织的观察中发现,瘘管的环状平滑肌明显增厚,瘘管壁周围存在大量神经丛结构(图 5)。
|
图 4 ARMs患儿直肠末端的组织结构,显示环状平滑肌明显增厚,纤维组织增生(HE染色,×100) Fig.4 Dilated rectal pouch indicated that predominant thickened circular smooth muscle and fibrous tissue in rectal wall in ARMs 注 RM:瘘管附近的直肠黏膜; CM:环状平滑肌 |

|
图 5 新生儿及ARMs患儿肛周组织中感觉神经末梢分布情况 Fig.5 Sensory nerve ending distribution in anorectal region in neonates and ARMs 注 5A:肛门内括约肌与肛门外括约肌间的纵肌管内可见Pacinian小体(箭头所示)(改良Bielshowsky染色,×200); 5B:新生儿耻骨直肠肌内可见肌梭(改良Bieishowsky染色,×400); 5C:显示高位ARMs患儿耻骨直肠肌中的肌梭(改良Bieishowsky染色,×400); 5D:显示直肠前列腺瘘患儿的瘘管壁周围的神经节细胞,白箭头示神经节细胞,黑箭头示无髓神经纤维(改良Bielshowsky染色,×400) |
肛管上界起于耻骨直肠肌上缘,下界至肛门外口,是控制排便最重要的解剖结构。已发表文献对人类肛周肌群的描述存在较大差异。本研究将正常的肛周肌肉分为三个肌管:IAST、LMT和TMT。在中、高位ARMs中,直肠末端未穿过盆底到达会阴部的皮肤,上述三管系统发育异常,且三者未建立正常的解剖关系。本研究表明,ARMs患儿的直肠扩张,主要表现为环状平滑肌增厚和组织纤维化。直肠神经肌肉发育不良是先天性内在病理改变,与直肠功能障碍以及术后便秘和巨直肠密切相关。因此,直肠发育不良也是ARMs的病理改变之一,切除远端扩张的直肠可获得更好的术后排便控制功能。
尿潴留是直肠前列腺瘘或直肠膀胱瘘患儿肛门成形术后常见的并发症之一,很多学者认为其与先天骶髓神经发育异常有关[14]。本研究发现,高位ARMs的瘘管壁周围紧密围绕着大量自主神经丛,这些神经丛支配膀胱和阴茎功能,术中从瘘管壁外侧剥离结扎可能会造成神经丛损伤,导致术后尿潴留。提示通过直肠内途径剥除瘘管黏膜的方式关闭瘘管,有利于保护肌鞘和周围神经丛[15]。
本研究表明,LMT由来自肛提肌的横纹肌和来自直肠的纵向平滑肌构成,为IAST(平滑肌)与TMT(横纹肌)的功能联系提供了解剖学依据。LMT在IAST与TMT的纵向连接有助于在括约肌收缩时缩短肛管、加深肛穴,同时起固定肛管、防止脱垂以及闭合肛门的作用[16]。Shafik[16]研究表明,从功能上来看,肛提肌作为一个整体,同时收缩或松弛。来自纵向横纹肌的LMT部分和TMT同属肛提肌,这些肌肉整体收缩时,LMT使肛管短缩,耻骨直肠肌牵拉使肛管成角,TMT收缩使肛管闭合。当排便时,肛提肌松弛,直肠强烈收缩,同时LMT的纵向平滑肌部分收缩,使肛管变直开放,便即排出。此外,LMT与TMT存在丰富的神经末梢,如Pacinian小体和肌梭,这表明二者既是运动器官,也是感觉器官。当直肠内有粪便或气体时,内括约肌松弛以刺激LMT中的Pacinian小体和TMT中的肌梭,引起EAS收缩反射,产生排便感觉[17]。
本研究发现,ARMs患儿的LMT闭合缩窄并且向前向上移位,其被分为盆部LMT和会阴部LMT。在高、中位ARMs中,盆部LMT分别在后尿道后方和直肠盲端后方向前上方移位,故高位ARMs患儿的耻骨直肠肌长度比中位ARMs短。而无论高位或中位ARMs,会阴部LMT均从后尿道向下延伸,直至肛穴的真皮深层,这导致LMT的长度与ARMs患儿肛门直肠发育不全的程度成反比(P<0.05),这一发现对LAARP的会阴部手术隧道成形至关重要。ARMs中LMT和TMT的形态可在手术前后通过MRI或CT扫描进行评估[18]。肛门成形术的目的是将直肠拖出并准确地放置于括约肌复合体中心,即LMT的中心,使直肠平滑肌纵肌与盆底横纹肌纵肌紧密相贴,形成正常的联合纵肌管。若纵肌管发育不良、术中损伤或直肠错过其中心,将会导致术后肛门松弛、黏膜脱垂,最终造成肛门失禁[19]。
本研究发现,在LMT发育良好的情况下,会阴部LMT的远端纤维在EAS皮下部呈弥散状渗透,并终止于肛穴周围的真皮深层,因此在ARMs患儿中,肛穴标志着会阴远端纵肌管的中心。纵肌发育程度越好,肛穴越深。从形态上看,ARMs患儿的LMT可看作沙漏状,在两个较小的漏斗之间有一个较长的隧道。由于在会阴部使用电刺激仪可引起浅部EAS和LMT收缩,所以在电刺激仪和腹腔镜的引导下,经腹会阴联合入路可以准确辨别并扩张位于LMT中心的潜在隧道,将直肠末端拖出。
耻骨直肠肌和EAS功能一致,共同构成了TMT[16]。耻骨直肠肌将LMT上端牵引向前,固定于耻骨联合,构成了肛门直肠角。本研究发现,ARMs患儿的耻骨直肠肌较正常新生儿窄并向前上方移位。且为了适应直肠盲端和尿道球部瘘管的大小,高位ARMs患儿的耻骨直肠肌较中位患儿更窄、更短[20]。手术中尽可能恢复肛周肌肉三管系统的结构,并最大限度减小对其的损伤是肛门实现良好控便功能的关键[21]。
Peña提出了肛门括约肌复合体的概念,该复合体由肛提肌与肛穴的一组垂直横纹肌组成[3, 22]。根据这一理论,在中线切开肛门括约肌复合体后,可通过电刺激仪使肌肉收缩,以确定复合体的中心。Shafik[16]研究表明,肛提肌作为一个整体,共同收缩或松弛,故使用Peña所描述电刺激的方法不易区分TMT和LMT。本研究表明,在中、高位ARM患儿中,肛门括约肌复合体的范围超出了LMT的界限,LMT被劈开,直肠仅被TMT包绕。
综上所述,肛周肌肉由三个肌管组成:IAST、LMT与TMT,其中TMT由耻骨直肠肌和EAS组成; LMT介于IAST与TMT之间,从肛提肌延伸至肛周真皮深层,由来自肛提肌的横纹肌纤维和来自直肠的平滑肌纤维组成。在ARMs患儿中,LMT闭合,分为盆部LMT和会阴部LMT两部分。盆部LMT向前上方移位,会阴部LMT向下延伸并融合形成纵行的柱状肌管。肛穴是会阴部LMT的中心标志。经腹腔镜和会阴联合入路,在会阴部使用电刺激仪可准确辨别LMT的中心。钝性扩张肌管中心的潜在隧道,将新直肠从中拖出,可获得更好的肛门控便功能。
| [1] |
Stephens FD. Imperforate rectum; a new surgical technique[J]. Med J Aust, 1953, 1(6): 202-203. |
| [2] |
Smith ED. The bath water needs changing, but don't throw out the baby:an overview of anorectal anomalies[J]. J Pediatr Surg, 1987, 22(4): 335-348. DOI:10.1016/s0022-3468(87)80236-1 |
| [3] |
Peña A, Devries PA. Posterior sagittal anorectoplasty:important technical considerations and new applications[J]. J Pediatr Surg, 1982, 17(6): 796-811. DOI:10.1016/s0022-3468(82)80448-x |
| [4] |
Rintala RJ, Lindahl HG. Posterior sagittal anorectoplasty is superior to sacroperineal-sacroabdominoperineal pull-throu-gh:a long-term follow-up study in boys with high anorectal anomalies[J]. J Pediatr Surg, 1999, 34(2): 334-337. DOI:10.1016/s0022-3468(99)90203-8 |
| [5] |
Tsuji H, Okada A, Nakai H, et al. Follow-up studies of anorectal malformations after posterior sagittal anorectoplasty[J]. J Pediatr Surg, 2002, 37(11): 1529-1533. DOI:10.1053/jpsu.2002.36178 |
| [6] |
Bliss DP Jr, Tapper D, Anderson JM, et al. Does posterior sagittal anorectoplasty in patients with high imperforate anus provide superior fecal continence?[J]. J Pediatr Surg, 1996, 31(1): 26-32. DOI:10.1016/s0022-3468(96)90314-0 |
| [7] |
Chung PHY, Wong CWY, Wong KKY, et al. Assessing the long term manometric outcomes in patients with previous laparoscopic anorectoplasty (LARP) and posterior sagittal anorectoplasty (PSARP)[J]. J Pediatr Surg, 2018, 53(10): 1933-1936. DOI:10.1016/j.jpedsurg.2017.10.058 |
| [8] |
Willital GH. Endosurgical intrapuborectal reconstruction of high anorectal anomalies[J]. Pediatr Endosurg Innov n'nTech, 2009, 2(1): 5-11. DOI:10.1089/pei.1998.2.5 |
| [9] |
Georgeson KE, Inge TH, Albanese CT. Laparoscopically assisted anorectal pull-through for high imperforate anus-a new technique[J]. J Pediatr Surg, 2000, 35(6): 927-931. DOI:10.1053/jpsu.2000.6925 |
| [10] |
Tainaka T, Uchida H, Tanaka Y, et al. Long-term outcomes and complications after laparoscopic-assisted anorectoplasty vs.posterior sagittal anorectoplasty for high-and intermediate-type anorectal malformation[J]. Pediatr Surg Int, 2018, 34(10): 1111-1115. DOI:10.1007/s00383-018-4323-4 |
| [11] |
Ren XH, Xu H, Jiang Q, et al. Single-incision laparoscopic-assisted anorectoplasty for treating children with intermediate-type anorectal malformations and rectobulbar fistula:a comparative study[J]. Pediatr Surg Int, 2019, 35(11): 1255-1263. DOI:10.1007/s00383-019-04549-3 |
| [12] |
Slater BJ, Kay S, Rothenberg SS. Use of the 5mm endoscopic stapler for ligation of fistula in laparoscopic-assisted repair of anorectal malformation[J]. J Laparoendosc Adv Surg Tech A, 2018, 28(6): 780-783. DOI:10.1089/lap.2017.0111 |
| [13] |
Lamy C, Duyckaerts C, Delaere P, et al. Comparison of seven staining methods for senile plaques and neurofibrillary tangles in a prospective series of 15 elderly patients[J]. Neuropathol Appl Neurobiol, 1989, 15(6): 563-578. DOI:10.1111/j.1365-2990.1989.tb01255.x |
| [14] |
Mosiello G, Capitanucci ML, Gatti C, et al. How to investigate neurovesical dysfunction in children with anorectal malformations[J]. J Urol, 2003, 170(4 Pt 2): 1610-1613. DOI:10.1097/01.ju.0000083883.16836.91 |
| [15] |
Wang C, Diao M, Li L, et al. Laparoscopic dissection and division of distal fistula in boys with rectourethral fistula[J]. J Surg Res, 2017, 211: 147-153. DOI:10.1016/j.jss.2016.11.059 |
| [16] |
Shafik A. A new concept of the anatomy of the anal sphincter mechanism and the physiology of defecation:mass contraction of the pelvic floor muscles[J]. Int Urogynecol J Pelvic Floor Dysfunct, 1998, 9(1): 28-32. DOI:10.1007/BF01900538 |
| [17] |
Peikert K, May CA. Muscle spindles in the human bulbospongiosus and ischiocavernosus muscles[J]. Muscle Nerve, 2015, 52(1): 55-62. DOI:10.1002/mus.24500 |
| [18] |
Podberesky DJ, Towbin AJ, Eltomey MA, et al. Magnetic resonance imaging of anorectal malformations[J]. Magn Reson Imaging Clin N Am, 2013, 21(4): 791-812. DOI:10.1016/j.mric.2013.04.010 |
| [19] |
Muro S, Tsukada Y, Harada M, et al. Anatomy of the smooth muscle structure in the female anorectal anterior wall:convergence and anterior extension of the internal anal sphincter and longitudinal muscle[J]. Colorectal Dis, 2019, 21(4): 472-480. DOI:10.1111/codi.14549 |
| [20] |
Liem NT, Hau BD. Long-term follow-up results of the treatment of high and intermediate anorectal malformations using a modified technique of posterior sagittal anorectoplasty[J]. Eur J Pediatr Surg, 2001, 11(4): 242-245. DOI:10.1055/s-2001-17155 |
| [21] |
杨中华, 王大斌, 刘丹, 等. 先天性肛门直肠畸形术后合并便秘患儿排便功能评定及病因探讨[J]. 临床小儿外科杂志, 2020, 19(1): 18-25. Yang ZH, Wang DB, Liu D, et al. Comprehensive assessments of defecation functions in anorectal malformation children with postoperative constipation[J]. J Clin Ped Sur, 2020, 19(1): 18-25. DOI:10.3969/j.issn.1671-6353.2020.01.004 (in Chinese) |
| [22] |
Bischoff A, Bealer J, Peña A. Controversies in anorectal malformations[J]. Lancet Child Adolesc Health, 2017, 1(4): 323-330. DOI:10.1016/S2352-4642(17)30026-3 |
 2020, Vol. 19
2020, Vol. 19


