神经母细胞瘤(neuroblastoma, NB)是儿童最常见的颅外恶性实体肿瘤,占所有儿童癌症死亡人数的1/6,超过70%的NB患儿在明确诊断时已出现原发肿瘤外形成的恶性病变[1, 2]。NB在病理学、生物学、遗传学和临床特征方面具有显著的异质性,虽然极少部分可以自发消退或分化为良性神经节神经瘤,但大部分呈现恶性进展或对多模式治疗的抵抗[3]。对于高风险NB患儿,如手术、高强度化疗、放疗、免疫治疗以及自体干细胞移植等治疗方法并未能有效提高NB的临床疗效,其5年生存率仍低于50%[4]。因此,探索NB的分子生物学特性对疾病早期诊断、治疗以及预后有着极其重要的作用。
microRNAs(miRNAs)是一组内源性、高度保守、大小为18~22个碱基的非编码单链RNA分子,其在基因的转录后调控中发挥重要的调节作用[5]。研究发现它们在多种人类肿瘤中呈异常表达,与肿瘤的恶性进展密切相关,包括神经母细胞瘤[6, 7]。据报道,与NB相关的MYCN癌基因可以通过调节miRNA而起到致癌作用[8]。但也有证据表明,一些miRNA在NB的发生过程中起着抑癌作用[5, 9]。miR-29家族是一类抑癌基因,成员包括miR-29a、miR-29b和miR-29c,在多种恶性肿瘤细胞内呈低表达,对癌细胞的生长和转移起负性调控作用[10]。本研究旨在通过检测NB组织中miR-29b的表达情况,并通过细胞实验验证其功能,为阐明miR-29b在NB中的作用机制奠定基础,以期为拓展NB的治疗方法提供参考。
材料与方法 一、实验标本收集2018年4月至2019年4月由湖南省儿童医院普外科收治的病理诊断为神经母细胞瘤的患儿组织标本,10例原发部位为肾上腺,2例来源于脊髓,肿块扩大切除后留取肿瘤组织及癌旁正常肾上腺组织,取材后立即冻存于液氮中。患儿年龄、性别、INSS分期、术前化疗情况及N-MYC的扩增情况见表 1。本研究中涉及的组织标本均得到监护人的知情同意,并通过本单位伦理委员会的批准。
|
|
表 1 12例神经母细胞瘤患儿的临床特征及肿瘤组织中miR-29b表达情况 Table 1 Clinical characteristics of 12 children with neuroblastoma and expression of miR-29b in tumor tissues |
人神经母细胞瘤系SK-N-SH购自中国科学院上海生命科学院细胞库;miRNeasy Mini RNA提取试剂盒购自德国QIAGEN公司,MiRNA-cDNA逆转录剂盒及All-in-OneTM miRNAq PCR Kit均购自美国Gene Copoeia公司,miR-29b特异性引物购自广州复能基因有限公司(序列保密);转染试剂LipofectamineTM 2000购自美国的Invitrogen公司;miR-29b mimics、miR-29b inhibitor和阴性对照(NC)均购买于上海吉玛技术制药有限公司;CCK-8试剂盒购自日本同仁化学;Transwell小室购自美国康宁公司;E-cadherin、Vimentin及β-actin兔抗人单克隆抗体购自美国CST公司。
三、实验方法1.细胞培养:SK-N-SH细胞置于含有10%胎牛血清(BI, Israel)和1%双抗(青霉素:100 U/mL;链霉素:0.1 mg/mL)的DMEM(BI, Israel)中培养,并置于含有5%CO2的37℃孵箱中培养。
2.实时定量PCR检测:利用miRNeasy Mini RNA提取试剂盒按照说明书的要求提取组织中的miRNA,并以NanoDrop ND-2000测定RNA浓度,琼脂糖凝胶电泳分析提取总RNA的完整性,并取800 ng RNA以MiRNA-cDNA逆转录剂盒进行反转录反应,选择U6 RNA作为内参对照。然后在All-in-OneTMqPCR Mix作用下进行实时定量PCR反应。反应程序是95℃变性10 min,然后是40个扩增循环(退火:60℃ 20 s;延伸72℃ 15 s)。
3. SK-N-SH细胞转染:根据试剂商(上海吉玛)说明转染miR-29b mimics、miR-29b inhibitor和阴性对照(NC)。当细胞融合度达到50%左右时进行转染,步骤如下:按照说明稀释Lipofectamine试剂,以及miR-29b mimics、miR-29b inhibitor和NC试剂;制备转染混合液,轻柔吹打混匀,室温孵育20 min;将适量的转染混合液加入到相应的细胞培养基中,轻柔摇晃混匀;将细胞置于37℃的培养箱中培养6~8 h,更换培养基,qPCR检测转染效率。
4. CCK-8检测:转染后各组细胞活性将瞬间转染完成12 h后的细胞接种到96孔板(5 000细胞/板),置于37 ℃培养箱中,分别在接种后的第1、2、3、4、5天加人CCK-8溶液孵育1~4 h,去除上清液加入DMSO在摇床上避光晃动10 min后,酶标仪测定450 nm处各组吸光度值。以上实验重复3次。
5.划痕实验:细胞转染完成后,待细胞融合度达90%左右时,用200 μL无菌移液器枪头沿培养板底部呈“1”字形划痕,用PBS洗掉脱落细胞,然后放入培养箱继续培养48 h,倒置显微镜下记录划痕0 h和48 h后相对距离。
6. Transwell侵袭实验:将转染后细胞计数接种到8 μm含有基质胶的Transwell小室中(2.5×104细胞/孔),上室内为200 μL无血清培养基,而下室内含有500 μL 10%血清的培养基。放入37 ℃、5%CO2的培养箱内培养24 h后,4%多聚甲醛固定细胞20 min,0.1%结晶紫染色20 min。最后在显微镜下观察发生侵袭的细胞,并计算每个视野下发生侵袭的细胞数。
7. Western blot实验:免疫印迹实验检测miR-29b mimics、miR-29b inhibitor和阴性对照(NC)转染后对EMT相关蛋白表达水平的影响。细胞转染48 h后,利用RIPA裂解细胞提取细胞蛋白,SDS-PAGE胶电泳进行蛋白分离,常规湿法转膜90 min,5%的脱脂奶粉封闭1 h,免疫抗体反应(稀释比例为兔抗人E-cadherin1 : 1 000;兔抗人Vimentin 1 : 1 000、β-actin 1 : 1 000;山羊抗兔二抗1 : 5 000)。ECL化学发光,凝胶成像系统显影。
四、统计学处理所有数据采用SPSS18.0进行数据的整理与分析。对于计量资料采用均数±标准差(x±s)表示,多组间比较采用方差分析,两组间比较采用t检验。以P < 0.05为差异有统计学意义。
结 果 一、神经母细胞瘤组织中miR-29b的表达情况神经母细胞瘤中miR-29b的表达水平明显低于癌旁肾上腺组织(0.35± 0.21),差异有统计学意义(t=18.15,P<0.05),详见表 1。
二、miR-29b抑制SK-N-SH细胞的活性利用CCK-8实验对转染后的细胞活性进行测定,结果显示miR-29b相关核苷酸(mimics/inhibitor/NC)瞬转入细胞第1天,miR-29b mimics即显现出抑制细胞增殖的作用,并在第3天达到抑制高峰。miR-29b mimics与miR-29b inhibitor组和NC组比较,细胞增殖能力差异有统计学意义(P<0.05);但miR-29b inhibitor与NC组比较,差异无统计学意义(P>0.05),见表 2。
|
|
表 2 miR-29b mimics和inhibitor对SK-N-SH细胞增殖的影响(x±s) Table 2 Effect of miR-29b mimics and inhibitor on proliferation of SK-N-SH cells(x±s) |
转染miR-29b mimics的SK-N-SH细胞发生侵袭但细胞数目(36.33±8.08)明显少于NC组(78.67±9.07),而miR-29b inhibitor组发生侵袭的细胞数目(112.30±11.68)多于NC组(78.67±9.07),且差异均有统计学意义(P < 0.05),见表 3、图 2。体外划痕实验结果显示,转染miR-29b inhibitor组以及NC组的SK-N-SH细胞在48 h后划痕接近愈合,愈合率达85%以上,而转染miR-29b mimics组的SK-N-SH细胞48 h后的划痕明显未愈合,愈合率仅为51.67%,见表 3、图 2。
|
|
表 3 miR-29b对SK-N-SH细胞侵袭、迁移能力的影响 Table 3 Effect of miR-29b on invasion and migration of SK-N-SH cells (x±s) |

|
Download:
|
| 图 1 Transwell小室实验检测miR-29b对SK-N-SH细胞侵袭能力的影响 A:NC组(倒置显微镜,×100);B:miR-29b mimics组(倒置显微镜,×100);C:miR-29b inhibitor组(倒置显微镜,×100) 图 2 划痕实验检测miR-29b对SK-N-SH细胞迁移能力的影响 A-C:划痕后0 h;D-F:划痕后48 h;A、D:NC组;B、E:miR-29b mimics组;C、F:miR-29binhibitor组(倒置显微镜,×100, 与NC组相比,*P<0.05) Fig. 1 Effect of miR-29b on the invasion of neuroblastoma SK-N-SH cells was detected by Transwell test Fig. 2 Effect of miR-29b on the migration of neuroblastoma SK-N-SH cells was detected by wound healing assay | |
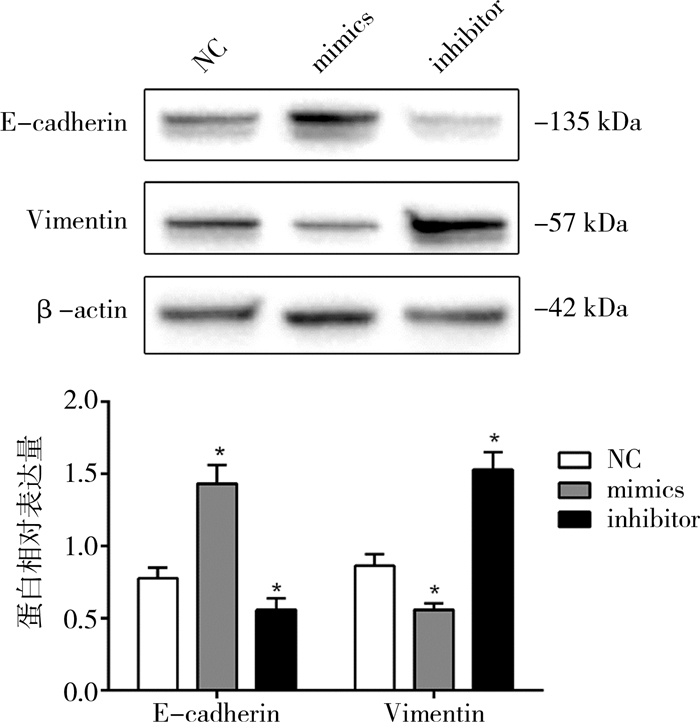
与miR-29b inhibitor组及NC组比较,转染miR-29b mimics组的SK-N-SH细胞中E-cadherin表达上调,而Vimentin表达下调;转染miR-29b inhibitor后,SK-N-SH细胞中E-cadherin表达下调,而Vimentin表达上调,差异有统计学意义(P<0.05)(图 3)。
|
Download:
|
| 图 3 Western blot检测miR-29b对SK-N-SH细胞中E-cadherin、Vimentin蛋白的表达影响(与NC组相比,*P<0.05) Fig. 3 Effect of miR-29b on the expressions of E-cadherin and Vimentin in neuroblastoma SK-N-SH cells was detected by Western blotting | |
近年来,儿童恶性肿瘤的发病率以及因恶性肿瘤引起的病死率均呈逐年上升趋势,已成为威胁儿童健康的重要问题。NB是婴幼儿最常见的恶性肿瘤,最新数据表明,肿瘤的侵袭和转移是导致NB患儿死亡的重要原因,而NB的转移率高达60%[11, 12]。对于高风险NB患儿,现阶段综合治疗的疗效十分有限,且不良反应明显,因此探索NB发病和进展的机制,寻找预防转移的靶点,发展新的治疗策略,对提高NB的疗效具有重要意义。
miRNA是最初于1993年发现的大小约为18~22个碱基的非蛋白质编码RNA,超过60%的蛋白质编码基因的表达受miRNA控制,发挥转录后表达的调节作用对转录后调控可发挥重要作用[13]。研究表明,miRNA通过对肿瘤相关基因的调节在多种侵袭性肿瘤的发生和发展中发挥抑制或促进癌细胞生长的作用[5]。研究发现miR-21、miR-22、miR-143等与NB转移及浸润有关[7, 14]。
人类miR-29家族是一类抑癌基因,在多种人类肿瘤中异常表达,但关于其具体的作用机制目前尚不明确[15]。Cheung等[16]发现miR-29a在NB中枢神经系统转移的进程中起到关键作用,并可作为NB中枢神经系统转移的生物学标志物。既往研究显示,神经祖细胞中的miR-29b表达水平明显高于神经母细胞瘤细胞[17]。Guo等[2]研究发现miR-29b在转移性NB组织的表达水平升高(Fold change=2.44)。本研究发现NB组织中miR-29b的表达水平明显低于正常肾上腺组织,提示miR-29b可能参与NB的发生发展。
大量研究表明,miR-29在肿瘤发生中的作用机制复杂,表现出抑癌和促癌的双重作用。本研究通过细胞实验探讨了miR-29b对NB的作用,发现miR-29b mimics组中miR-29b过表达后,NB细胞的增殖受到明显抑制,侵袭、迁移能力均明显下降,表明miR-29b在NB中发挥肿瘤抑制作用。研究表明miR-29b可调节某些细胞周期蛋白(MCL-1、CDK6、CCND2、CDC42等)来促进肿瘤细胞凋亡,例如miR-29b可通过上调抑癌基因p53的表达水平,或者通过抑制p85与CDC42间接活化p53,抑制肿瘤增殖[18]。肿瘤微环境是肿瘤生长、血管生成侵袭和转移所必需的[19]。Chou等[20]发现GATA3可提高miR-29b的表达水平,并通过调节GATA3-miR-29b轴来改变肿瘤微环境,抑制癌细胞转移。此外,miR-29b还可通过靶向调控涉及血管新生、胶原重蛋白酶解相关的转移前动力蛋白来抑制癌细胞转移[20]。本研究通过Transwell小室及划痕实验均证实miR-29b过表达后可明显抑制NB细胞的侵袭和迁移能力。
上皮间质转化(epithelial mesenchymal transition, EMT)是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。本实验结果显示miR-29b过表达后E-cadherin蛋白的表达水平明显增强,而Vimentin表达水平则明显降低。Sun等[21]在肺纤维化的研究中发现上调miR-29b可以逆转EMT,而miR-29b的下调则会促进EMT的发生,推测这可能与miR-29b抑制TGF-β1转录有关。Li等[22]在乳腺癌中发现,miR-29b缺失会促进EMT,增加癌细胞的侵袭性。Ru等[23]发现miR-29b可以通过调节EMT信号传导抑制前列腺癌的转移,当前列腺癌细胞过表达miR-29b后,上皮标志物E-cadherin表达增强,而N-cadherin、Twist和Snail表达下降。这与本实验结果相一致,提示miR-29b可通过促进EMT过程中的上皮转化进而抑制NB侵袭转移。
本研究通过分析NB中miR-29b的表达水平,发现miR-29b在NB组织表达下调,并初步验证了miR-29b对神经母细胞瘤的增殖以及转移的影响,这些结果为阐明NB的发病机制提供了新的视野,为发展NB的治疗新策略提供了一定的理论依据。在接下来的研究中,我们将进一步探讨miR-29b抑制NB侵袭转移的分子机制,并通过建立NB的人源肿瘤异种移植模型(PatientDerived tumor Xenograft, PDX)及体内实验深入研究miR-29b对NB成瘤及肿瘤转移的影响。
| 1 |
Boeva V, Louis-Brennetot C, Peltier A, et al. Heterogeneity of neuroblastoma cell identity defined by transcriptional circuitries[J]. Nat Genet, 2017, 49(9): 1408-1413. DOI:10.1038/ng.3921. |
| 2 |
Guo J, Dong Q, Fang Z, et al. Identification of miRNAs that are associated with tumor metastasis in neuroblastoma[J]. Cancer Biol Ther, 2010, 9(6): 446-452. DOI:10.4161/cbt.9.6.10894. |
| 3 |
Mei H, Lin ZY, Tong QS. The roles of microRNAs in neuroblastoma[J]. World J Pediatr, 2014, 10(1): 10-16. DOI:10.1007/s12519-014-0448-2. |
| 4 |
李勇, 肖雅玲, 黎明, 等. Apelin/APJ在小儿神经母细胞瘤中的表达及意义[J]. 临床小儿外科杂志, 2019, 18(2): 154-158. DOI:10.3969/j.issn.1671-6353.2019.02.017. Li Y, Xiao YL, Li M, et al. Expression and significance of Apelin/APJ in pediatric neuroblastoma[J]. J Clin Ped Sur, 2019, 18(2): 154-158. DOI:10.3969/j.issn.1671-6353.2019.02.017. |
| 5 |
Ergin K, Aktas S, Altun Z, et al. MicroRNA profiles in neuroblastoma:Differences in risk and histology groups[J]. Asia Pac J Clin Oncol, 2018, 14(5): e374-e379. DOI:10.1111/ajco.12821. |
| 6 |
Powers JT, Tsanov KM, Pearson DS, et al. Multiple mechanisms disrupt the let-7 microRNA family in neuroblastoma[J]. Nature, 2016, 535(7611): 246-251. DOI:10.1038/nature18632. |
| 7 |
Galardi A, Colletti M, Businaro P, et al. MicroRNAs in Neuroblastoma:Biomarkers with Therapeutic Potential[J]. Curr Med Chem, 2018, 25(5): 584-600. DOI:10.2174/0929867324666171003120335. |
| 8 |
Megiorni F, Colaiacovo M, Cialfi S, et al. A sketch of known and novel MYCN-associated miRNA networks in neuroblastoma[J]. Oncol Rep, 2017, 38(1): 3-20. DOI:10.3892/or.2017.5701. |
| 9 |
Lynch J, Fay J, Meehan M, et al. MiRNA-335 suppresses neuroblastoma cell invasiveness by direct targeting of multiple genes from the non-canonical TGF-beta signalling pathway[J]. Carcinogenesis, 2012, 33(5): 976-985. DOI:10.1093/carcin/bgs114. |
| 10 |
Rostas JW, Pruitt HC, Metge BJ, et al. microRNA-29 negatively regulates EMT regulator N-myc interactor in breast cancer[J]. Mol Cancer, 2014, 13: 200. DOI:10.1186/1476-4598-13-200. |
| 11 |
DuBois SG, Groshen S, Park JR, et al. Phase I study of vorinostat as a radiation sensitizer with 131I-metaiodobenzylguanidine (131I-MIBG) for patients with relapsed or refractory neuroblastoma[J]. Clin Cancer Res, 2015, 21(12): 2715-2721. DOI:10.1158/1078-0432.CCR-14-3240. |
| 12 |
Sharp SE, Gelfand MJ, Shulkin BL. Pediatrics:diagnosis of neuroblastoma[J]. Semin Nucl Med, 2011, 41(5): 345-353. DOI:10.1053/j.semnuclmed.2011.05.001. |
| 13 |
Tay Y, Rinn J, Pandolfi PP. The multilayered complexity of ceRNA crosstalk and competition[J]. Nature, 2014, 505(7483): 344-352. DOI:10.1038/nature12986. |
| 14 |
邵静波. microRNA在神经母细胞瘤的研究进展[J]. 国际儿科学杂志, 2016, 43(4): 271-274. DOI:10.3760/cma.j.issn.1673-4408.2016.04.003. Shao JB. Research progress of microRNA in neuroblastoma[J]. Int J Pediatr, 2016, 43(4): 271-274. DOI:10.3760/cma.j.issn.1673-4408.2016.04.003. |
| 15 |
Wang Y, Zhang X, Li H, et al. The role of miRNA-29 family in cancer[J]. Eur J Cell Biol, 2013, 92(3): 123-128. DOI:10.1016/j.ejcb.2012.11.004. |
| 16 |
Cheung IY, Farazi TA, Ostrovnaya I, et al. Deep MicroRNA sequencing reveals downregulation of miR-29a in neuroblastoma central nervous system metastasis[J]. Genes Chromosomes Cancer, 2014, 53(10): 803-814. DOI:10.1002/gcc.22189. |
| 17 |
Liu DZ, Ander BP, Tian Y, et al. Integrated analysis of mRNA and microRNA expression in mature neurons, neural progenitor cells and neuroblastoma cells[J]. Gene, 2012, 495(2): 120-127. DOI:10.1016/j.gene.2011.12.041. |
| 18 |
Park SY, Lee JH, Ha M, et al. miR-29 miRNAs activate p53 by targeting p85 alpha and CDC42[J]. Nat Struct Mol Biol, 2009, 16(1): 23-29. DOI:10.1038/nsmb.1533. |
| 19 |
Goubran HA, Kotb RR, Stakiw J, et al. Regulation of tumor growth and metastasis:the role of tumor microenvironment[J]. Cancer Growth Metastasis, 2014, 7(7): 9-18. DOI:10.4137/CGM.S11285. |
| 20 |
Chou J, Lin JH, Brenot A, et al. GATA3 suppresses metastasis and modulates the tumour microenvironment by regulating microRNA-29b expression[J]. Nat Cell Biol, 2013, 15(2): 201-213. DOI:10.1038/ncb2672. |
| 21 |
Sun J, Li Q, Lian X, et al. MicroRNA-29b mediates lung mesenchymal-epithelial transition and prevents lung fibrosis in the silicosis model[J]. Mol Ther Nucleic Acids, 2019, 14: 20-31. DOI:10.1016/j.omtn.2018.10.017. |
| 22 |
Li H, Solomon E, Duhachek Muggy S, et al. Metalloprotease-disintegrin ADAM12 expression is regulated by Notch signaling via microRNA-29[J]. J Biol Chem, 2011, 286(24): 21500-21510. DOI:10.1074/jbc.M110.207951. |
| 23 |
Ru P, Steele R, Newhall P, et al. miRNA-29b suppresses prostate cancer metastasis by regulating epithelial-mesenchymal transition signaling[J]. Mol Cancer Ther, 2012, 11(5): 1166-1173. DOI:10.1158/1535-7163.MCT-12-0100. |
 2020, Vol. 19
2020, Vol. 19


