2. 湖南省儿童医院普外一科(湖南省长沙市, 410007)
2. Department Ⅰ of General Surgery, Children's Hospital of Hunan Province, Changsha 410007, China
脾脏肿瘤(splenic tumor)在儿童中的发病率低,原发性脾脏肿瘤仅占全身肿瘤的0.1%左右[1]。近年来,随着儿童健康筛查以及影像学检查技术的普及,脾脏肿瘤的检出率不断升高[2]。但目前对于儿童脾脏肿瘤仍缺乏大宗病例的总结,尚无标准的分类方法,且在诊断和治疗方面仍存在争议。本研究回顾性分析湖南省儿童医院普外科儿童脾脏肿瘤病例的临床资料,对儿童脾脏肿瘤的临床特点、治疗策略及预后进行总结。
材料与方法 一、一般资料2010年1月至2019年12月由湖南省儿童医院收治的脾脏肿瘤患儿24例,其中男童14例,女童10例;年龄1个月至15岁,中位年龄7岁2个月。临床表现:有症状患儿14例,伴有一种或多种临床症状(如腹部膨隆、腹部包块、左上腹及腰部疼痛、消瘦、腹胀、皮疹、发热及呕吐等);无症状或因他疾病时检查发现5例,健康体检发现3例,孕期行四维彩超检查时发现2例。
二、术前检查所有患儿完善甲胎蛋白(alpha fetoprotein, AFP)、癌胚抗原(carcinoma embryonic antigen,CEA)以及B超、CT或MRI等检查,如考虑脾脏恶性肿瘤,建议行骨髓穿刺和18F-FDG/PET-CT检查以确定肿块性质及有无转移。术中如不能区分良恶性或需行大网膜自体脾片移植时,术中行快速冰冻病理检查,所有标本术后制作病理石蜡切片。
三、治疗及随访方法在脾脏良性肿瘤中,3例脾脏血管瘤患儿行经皮选择性动脉造影+脾脏血管瘤经动脉硬化介入栓塞术;5例行开腹脾脏切除(脾脏错构瘤1例,脾脏囊肿及脾脏淋巴管瘤各2例,其中1例脾脏囊肿行开腹脾脏囊肿开窗引流+囊肿去顶毁底术),4例脾脏淋巴管瘤行开腹脾脏切除及大网膜自体脾片移植术;8例行腹腔镜下脾脏(或部分/段)切除术(脾脏梭形细胞血管内皮瘤1例,脾脏囊肿1例,脾脏窦岸细胞血管瘤1例,上皮或表皮样囊肿3例,脾脏淋巴管瘤或脉管瘤2例)。4例脾脏恶性肿瘤(脾脏恶性外周神经鞘膜瘤1例,脾脏平滑肌肉瘤1例,脾脏淋巴瘤2例)行开腹手术和化疗治疗,手术方式为脾脏切除、脾门淋巴结清扫联合转移病灶切除及输液港植入(3例)以备术后化疗。通过门诊随访收集血常规、凝血功能、免疫功能及腹部彩超检查资料,了解患儿预后情况。
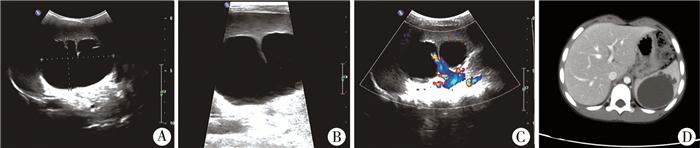
结 果 一、影像学表现本组病例B超或CT检查发现脾脏肿瘤囊性病变13例、实性6例、囊实混合性5例,脾脏囊肿与脾脏淋巴管瘤在影像学上的表现有所不同,脾脏囊肿CT增强一般无强化,但病灶边缘有弧形钙化,而脾脏淋巴管瘤边缘及间隔有轻度强化,囊壁光滑(图 1);行18F-FDG/PET-CT检查,2例发现脾脏内单发团块状放射性浓聚灶,1例为多发不规则浓聚灶,1例为整个脾脏代谢弥漫性增高,其最大标准化摄取值(standard uptake values,SUVs)为2.1~8.4,脾脏淋巴瘤病例发现颈、锁骨上下窝、纵隔、腹主动脉周围等多处淋巴结病变,4例18F-FDG/PET-CT检查提示脾脏恶性肿瘤患儿与术后病理检查结果相吻合。影像学检查发现病变单发者18例,2个及以上脾脏内病变者6例;病灶直径<5 cm者5例,>5 cm者19例;3例伴脾脏增大。B超定位诊断率为91.67%,CT、MRI或18F-FDG/PET-CT定位诊断率为100%。
|
Download:
|
| 图 1 儿童脾脏淋巴管瘤影像学表现 注 A:腹部凸阵探头示脾脏中下部膨隆,明显提示囊性占位;B:高频探头观察发现脾内囊性暗区,内有分隔;C:彩色多普勒超声提示脾内囊性暗区分隔上条状血流信号;D:CT增强示脾内囊状液暗均匀低密度影,CT值17~20 HU,囊壁光整,未见明显强化及壁结节,边缘可见多发迂曲扩张的管状结构 Fig. 1 Typical imaging features of splenic lymphangioma in children | |
20例脾脏良性肿瘤中,3例脾脏血管瘤患儿行经皮选择性动脉造影+脾脏血管瘤经动脉硬化介入栓塞术,采用平阳霉素2.0 mg+碘化油1.5 mL+地塞米松3.0 mg+碘帕醇3.0 mL介入栓塞脾脏血管瘤分支血管,以500 μ聚乙烯醇(polyvinyl alcohol, PVA)混合50%的碘帕醇进行血管瘤主干栓塞[3, 4];4例行开腹脾脏全切除术,1例行脾脏囊肿开窗引流+囊肿去顶毁底术,围术期积极抗感染、监测血小板,术后无一例出现脾脏切除术后凶险性感染(over-whelming post splenectomy infection, OPSI)及血栓形成;4例脾脏脉管畸形或脾脏淋巴管畸形患儿行脾脏切除及大网膜自体脾片移植术,术后腹部彩超发现移植脾片均有存活,且患儿免疫全套指标均正常,大网膜自体脾片移植能使脾脏切除患儿免疫功能恢复至术前水平;8例行腹腔镜下脾脏(或部分/段)切除术,其中5例行腹腔镜(或3D腹腔镜)下二级脾蒂离断脾脏段切除术,保留脾脏自身免疫功能,2例术前检查发现副脾,且术中无法明确肿块病理性质,行腹腔镜下脾脏全切除术。
4例脾脏恶性肿瘤患儿行手术及辅助化疗(3例植入输液港以备化疗用),治疗方式为脾切除术、转移灶切除及脾门淋巴结清扫。1例脾脏T细胞来源非霍奇金淋巴瘤(不排除T/NK细胞淋巴瘤)术后采用EPOCH(强的松、美罗华、长春新碱、吡柔比星、环磷酰胺)方案规律化疗;1例脾脏经典型霍奇金淋巴瘤(混合细胞型)采用FMD(氟达拉滨、米托蒽醌、地塞米松)方案规律化疗;1例脾脏恶性外周神经鞘膜瘤采用异环磷酰胺、多柔比星和依托泊苷化疗4周期后病情趋于稳定;1例脾脏平滑肌肉瘤术后5个月转移复发,最终死亡。
三、术后病理脾脏良性肿瘤17例,脾脏恶性肿瘤4例,3例脾脏血管瘤病例因行介入栓塞治疗无病理诊断。脾脏良性肿瘤包含6例脾脏囊肿(2例单纯脾脏囊肿、2例脾脏上皮样囊肿、2例脾脏表皮样囊肿并感染)、2例脾脏脉管畸形、5例脾脏淋巴管畸形、1例脾脏错构瘤、1例脾脏梭形细胞血管内皮瘤、1例脾脏海绵状血管瘤、1例脾脏窦岸细胞血管瘤。原发性恶性肿瘤的病理结果提示恶性淋巴瘤2例(1例脾脏T细胞来源非霍奇金淋巴瘤,1例脾脏经典型霍奇金淋巴瘤,混合细胞型),1例脾脏恶性外周神经鞘膜瘤,1例脾脏平滑肌肉瘤(大网膜、子宫转移);本组病例未见脾脏转移性瘤。
四、随访结果本组病例住院时间3~15 d,平均住院时间(8.31±0.72)d。围手术期无一例死亡,且均未出现腹腔内出血、膈下脓肿、胰瘘、血管栓塞等术后并发症。平均随访(12.0±8.2)个月,最短5个月,最长6年。除1例原发性脾脏肿瘤患儿术后5个月转移复发而死亡外,其余23例术后无复发转移。脾脏恶性肿瘤共4例,末次随访时间为2019年6月,总生存时间5~73个月,中位生存时间16个月。
讨 论临床上脾脏疾病不常见,脾脏发生肿瘤病变者极少,脾脏肿瘤发病率约为0.03%,可见于各个年龄段,且无性别差异[5]。本组病例中男女比例为1.36 : 1,发病年龄1个月至15岁,平均(8.9±3.0)岁,与文献报道一致。脾脏肿瘤患儿临床表现并不十分典型,部分患儿往往无临床症状,有症状者受肿瘤部位、大小、性质及继发性病理改变等诸多因素影响,具体包括:①左上腹膨隆或左腰部不适,有明显肿块压迫症状;②左腹部包块,肿瘤较大者可扪及包块,表面结节感,有触痛,多见于恶性肿瘤;③脾大及脾脏功能亢进症状,伴门静脉海绵样变性者脾脏功能亢进症状明显,但两者并不成正比;④全身症状:多有持续低热、消瘦、乏力、贫血等。此类症状多见于脾脏恶性肿瘤;⑤肿瘤自发破裂:常表现为腹痛,伴发热,甚至出现出血性休克[6]。Willcox等[7]报道小儿脾脏血管瘤自发破裂发生率高达25%。脾脏组织极脆,在临床诊治中最为危险的是肿瘤发生自发性破裂出血,需要及时抢救,否则会危及生命。本组中未见肿瘤破裂病例,可能与样本量差异有关。
术前B超、CT或MRI是脾脏肿瘤主要诊断手段,考虑恶性病变时才行骨髓穿刺和18F-FDG/PET-CT检查,确定肿块性质及有无转移[8, 9]。首选B超检查,无创且价廉,其灵敏度高,甚至有孕期四维超声诊断胎儿脾脏囊肿的报道[10]。本组中就有2例在母体孕期检查时发现,这有利于在出生后及时有效的处理,获得良好的治疗效果。脾脏良性肿瘤B超表现多为单发占位病变,有包膜局限于脾脏内,边界清内部多为低均匀回声;恶性病变则表现为多发占位病变,有突破包膜向脾脏外浸润,边界欠清内部回声不均匀。CT检查定性诊断率可达95%以上,诊断价值高,优势是可形成CT三维成像重建以及3D成像,能精准判定肿瘤与周围脏器及血管的关系,呈现出肿瘤大小形态以及血管走向,对制定手术方案有十分重要的作用,并对手术难易程度及可切除性进行评估,进而为腹腔镜下脾脏肿瘤切除治疗提供保障[11]。鉴别脾脏肿瘤良恶性方面18F-FDG/PET-CT诊断价值高于CT或MRI,尤其对脾脏恶性肿瘤或转移瘤有较强的鉴别能力,可作为一种重要的补充诊断方法,但其检查费用较高[12]。研究发现肿瘤恶性程度越高,代谢越旺盛,摄取18F-FDG就越多[13]。本组4例脾脏恶性肿瘤患儿的SUVs范围为2.1~8.4,提示恶性肿瘤,且检查发现转移病灶,与术后病理相吻合。骨髓穿刺检查有助于脾脏恶性淋巴瘤的诊断,可根据病情选择性运用,但阳性率低。病理检查是鉴别良恶性病变的金标准,但因脾脏血供丰富,穿刺活检风险较高,通常只有术后才能获得病理诊断。总之,在诊断方面主要依赖于影像学检查,对于影像学高度怀疑恶性或不能明确的病变,应积极予以手术切除。
儿童脾脏肿瘤的治疗不同于成年人,应依据患儿年龄、临床表现及术前影像学检查选择合适的治疗方法。研究发现只要保留脾脏25%以上即可保留脾脏的正常功能。故本研究建议遵循“选择性脾脏切除”的基本原则,避免“无辜性脾脏切除”,同时要求与所有肿瘤病人的治疗原则一样,以确保患儿安全为前提,尽量做到无血无瘤,减少肿瘤医源性种植,要求手术过程精细化,适当追求微创化治疗[14, 15]。目前国内外尚无脾脏肿瘤手术操作指南,但手术是首选治疗方式[16]。脾脏良性肿瘤手术指征:无症状患儿建议定期复查,注意肿瘤大小变化,但有学者提出对脾脏血管瘤直径>4 cm、有血液功能障碍、肿瘤破裂倾向的患儿建议行手术治疗[17];与恶性肿瘤难以区分,而瘤体为多发、体积大、有压迫症状等,建议行手术治疗;对于直径<5 cm的无症状脾脏囊肿(非寄生虫)建议定期复查,>5 cm或有症状者,感染和破裂的概率较大,需手术治疗;寄生虫性脾脏囊肿药物治疗无效者建议行手术治疗[18, 19]。介入栓塞治疗在脾脏血管瘤中治疗是可行的,本组脾脏血管瘤患儿介入栓塞术后恢复良好,且肿瘤明显缩小或消失,但如肿块大或治疗无效,有自发破裂风险时建议及时手术治疗[20, 21]。脾脏良性肿瘤手术方式选择也有所不同,本组早期病例以开腹行脾脏切除术较多,这与文献报道是一致的,但需高度警惕术后并发症,围术期应积极抗感染治疗,监测血小板,预防术后OPSI以及血栓形成。Luu等[22]研究中发现脾脏切除术后OPSI发生率0.1% ~8.5%,其与发病年龄、切除脾脏原因及脾脏切除后间隔时间长短有关。一旦发生OPSI,会危及生命,因此需要严格把握脾脏切除指征,尽量保留脾脏功能而预防OPSI。随着外科手术技术的提高和对脾脏免疫功能的重新认识,其手术方式也随之改进。对于较小的局限于某一段的脾脏良性肿瘤可行脾脏部分(或段)切除术,而对于病灶较大者可考虑脾脏切除后大网膜自体脾片移植,前提是术中病理检查结果提示为良性。1991年Delaitre等完成首例腹腔镜脾脏切除术(laparoscopic splenectomy, LS),其显著优势是手术时间短、出血量少,住院时间短,并发症少,效果美观[23]。
腹腔镜脾脏部分(或段)切除术是目前应用较多的且要求较高的手术方式,能最大限度地保留脾脏自身免疫功能。尹强等[24]认为腹腔镜下脾脏手术时处理脾蒂一般采用先游离再离断的方法,先动脉后静脉,特别需要注意在处理脾脏上极肿物时需要离断胃短血管,以免增加出血风险。因此,成功实施LS其挑战在于对脾脏门血管精细解剖分离二级脾蒂血管、脾脏实质离断及创面的处理,术中避免过度游离脾脏周围韧带,注意观察残余脾脏的血供情况,防止脾脏出现缺血性梗死。对于脾脏恶性肿瘤(包括脾脏转移瘤)患儿,根治性手术切除联合放化疗是其治疗原则,同时行淋巴结清扫和原发病灶切除或其他脏器切除,术中应注意完整切除,操作精细,避免种植转移,恶性肿瘤患儿可行输液港植入可备术后化疗[25, 26]。病理类型和是否存在远处转移是决定脾脏恶性肿瘤预后的重要因素[27]。对于脾脏淋巴瘤的患儿,常见的化疗方案有ECHOP、FMD等[28, 29]。本研究中恶性外周神经鞘膜瘤(malignant peripheral nerve sheath tumors, MPNST)是少见的恶性肿瘤,约占软组织肿瘤的6%[30]。MPNST的主要治疗方式是手术切除,切缘阴性,对于体积较大或有转移的晚期患儿,可以辅助放疗[31]。原发脾脏MPNST目前国内外尚未见报道,本例MPNST患儿行脾脏切除、脾脏门淋巴结清扫、输液港植入后,并完善SYT/SSX1及SYT/SSX2融合基因检测排除脾脏单向分化梭形细胞滑膜肉瘤。术后采用异环磷酰胺、多柔比星和依托泊苷化疗,未进行放疗。本组无脾脏转移瘤患儿,但对于转移瘤患儿,若为孤立脾脏转移以手术治疗为主,多器官转移不建议手术,以治疗原发病为主,术后积极化疗[28]。
脾脏肿瘤病理类型复杂,目前尚无统一的分类标准,在临床上分为脾脏良性肿瘤、脾脏恶性肿瘤和脾脏转移瘤。脾脏良性肿瘤较多见,约占脾脏肿瘤的60% ~70%,脾脏囊肿在脾脏良性肿瘤中最常见,其次是脾脏淋巴管瘤、血管瘤和错构瘤,本研究结果与文献报道类似[32]。脾脏恶性肿瘤有脾脏淋巴瘤、血管肉瘤、淋巴管肉瘤等,以脾脏淋巴瘤最多见,脾脏转移瘤罕见,偶有结肠癌、肝癌及卵巢癌等肿瘤发生脾脏转移的报道[33]。本组病例无脾脏转移瘤患儿。脾脏肿瘤在不出现严重并发症的情况下大多预后良好,脾脏恶性肿瘤不同病理类型预后不一,以手术为主的综合治疗可提高预后,脾脏肉瘤生长迅速、短期内可转移,预后最差。
在脾脏肿瘤的治疗中,尤其对脾脏良性肿瘤必须遵循“能保则保,该切则切”基本原则,尽量避免“无辜性脾脏切除”,预防OPSI综合征是重点,手术方法选择多样。对脾脏恶性肿瘤争取早诊治,强调以根治性手术为主,结合放化疗的综合治疗,能有效改善预后。腹腔镜技术和达芬奇机器人手术系统的引入使得脾脏外科手术更趋微创和精准,其适应证也持续拓宽。
| 1 |
黄珊, 徐冰, 胡耀宗, 等. 小儿脾脏良性肿瘤的诊治[J]. 肝胆外科志, 2018, 26(2): 126-129. DOI:10.3969/j.issn.1006-4761.2018.02.014. Huang S, Xu B, Hu YZ, et al. Surgical diagnosis and treatment of splenic benign tumors in children[J]. Journal of Hepatobiliary Surgery, 2018, 26(2): 126-129. DOI:10.3969/j.issn.1006-4761.2018.02.014. |
| 2 |
Silver DS, Pointer DT, Slakey DP. Solid tumors of the spleen:evaluation and management[J]. J Am Coll Surg, 2017, 224(6): 1104-1111. DOI:10.1016/j.jamcollsurg.2016.12.043. |
| 3 |
Zheng L, Deng CL, Li J, et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy:A ease report[J]. Medicine (Baltimore), 2018, 97(17): 1-4. DOI:10.1097/MD.0000.000000009940. |
| 4 |
Liu QD, Song Y, Zhou NX, et al. Radiofrequeney ablation of splenic tumors:a case series[J]. J Gastrointestin Liver Dis, 2013, 22(1): 105-108. |
| 5 |
李宗芳, 张澍. 脾脏的基础研究进展与展望[J]. 西安交通大学学报(医学版), 2008, 29(1): 1-5. DOI:10.3969/j.issn.1671-8259(2008)01-0001-06. Li ZF, Zhang S. The progress and prospect of fundamental research of the spleen[J]. Journal of Xi'an Jiaotong University (Medical Sciences), 2008, 29(1): 1-5. DOI:10.3969/j.issn.1671-8259(2008)01-0001-06. |
| 6 |
Boyer TD, Habib S. Big spleens and hypersplenism:fix it or forget it?[J]. Liver Int, 2015, 35(5): 1492-1498. DOI:10.1111/liv.12702. |
| 7 |
Willcox TM, Speer RW, Schlinkert RT, et al. Hemangioma of the spleen:presentation, diagnosis and management[J]. J Gastrointest Surg, 2000, 4(6): 611-613. DOI:10.1016/s1091-255x(00)80110-9. |
| 8 |
Vancauwenberghe T, Snoeckx A, Vanbeckevoort D, et al. Imaging of the spleen:what the clinician needs to know[J]. Singapore Med J, 2015, 56(3): 133-144. DOI:10.11622/smedj.2015040. |
| 9 |
Jang S, Kim JH, Hur BY, et al. Role of CT in Differentiating Malignant Focal Splenic Lesions[J]. Korean J Radiol, 2018, 19(5): 930-937. DOI:10.3348/kjr.2018.19.5.930. |
| 10 |
Sepulveda W, Ochoa JH, Cafici D, et al. Splenic cyst as a rare cause of fetal abdominal cystic mass:A multicenter series of nine cases and review of the literature[J]. Ultrasound, 2018, 26(1): 22-31. DOI:10.1177/1742271X17747138. |
| 11 |
Siwon J, Jung HK, Bo YH, et al. Role of CT in differentiating malignant focal splenic lesions[J]. Korean J Radiol, 2018, 19(5): 930-937. DOI:10.3348/kjr.2018.19.5.930. |
| 12 |
Nobashi T, Baratto L, Reddy SA, et al. Predicting response to immunotherapy by evaluating tumors, lymphoid cell-rich organs and immune-related adverse events using FDG-PET/CT[J]. Clin Nucl Med, 2019, 44(4): e272-e279. DOI:10.1097/RLU.0000000000002453. |
| 13 |
Zhao Q, Dong A, Wang Y, et al. FDG PET/CT in primary splenic angiosarcoma with diffuse involvement of the spleen[J]. Clin Nucl Med, 2017, 42(10): 815-817. DOI:10.1097/RLU.0000000000001805. |
| 14 |
Alan FU, Paolo G, Kendall K, et al. Laparoscopic Splenectomy:Has It Become the Standard Surgical Approach in Pediatric Patients?[J]. J Surg Res, 2019, 240: 109-114. DOI:10.1016/j.jss.2019.02.045. |
| 15 |
Cheng J, Tao KX, Yu PW. Laparoscopic splenectomy is a better surgical approach for spleen-relevant disorders:a comprehensive metaanalysis based on 15-year literatures[J]. Surg Endosc, 2016, 30(10): 4575-4588. DOI:10.1007/s00464-016-4795-z. |
| 16 |
Jiang HC, Liu LX, Wang JZ, et al. Can the spleen be divided into two functional parts?[J]. J Clin Gastroenterol, 2014, 48(3): 261-263. DOI:10.1097/MCG.Ob013e31829e4534. |
| 17 |
Choi W, Choi YB. Splenic embolization for a giant splenic hemangioma in a child:a case report[J]. BMC Pediatr, 2018, 18(1): 354. DOI:10.1186/s12887-018-1331-4. |
| 18 |
马盼飞, 麻勇, 姜洪池. 脾囊肿外科处理的变迁及今日观[J]. 中华肝脏外科手术学电子杂志, 2019, 8(2): 104-107. DOI:10.3877/cma.j.issn.2095-3232.2019.02.006. Ma PF, Ma Y, Jiang HC. The changes and present views of surgical management of splenic cyst[J]. Chinese Journal of Hepatic Surgery, 2019, 8(2): 104-107. DOI:10.3877/cma.j.issn.2095-3232.2019.02.006. |
| 19 |
Eris C, Akbulut S, Yildiz MK, et al. Surgical approach to splenic hydatid cyst:single center experience[J]. Int Surg, 2013, 98(4): 346-353. DOI:10.9738/INTSURG-D-13-00138.1. |
| 20 |
Guan YS, Hu Y. Clinical application of partial splenic embolization[J]. Scientific World Journal, 2014, 2014: 961345. DOI:10.1155/2014/961345. |
| 21 |
Grzesik P, Wu JK. Current perspectives on the optimal management of infantile hemangioma[J]. Pediatric Health Med Ther, 2017, 8: 107-116. DOI:10.2147/PHMT.S115528. |
| 22 |
Luu S, Spelman D, Woolley IJ. Post-splenectomy sepsis:preventative strategies, challenges, and solutions[J]. Infect Drug Resist, 2019, 12: 2839-2851. DOI:10.2147/IDR.S179902. |
| 23 |
徐冰, 彭兵, 曹李明, 等. 儿童腹腔镜脾切除术35例分析[J]. 临床小儿外科杂志, 2013, 12(3): 216-218. DOI:10.3969/jissn.1671-6353.2013.03.016. Xu B, Peng B, Chao LM, et al. Laparoscopic splenctomy in children:a report of 35 cases[J]. J Clin Ped Sur, 2013, 12(3): 216-218. DOI:10.3969/jissn.1671-6353.2013.03.016. |
| 24 |
尹强, 周小渔, 刘朝阳, 等. 小儿全腹腔镜下脾切除术体位与显露探讨[J]. 临床小儿外科杂志, 2017, 16(1): 73-76. DOI:10.3969/jissn.1671-6353.2017.01.017. Yin Q, Zhou XY, Liu CY, et al. Position choice and exposure technique during pediatric laparoscopic splenctomy[J]. J Clin Ped Sur, 2017, 16(1): 73-76. DOI:10.3969/jissn.1671-6353.2017.01.017. |
| 25 |
Sauer J, Sobolewski K, Dommisch K. Splenic metastases-not a frequent problem, but an underestimate location of metastases:epidemiology and course[J]. J Cancer Res Clin Oncol, 2009, 135(5): 667-671. DOI:10.1007/s00432-008-0502-3. |
| 26 |
Rizzo F, Calamia S, Mingoia G, et al. Isolated metachronous splenic metastasis from colon cancer:possible explanations for this rare entity[J]. J Gastrointest Cancer, 2019, 50(1): 143-146. DOI:10.1007/s12029-017-9992-z. |
| 27 |
Wakasugi M, Yasuhara Y, Nakahara Y, et al. Primary splenic malignant lymphoma mimicking metastasis of rectosigmoid cancer:a case report[J]. Int J Surg Case Rep, 2018, 44: 11-15. DOI:10.1016/j.ijscr.2018.01.022. |
| 28 |
Kalpadakis C, Pangalis GA, Angelopoulou MK, et al. Treatment of splenic marginal zone lymphoma[J]. Best Pract Res Clin Haematol, 2017, 30(1-2): 139-148. DOI:10.1016/j.beha.2016.07.004. |
| 29 |
Byrd KP, Vontela NR, McCullar B, et al. Multi-database description of primary splenic diffuse large B-cell lymphoma[J]. Anticancer Res, 2017, 37(12): 6839-6843. DOI:10.21873/anticanres.12145. |
| 30 |
Jo VY, Doyle LA. Refinements in sarcoma classification in the current 2013 World Health Organization Classification of Tumours of Soft Tissue and Bone[J]. Surg Oncol Clin N Am, 2016, 25(4): 621-43. DOI:10.1016/j.soc.2016.05.001. |
| 31 |
Zhen NY, Li BX, Zhen GZ., et al. Clinicopathological features and prognosis of malignant peripheral nerve sheath tumor:a retrospective study of 159 cases from 1999 to 2016[J]. Oncotarget, 2017, 8(62): 104785-104795. DOI:10.18632/oncotarget.18975. |
| 32 |
Morgenstern L, Rosenberg J, Geller SA. Tumors of the spleen[J]. World J Surg, 1985, 9(3): 468-476. DOI:10.1007/BF01655283. |
| 33 |
Dimitrov Dimitrov D. Laparoscopic splenectomy for solitary splenic metastasis in patients with previous open surgery-case series[J]. Int J Surg Case Rep, 2019, 65: 83-86. DOI:10.1016/j.ijscr.2019.10.044. |
 2020, Vol. 19
2020, Vol. 19


