脊髓栓系综合征(tethered cord syndrome, TCS)多见于儿童或青少年,处于生长发育期的患儿往往会呈现进行性加重,严重者可导致肾功能衰竭。目前多采用脊髓栓系松解术来防止神经损伤进一步恶化,但对于已存在的神经损伤基本无治疗意义[1]。因此,重建TCS患儿的膀胱功能可能对治疗儿童TCS伴神经源性膀胱功能障碍具有重要意义。
Channelrhodopsin-2 (ChR2)作为一种感光性蛋白质,来自于单细胞绿色藻类[2]。在特定的光谱照射条件下,ChR2可快速形成光电流,使细胞发生去极化,引发兴奋,从而实现对体内神经细胞的精准调控[3]。该技术目前已经应用于多个生理学研究领域,但在治疗儿童TCS伴发神经源性膀胱功能障碍方面还未见报道[4]。本研究通过动物实验,将重组后的Ad-EGFP-ChR2腺病毒载体精确转染至支配膀胱逼尿肌骶髓中间外侧柱的副交感神经核(sacral parasympathetic nucleus, SPN)内,给予特定光谱照射刺激活化兴奋SPN,模拟排尿中枢的神经活动,旨在评估光感基因技术对修复TCS伴神经源性膀胱功能的可行性,为儿童TCS伴神经源性膀胱的临床治疗提供实验理论基础。
材料与方法 一、实验材料(一)实验动物
实验动物由中国人民解放军军事医学科学院动物所提供,本研究共纳入雌性大鼠46只,体重(60±10)g,鼠龄4周。常规饲养1周,饲养间室温21℃ ~25℃,相对湿度40% ~60%,供应无菌饲料和无菌水并自由摄食、饮水,每日光照8 h,检疫合格,实验在伦理委员会动物指导协议下进行,建模前12 h禁食禁饮。尿动力学检查指标(膀胱最大容量、逼尿肌漏点压、残余尿量)均无异常。随机分为健康对照组(15只,仅作背部皮肤肌肉切开和缝合)、脊髓栓系有光感基因组(15只,转染光感基因ChR2)和脊髓栓系无光感基因组(16只,未转染光感基因ChR2)。
(二)主要试剂和仪器
10%水合氯醛溶液(中国人民解放军陆军总医院,用于麻醉);MP-150生物机能实验系统(美国泰德科技有限公司,用于尿动力学测定);UVP凝胶成像系统(美国UVP公司,用于Western blot检测);NGF酶联免疫(enzyme-linked immunosorbent assay,ELISA)试剂盒[中国宝生物工程有限公司,用于尿液中神经生长因子(nerve growth factor, NGF)含量的定量分析];NGFβ一抗(中国宝生物工程有限公司,用于Western blot检测);辣根过氧化物酶标记的鼠抗兔二抗(中国宝生物工程有限公司,用于Western blot检测)。
二、实验方法(一)动物模型的建立
未成年雌性大鼠麻醉后沿背部腰骶正中打开椎管腔,剪开硬脊膜,显露脊髓及终丝,将质量为5 g的砝码悬吊在终丝下纵向牵拉,使脊髓牵拉下移,人为造成脊髓组织变性坏死,引起神经损害。为形成永久性脊髓栓系,把下移的脊髓固定在椎管旁的组织上,然后缝合肌层及皮肤,后行尿流动力学检测。采用KEYPOINT 4M/4C标准型肌电图仪及多导诱发电位仪分别对所有动物进行术前、术后体感诱发电位(somatosensory evoked potential, SEP)检测。根据诱发电位学规律,建模后的动物与建模前相比SEP波幅降低(不超过1/3),潜伏期延长(不超过2.5 ms)可认为建模成功[5]。
(二) ChR2基因载体的构建及转染
腺病毒载体Ad-EGFP-ChR2由中国科学院北京基因组研究所构建。将构建成功的腺病毒载体Ad-EGFP-ChR2转染至支配膀胱逼尿肌的骶髓中间外侧柱内的副交感神经核,免疫荧光反应观察发现转染组阳性细胞的胞体和突起有绿色荧光表达,表明腺病毒载体Ad-EGFP-ChR2转染成功。
(三)蓝光刺激
建立脊髓栓系神经源性膀胱动物模型后,显微镜下用显微器械切开腰骶段硬膜囊,根据定位坐标值(脊髓正中两侧0.2 mm,深度0.5 mm)在双侧SPN内上中下各三点注射0.1 μL的Ad-EGFP-ChR2腺病毒载体(病毒量为1.0×108单位),注射后留针10 min。选择合适大小的蓝光LED发光二极管缝合于切口,光源朝向硬膜囊,距离硬膜囊约2 mm处将二极管与周围肌肉筋膜缝合固定,因二极管较椎板减压范围大,借助剩余椎板的阻挡作用,从而避免二极管对脊髓的压迫,可将发光二极管正负极置于皮下,以便与电源连接。用电脑程序掌控二极管的发光频率和节律。每次持续15 min,每日重复3次,照射至2周(图 1)。
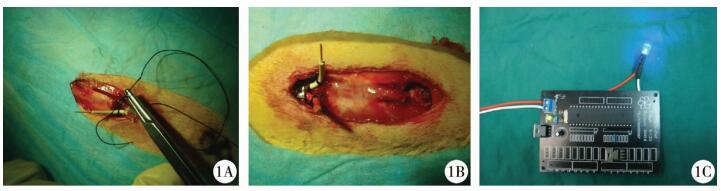
|
Download:
|
| 图 1 LED蓝光光源置入 Fig. 1 LED blue light source placement | |
(一)尿动力学测定
固定四肢及头部,大鼠在无麻醉状态下切开组织显露膀胱,将头皮针穿入膀胱穹窿处当作膀胱测压管,在穿刺处行浆肌层荷包缝合;膀胱测压导管通过三通管一端与尿动力仪连接,另一端和微量灌注泵连接;生理盐水灌注膀胱,通过MP-150生物机能实验系统观察尿动力学变化的各项指标(图 2)。

|
Download:
|
| 图 2 尿动力学测定 A.MP150生理信号分析系统B.BYZ-810单通道注射泵C.膀胱穿刺测尿动力 Fig. 2 Measurements of urinary dynamics | |
(二)神经生长因子NGF的测定
1.尿中NGF检测方法 用离心管采集不同组间动物的尿液2 mL,离心8 min,温度5℃,6 000 r/min,离心机离心后取上清液置于1.5 mL冻存管中,-80℃保存。尿液中NGF含量通过ELISA法测定。NGF酶联免疫试剂盒由中国宝生物工程有限公司提供,具体操作步骤严格按照试剂盒说明书进行,用每组样本尿液中NGF含量/尿肌酐值Cr进行标准化[6]。
2.膀胱组织NGF蛋白的检测 ①组织蛋白的提取:取90 mg膀胱组织剪碎后置于RIPA组织裂解液中并在冰上匀浆,充分裂解后将其置于5 ℃离心机15 000 r·min-1离心10 min,移去上清液;②BCA蛋白定量:检测蛋白表达分别配制10%分离胶和5.0%的浓缩胶,将上样样品与缓冲液等体积混合,100℃加热8 min使蛋白变性。将变性的蛋白用微量进样器每孔加入10 μL,80 V恒流电泳,之后在2 mA/m2恒定电流作用下进行转膜。通过上样后浓缩胶与分离胶分别采用90 V、120 V电压进行电泳,电泳后200 mA湿转至PVDF膜上,将PVDF膜用5%脱脂牛奶封闭过夜后,一抗NGFβ(1 : 500,兔多克隆IgG)室温下放置2 h,清洗PVDF膜,辣根过氧化物酶标记的鼠抗兔二抗(1 : 1 000)室温下放置1.5 h,清洗PVDF膜,进行DBA显色反应。用凝胶成像分析系统分析图像。
四、统计学方法采用SPSS18.0软件包进行统计学分析,计量资料以(x±s)表示。三组间计量资料的对比采用单因素方差分析,两两比较采用SNK-Q检验。P<0.05为差异有统计学意义。
结 果 一、尿动力学结果与健康对照组比较,脊髓栓系无光感基因组膀胱容量减小,顺应性降低,逼尿肌漏点压升高,残余尿量增多,差异有统计学意义(P < 0.05)。脊髓栓系有光感基因组与脊髓栓系无光感基因组相比,膀胱最大容量增加,顺应性升高,逼尿肌漏点压降低,残余尿量减少,差异有统计学意义(P < 0.05)。脊髓栓系有光感基因组与健康对照组相比,尿动力学各项指标差异无统计学意义(P>0.05),见表 1。
|
|
表 1 不同组间尿动力学指标对比(x±s) Table 1 Urodynamic parameters of three groups(x±s) |
与健康对照组相比,脊髓栓系无光感基因组NGF含量、NGF/Cr值均增加,差异有统计学意义(P < 0.05);与脊髓栓系无光感基因组相比,脊髓栓系有光感基因组NGF含量、NGF/Cr值均减少,差异有统计学意义(P < 0.05);脊髓栓系有光感基因组NGF含量、NGF/Cr值与健康对照组相比差异无统计学意义(P>0.05),见表 2。
|
|
表 2 不同组间尿液NGF、NGF/Cr值的比较(x±s) Table 2 Comparison of urine NGF and NGF/Cr values between different groups(x±s) |
膀胱组织中NGF蛋白表达的Western-blot检测结果显示,脊髓栓系无光感基因组的蛋白表达量高于健康对照组(P < 0.05);脊髓栓系有光感基因组与脊髓栓系无光感基因组相比,NGF蛋白表达量降低(P < 0.05);与健康对照组相比,脊髓栓系有光感基因组NGF蛋白表达量无显著性差异(P>0.05)。见图 3。

|
Download:
|
| 图 3 不同组间膀胱组织NGF的表达情况 Fig. 3 Expression of NGF in bladder tissue between different groups | |
近年来对儿童TCS诱发的神经源性膀胱的治疗多采用在间歇式导尿的基础上联合抗胆碱药物及手术进行综合治疗的方法,但因无菌操作要求高,易产生耐药性,术后并发症较多,常不易被患儿及家属接受。骶神经前根电刺激重建膀胱功能虽已运用于临床,但尚未取得满意疗效[7]。因此,探索新的方法治疗儿童TCS诱发的神经源性膀胱功能障碍具有重要意义。
既往研究发现,将ChR2基因载体转染至哺乳动物细胞后在保持细胞完整性的前提下可安全、稳定、持久表达[8]。Karl[9]成功将ChR2光感基因通过基因转染技术转入动物细胞内,在特定波长的蓝光刺激下使细胞兴奋。随后,该技术在脑神经回路研究方面被大量应用。本研究成功建立脊髓栓系动物模型,将构建的腺病毒载体Ad-EGFP-ChR2转染至未成年大鼠骶髓双侧SPN内。
尿动力学检查被认为是诊断儿童TCS伴神经源性膀胱临床类型、评估严重程度的理想方法,进而为临床治疗提供客观依据[10]。有研究表明TCS患儿上尿路损害与逼尿肌顺应性降低、逼尿肌漏点压升高、残余尿量增多的关系均较为密切[11]。本研究给予特定蓝光照射,脊髓栓系有光感基因组的尿动力学指标均接近于健康对照组,表明ChR2可以通过激活SPN参与排尿中枢的神经活动,进而改善膀胱功能。
在泌尿系统中,NGF主要分布在膀胱上皮、黏膜下组织、平滑肌和神经纤维,而尿液中NGF主要由尿路上皮细胞和平滑肌细胞形成[12]。Steers等[13]已通过动物实验证实NGF与膀胱功能存在直接的关系。Allen等[14]则通过动物模型证实,当膀胱处于过度活动状态时,其上皮及平滑肌细胞可释放大量NGF。与脊髓栓系无光感基因组相比,脊髓栓系有光感基因组中NGF的表达量降低且接近于健康对照组。因此可以认为,蓝光刺激转染ChR2的SPN后,会降低膀胱上皮组织NGF表达。同时与正常者相比,神经源性膀胱患者尿液中NGF、NGF/Cr水平显著上升,且与症状的严重程度呈正相关[15]。我们通过ELISA试验进行不同组间尿液NGF、NGF/Cr值的比较,发现脊髓栓系无光感基因组尿液NGF、NGF/Cr值增加,而经过一定蓝光照射后,脊髓栓系有光感基因组尿液NGF、NGF/Cr值降低,神经源性膀胱的症状减轻。
综上所述,本研究通过观察未成年大鼠尿动力学指标、膀胱组织NGF的表达及尿液中NGF的含量变化情况,进一步验证了光感基因技术修复TCS伴神经源性膀胱的可行性。
| 1 |
张华楸, 孙炜, 淦超, 等. 儿童脊髓栓系综合征的手术治疗[J]. 中国微侵袭神经外科杂志, 2014, 19(4): 148-150. DOI:10.11850/j.issn.1009-122X.2014.04.002. Zhang HQ, Sun W, Jin C, et al. Surgical treatment of children with tethered cord syndrome[J]. Chinese Journal of Minimally Invasive Neurosurgery, 2014, 19(4): 148-150. DOI:10.11850/j.issn.1009-122X.2014.04.002. |
| 2 |
张志成, 孙天胜, 李放, 等. 光感基因调控技术-研究和治疗神经系统疾病的新方法[J]. 中国微侵袭神经外科杂志, 2013, 18(6): 280-282. DOI:10.11850/j.issn.1009-122X.2013.06.016. Zhang ZC, Sun TS, Li F, et al. Photosensitive gene regulation technology:a new method for research and treatment of neurological diseases[J]. Chinese Journal of Minimally Invasive Neurosurgery, 2013, 18(6): 280-282. DOI:10.11850/j.issn.1009-122X.2013.06.016. |
| 3 |
Greenberg KP, Pham A, Werblin FS. Differential targeting of optical neuromodulators to ganglion cell soma and dendrites allows dynamic control of center-surround antagonism[J]. Neuron, 2011, 69(4): 713-720. DOI:10.1016/j.neuron.2011.01.024. |
| 4 |
Hgglund M, Borgius L, Dougherty KJ, et al. Activation of groups of excitatory neurons in the mammalian spinal cord or hindbrain evokes locomotion[J]. Nat Neurosci, 2010, 13(2): 246-252. DOI:10.1038/nn.2482. |
| 5 |
Yamada S, Won DJ, Pezeshkpour G. Pathophysiology of tethered cord syndrome and similar complex disorders[J]. Neurosurg Focus, 2007, 23(2): E6. DOI:10.3171/foc-07/08/e6. |
| 6 |
Wang LW, Han XM, Chen CH, et al. Urinary brain derived neurotrophic factor:a potential biomarker for objective diagnosis of overactive bladder[J]. Int Urol Nephrol, 2014, 46(2): 341-347. DOI:10.1007/s11255-013-0540-x. |
| 7 |
Martens FM, Heesakkers JP. Clinical results of a brindley procedure:sacral anterior root stimulation in combination with a rhizotomy of the dorsal roots[J]. Advance in Urology, 2011, 659(7): 1-7. DOI:10.1155/2011/709708. |
| 8 |
Gunaydin LA, Yizhar O, Berndt A, et al. Ultrafast optogenetic control[J]. Nat Neurosci, 2010, 13(3): 387-392. DOI:10.1038/nn.2495. |
| 9 |
Boyden ES, Zhang F, Bamberg E, et al. Millisecond-timescale, genetically targeted optical control of neural activity[J]. Nat Neurosci, 2005, 8(9): 1263-1268. DOI:10.1038/nn1525. |
| 10 |
刘福云, 师红, 齐艳, 等. 小儿脊髓栓系综合征尿动力学检查及手术治疗[J]. 郑州大学学报(医学版), 2003, 38(2): 159-162. DOI:10.3969/j.issn.1671-6825.2003.02.003. Liu FY, Shi H, Qi Y, et al. Urodynamic examination and surgical treatment of pediatric tethered cord syndrome[J]. Journal of Zhengzhou University (Medical Edition), 2003, 38(2): 159-162. DOI:10.3969/j.issn.1671-6825.2003.02.003. |
| 11 |
李梁斌, 杨艳芳, 李星, 等. 儿童脊髓栓综合征伴神经源性膀胱的治疗策略[J]. 中国实用神经疾病杂志, 2017, 20(10): 82-84. DOI:10.3969/j.issn.1673-5110.2017.10.031. Li LB, Yang YF, Li X, et al. Treatment strategies for children with spinal cord syndrome and neurogenic bladder[J]. Chinese Journal of Practical Neurology, 2017, 20(10): 82-84. DOI:10.3969/j.issn.1673-5110.2017.10.031. |
| 12 |
程涛, 双卫兵, 张敏, 等. 脊髓损伤大鼠膀胱顺应性与神经生长因子表达的相关性研究[J]. 中国药物与临床, 2016, 16(7): 936-939. DOI:10.11655/zgywylc2016.07.003. Chen T, Shang WB, Zhang M, et al. Correlation between bladder compliance and expression of nerve growth factor in rats with spinal cord injury[J]. Chinese Remedies & Clinics, 2016, 16(7): 936-939. DOI:10.11655/zgywylc2016.07.003. |
| 13 |
杨明州, 沈艳丽, 杨进益. 尿液NGF与BOO伴发OAB疾病关系的研究进展[J]. 临床泌尿外科杂志, 2015, 30(4): 370-372. DOI:10.13201/j.issn.1001-1420.2015.04.026. Yang MZ, Shen YL, Yang JY. Research advances in the relationship between urine NGF and BOO associated with OAB disease[J]. Journal of Clinical Urology, 2015, 30(4): 370-372. DOI:10.13201/j.issn.1001-1420.2015.04.026. |
| 14 |
Allen SJ, Dawbarn D. Clinical relevance of the neurotrophins and their receptors[J]. Clinical Science, 2006, 110(2): 175-191. DOI:10.1042/cs20050161. |
| 15 |
刘煜, 蒋远斌, 王曦, 等. 尿液神经营养因子在筛查诊断及评估女性腺性膀胱中的应用探究[J]. 新疆医科大学学报, 2018, 41(10): 1223-1227. DOI:10.3969/j.issn.1009-5551.2018.10.007. Liu Y, Jiang YB, Wang X, et al. Application of urine neurotrophic factor in screening diagnosis and evaluation of female glandular bladder[J]. Journal of Xinjiang Medical University, 2018, 41(10): 1223-1227. DOI:10.3969/j.issn.1009-5551.2018.10.007. |
 2020, Vol. 19
2020, Vol. 19


