2. 海南省妇女儿童医学中心小儿神经外科(海南省海口市, 570206)
2. Department of Pediatric Neurosurgery, Hainan Women and Children's Medical Center, Haikou 570206, China
神经管畸形(neural tube defects, NTDs)是由于胚胎发育第3~4周时神经管闭合不全所致,为最常见的神经系统出生缺陷,约占新生儿神经系统出生缺陷的38.6%,为仅次于先天性心脏病的第二位出生缺陷性疾病。新生儿出生缺陷的死亡病例中,神经管畸形约占29%[1]。NTDs发病率存在地区差异,世界范围内NTDs总体发病率约为0.5/1 000~2/1 000,其中欧洲和北美地区最低,分别为0.96/1 000和0.5/1 000,南亚最高为3.1/1 000,包括我国在内的东亚地区为1.9/1 000[2, 3]。据文献报道甘肃、云南、山西等省份NTDs发生率高达1/200,云南陆良地区的NTDs患儿占比超过全国总病例数的13%[4, 5]。神经管畸形包括无脑畸形、脑膨出、脊柱裂等,其中脊柱裂和无脑畸形是最常见的两种类型,症状严重者,如无脑畸形可以致死,轻者如无合并脊髓损伤的单纯腰骶椎椎板未闭合者可无症状[6]。神经管畸形确切病因尚未完全知晓,孕期叶酸缺乏为常见病因之一,危险因素包括孕母胰岛素依赖型糖尿病、肥胖、社会经济地位低下、家族史(基因)、服用如丙戊酸钠类和甲氧苄胺嘧啶等药物[2]。
神经管畸形的围生期处理在过去30年经历了飞跃式发展。以往神经管畸形在出生时才能被发现或者表现不明显而被漏诊,病死率高且预后极差;随着产前诊断及针对性处理手段的进步,围生期处理理念进一步更新,包括主动预防、加强孕期产检及咨询、分娩方式及时机的选择、针对性处理计划等,极大地提高了NTDs患儿的生存率及生活质量。比如围孕期叶酸补充已成功将神经管缺陷病例数减少50% ~70%,发病率由原来的1.46/1 000活产婴儿降至0.81/1 000[2, 7]。另外,自上世纪70年代开始NTDs产前筛查后,NTDs病例数显著增加,而初级预防(叶酸补充)结合次级预防(产前筛查、终止妊娠)使NTDs出生率明显下降[8]。本文就神经管畸形的围生期处理及其最新进展做一综述。
一、产前筛查与诊断产前筛查与诊断的方法分为非侵入性和侵入性两大类,包括母体血清甲胎蛋白(alpha fetoprotein, AFP)测量、胎儿影像学检查如超声和MRI、羊膜穿刺术等[9]。为提高筛查精确性,降低假阳性率,推荐筛查应在妊娠中期孕15~22周进行[9];影响筛查精确性的重要因素包括:NTDs类型、胎龄、孕母胰岛素依赖型糖尿病、多胎妊娠、胎儿合并畸形等[9]。
(一)非侵入性方法
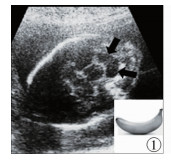
1.产前超声:超声以其安全、经济、敏感等特点已成为筛查胎儿畸形(包括NTDs)的首选。超声对NTDs的检测率在不同国家有所差别,加拿大为68% ~94%,欧洲为68%,哥伦比亚为86%[10];欧洲母胎学会指南推荐:对于所有妊娠中期(18~22周)的孕母,均应常规采用超声筛查胎儿先天性畸形[11]。超声优点明显,在筛查NTDs时,与孕母血清AFP相比,超声敏感性更高,假阳性率更低;而与有创性的羊水穿刺相比,超声更安全,因为羊水穿刺会增加羊水感染及自发流产的风险[11];此外,最重要的是单次超声检查可检测出多种胎儿先天性畸形[11]。妊娠中期NTDs的超声表现:颅顶部缺如及面部严重畸形提示无脑畸形;若为开放性神经管畸形,则超声特点明显,98%的开放性神经管畸形可见异常的头颅外形即“柠檬征”(图 1),后颅窝改变、小脑延长的“香蕉征”(图 2),胸腰骶部椎骨后椎弓异常或缺如,偶可见各脑室增大、增宽;若为闭合性神经管畸形,则可明显见到椎骨后方缺如处突出的厚厚的脊髓脊膜膨出囊,偶可见“柠檬征”与“香蕉征”;部分胎儿中可见到下肢活动异常及双足位置异常[11]。超声筛查胎儿NTDs的时机,按照指南应常规在妊娠中期(18~22周)进行,最新研究指出,筛查时间可提前至妊娠早期(11~13周),主要通过胎儿超声观察身体结构发育的变异,如胎儿颅内透明层缺失(即第四脑室前后径)、额上颌角减小、小脑延髓池部分或完全闭塞、颅内脑脊液量明显较少等[12]。目前妊娠早期的胎儿颅内超声检测更多用于学术研究,并未在临床上作为NTDs筛查及诊断的常规手段[12]。
|
Download:
|
| 图 1 “香蕉征” Fig. 1 Banana sign | |

|
Download:
|
| 图 2 “柠檬征” Fig. 2 Lemon sign | |
2.胎儿磁共振:胎儿磁共振不作为NTDs的筛查手段,而主要作为辅助诊断手段,在超声检测到胎儿异常后需要进一步详细显示变异结构时,利用胎儿磁共振为孕期胎儿管理及咨询提供更丰富精确的指导信息[13]。为了获得胎儿头颅、脊柱、脊髓脊膜膨出囊及蛛网膜下腔的最佳成像,建议胎儿磁共振在孕23~32周进行[13]。胎儿磁共振的优点包括无致畸性的辐射、对软组织显示清楚、可发现胎儿超声以外的畸形、不受羊水过少及孕母肥胖或胎儿体位等因素影响。妊娠晚期进行的磁共振检查不利于畸形胎儿妊娠管理的早期决策,比如终止妊娠[13]。充分而全面的中枢神经系统评估是宫内NTDs胎儿手术成功的必要条件。
3.孕母血清AFP(maternal serum alpha-fetoprotein,MSAFP):自上世纪70年代中期以来,作为非侵入性筛查方法,MSAFP一直用于开放性神经管畸形的筛查,在超声技术进展之前,MSAFP水平一直作为筛查开放性神经管畸形的金标准[14]。AFP最初由卵黄囊产生随后由胎儿肝脏产生,神经管闭合不全时,胎儿分泌的AFP进入羊水及孕母血清,可作为筛查NTDs的标志性生化指标[14]。MSAFP水平在孕早期即明显上升,在妊娠早期筛查NTDs的检出率约为50%,但假阳性率高达10%,此阶段影响MSAFP水平的因素包括孕母的种族、BMI、是否吸烟及口服避孕药等[14]。因此,在妊娠早期不推荐MSAFP作为NTDs的筛查指标;妊娠中期,MSAFP筛查NTDs检出率为71% ~90%,假阳性率为1% ~3%,故推荐MSAF筛查时间在妊娠中期16~18周(可放宽至15~22周)[14]。为了准确解读MSAFP结果,必须考虑胎龄、胎数、孕母种族和BMI、NTDs家族史、致畸药物如卡马西平和叶酸拮抗剂、慢性病如糖尿病等因素,同时需考虑如腹壁缺损、死胎、胎儿肾病、胎儿皮肤性疾病如营养不良性大疱性表皮松解症等胎儿疾病所致的MSAFP水平升高[14]。
与其他各种筛查方法比较,MSAFP花费最少,但其敏感性及特异性均较低,并且不能用于筛查闭合性神经管畸形。最近有回顾性研究提示,检测MSAFP水平用于筛查NTDs的方法不太实用,特别是在妊娠早期,故建议除了孕母孕前BMI≥35 kg/m2、偏远地区或医师经验不足等不能获得及时高质量的超声筛查等情况下保留采用MSAFP检测筛查NTDs以外,应考虑停止MSAFP在临床上的使用[15]。但综合考虑,MSAFP可筛查出部分可疑胎儿,为后续进一步的诊断性措施如超声或羊膜穿刺术提供指导。
(二)侵入性方法
1.羊膜穿刺术:AFP最初由卵黄囊产生、随后由胎儿肝脏产生,可少量存在于孕母血清中,乙酰胆碱酯酶(acetylcholine esterase, AChE)仅由胎儿神经组织特异性产生,正常情况下羊水中不能检测到AFP和AChE,羊水中AFP和AChE水平的升高基本提示为开放性神经管畸形,并且通过羊膜穿刺术获得的羊水标本很容易检出NTDs[9]。羊膜穿刺术最常见的用途为胎儿染色体核型及基因分析,其次为筛查NTDs羊水中的AFP和AChE等指标,此手术推荐在孕15~20周进行[9]。遗传信息结合羊水中AFP和AChE不仅有利于全面评估NTDs的病因及复发风险,而且可进一步明确NTDs的具体类型。通过羊膜穿刺术所获得的染色体和基因变异等信息对预测畸形胎儿的远期预后具有重要指导价值。通过羊膜穿刺术检查羊水中AFP和AChE等指标不作为筛查NTDs的常规手段,因为此手术会增加孕母自发性流产的风险[9]。据文献报道羊膜穿刺术使自发性流产风险在原有的基础上增加了0.5% ~1.0%,且术后阴道异常出血、羊水感染、羊膜破裂及胎儿损伤等风险也会增加[7]。
二、妊娠期管理1.妊娠咨询:妊娠咨询应该全面考虑畸形胎儿的身体残疾和智力障碍对患儿自身及家庭可能造成的影响。据文献报道美国的NTDs活产儿术后1年和30年的存活率分别为90%和75%,而未经手术治疗NTDs患儿第1年的病死率高达80% ~90%[16];过去30年,70% ~80%的父母对NTDs的畸形胎儿选择终止妊娠。对于这些父母医生应该建议其对终止妊娠的胎儿进行活检和染色体及基因等遗传信息分析,因为这些结果可为NTDs病因和再孕复发风险等提供重要参考。
对于非综合征型、非遗传物质变异性的脊髓脊膜膨出胎儿,部分父母选择继续妊娠,因为他们更关注畸形胎儿生后的生活质量[17]。Król等[18]随访研究中,对5~20岁的33名脊髓脊膜膨出患儿的生活质量进行问卷调查,发现患儿生活质量非常好、好和一般的比率分别为30%、64%和6%,没有患儿自诉其生活质量很差;因为这其中大部分患儿都接受过良好的医疗服务;此外,Barf等[19]对119名脊髓脊膜膨出并发脑积水的患儿进行调查,发现与年龄匹配组的正常儿童相比,在经济和家庭生活方面获得较好的满意度,但在性生活及自理能力方面满意度稍差,令人意外的发现是,患儿自诉的生活质量与疾病严重程度及脊髓脊膜膨出的脊柱水平位置无相关性;再者,Bowman等[20]对118名脊髓脊膜膨出患儿随访25年,发现寿命达25岁左右的患儿占75%,85%的患儿接受过高中或大学教育,80%患儿的小便和90%患儿的大便排泄能达到可接受程度,86%患儿因合并脑积水而需要终身依赖脑室腹腔分流管,其常见死亡原因为未及时识别和处理的分流障碍。
对于不同类型的NTDs,在产前诊断率、早产率、生后智商与认知水平、行走能力、脑积水分流率、生活质量等方面均存在较大区别[16]。相较于闭合性NTDs,开放性NTDs占大多数,其中脊髓脊膜膨出最常见(64%),膨出位置多位于腰骶部(49.5%),大部分(83.6%)膨出物直径>2 cm[16, 21];开放性NTDs基本会并发不同程度的脑积水,其中约72.8%患儿需行脑室腹腔分流术或内镜下第三脑室造瘘术,而闭合性NTDs则极少并发脑积水[21];闭合性NTDs基本不能在产检时检出,而开放性NTDs产前检出率为95.5%,从而能早期发现并及时采取宫内或生后手术以最大程度减轻其神经发育的影响[22];闭合性和开放性NTDs在长期随访中的智力与认知发育水平亦存在差异,前者智力处于正常范围的患儿占90%,后者仅为79.6%[23];由于脊髓神经发育受影响,约1/3(32%)的开放性NTDs患儿正常活动受限,日常生活中需要轮椅辅助,但近年来由于宫内手术、产后即时手术的开展以及手术成功率的提高,这一比例正呈逐渐下降的趋势。同时,有文献报道开放性NTDs中大小便正常或仅受轻微影响的患儿比例仅为38%,且大小便受严重影响的患儿其生活质量非常不理想[24]。
2.分娩方式与时机:近20年,由于大家对NTDs的认识不足,越来越多的父母对NTDs畸胎选择终止妊娠,这一现象限制了学者们对脊髓脊膜膨出胎儿分娩方式及时机的研究[9]。有研究指出脊髓脊膜膨出胎儿在肺成熟之后再分娩是最基本的原则,产前对胎儿进行心率监测可能会改善预后,通过超声监测胎儿生长、头围大小及脑室大小有助于评估预后及制定分娩计划。臀先露在脊髓脊膜膨出胎儿中较为常见,因为受到神经功能受损后下肢活动减少以及胎儿合并脑积水后头围增大的影响,此时常规选择剖宫产分娩方式[9];而对于头先露的脊髓脊膜膨出胎儿,分娩方式的选择仍存争议,多项研究显示[25],自然分娩并未对新生儿预后产生不良影响。Luthy等[26]对200例单纯的脊髓脊膜膨出胎儿行剖宫产,与自然分娩相比,剖宫产患儿具有更好的远期运动功能发育,且有利于顺利生产及减少膨出物破裂的风险,故该研究认为相较于自然分娩,剖宫产是一种更安全、患儿预后更好的分娩方式。另外,合并脑积水、膨出物直径过大(>6 cm)、家属要求等情况下应该选择剖宫产。总之,分娩方式的选择应根据NTDs患儿具体情况制定出个性化方案,目前多倾向于剖宫产。
3.宫内手术与传统产后手术:神经管畸形发生在胚胎发育早期,闭合不全时神经组织长期暴露于羊水中可对后续神经系统发育造成更为严重的后果。早期宫内手术可减轻神经组织长期暴露于羊水中的不良影响。一项由美国费城儿童医院进行的关于脊髓脊膜膨出的比较宫内手术和产后手术的随机对照试验表明,脊髓脊膜膨出胎儿的宫内手术可明显降低产后患儿脑室腹腔分流率,宫内手术可以使传统产后手术分流率由82%降至40%,生后30个月的下肢活动能力明显改善[27]。由美国产前及母胎外科协会进行的另一项随机对照试验表明[28]:宫内开放性手术治疗脊髓脊膜膨出可以改变胎儿不良结局,但需承担手术导致早产、子宫破裂等风险;宫内手术可降低新生儿出生后1年内的病死率、小脑扁桃体下疝率及脑室腹腔引流率;宫内手术后,生后30个月的独立行走能力是传统产后手术组的2倍,精神运动功能也可获得显著提高;宫内手术组患儿生后在不同解剖平面的功能恢复优于生后标准手术组;但是,宫内手术治疗增加了引发早产、子宫破裂、绒毛膜-羊膜分离、胎膜破裂、羊水过少、胎盘早剥、肺水肿、母胎溶血及子宫壁变薄等并发症的风险。2017年,美国妇产科医师学会(American College of Obstetricians and Gynecologists,ACOG)联合母胎医学会(Society for Maternal Fetal Medicine,SMFM)共同发布了宫内胎儿手术治疗脊髓脊膜膨出指南:推荐宫内胎儿手术治疗脊髓脊膜膨出,认为产前手术治疗脊髓脊膜膨出可广泛应用于临床[28]。目前,尚不推荐采用宫内内窥镜治疗胎儿脊髓脊膜膨出,因为虽然其创伤小,但该手术可导致胎儿早产、子宫破裂等并发症风险增加,且目前发表的文献数据少,样本量小,缺乏远期神经系统预后的证据。
三、隐性椎管闭合不全隐性椎管闭合不全(occult spinal dysraphism,OSD)的主要致病机理是脊髓拴系(tethered spinal cord,TSC),此类NTDs产检时一般不易发现,常因生后腰骶部明显的皮肤标志性病变而发现,故单独讨论此类NTDs的围生期处理。
1. OSD的Cochrane分类[29]:①伴有肠道和膀胱功能障碍、进行性神经功能障碍和骨科畸形(足畸形);②伴有泌尿生殖系统和肛门直肠畸形,但无进行性神经功能损害。10% ~53%的肛门直肠畸形儿童存在椎管闭合不全,肛门闭锁部位越靠近头侧(肛提肌以上),合并脊髓畸形的可能性越大;皮肤标志性病变极少出现;③无神经功能损害但伴有皮肤标志病变的婴儿;80%的OSD婴儿伴有腰骶部明显的皮肤标志性病变,正常新生儿中仅3%可见类似皮肤病变如血管瘤,尚不十分清楚腰骶部血管瘤与OSD的相关性; ④MRI未见异常但出现尿失禁等症状的患儿;脊髓MRI未见异常但合并难治性神经源性膀胱功能障碍的患儿应怀疑隐性脊髓拴系综合征(occult tethered cord syndrome,OTCS)。
2.临床评估[29]:①影像学评估。超声特点为经济、实用、无辐射,为新生儿及部分婴儿的最佳筛查手段,出生后3个月内脊柱骨化缓慢,为最佳显示时间窗;MRI需要镇静,因此最好推迟到出生3个月后进行。生后3个月内的圆锥末端低于L2不应视为异常, 因为圆锥末端会随时间继续上升,若出生3个月后仍低于L2水平应怀疑脊髓拴系(tethered spinal cord,TSC)。②泌尿系统评估。OSD的泌尿系统评估是治疗决策中的一个重要环节,金标准是尿动力学检查中的膀胱内压测压(cystometrygram,CMG)和肌电图检查(electromyogram,EMG)。
3.外科干预指征[27, 30]:自MRI出现以来,脊髓圆锥低位的手术病人呈稳定上升趋势。Ⅰ类疾病自然病程可预测且手术干预可以改善病情;Ⅱ类自然病程不可预测,但已知畸形易引起神经功能损伤,因此保守观察需慎重;Ⅲ类存在新发或进行性功能损害(神经系统、泌尿系统、运动系统),应积极行手术治疗。
综上所述,神经管畸形的发病率较高,为仅次于先天性心脏病的第二位新生儿出生缺陷性疾病,神经管畸形的围生期处理理念及处理手段方面均取得了飞跃式发展,极大地提高了NTDs患儿的生存率及生活质量,但目前先进的脊髓脊膜膨出宫内手术仅少数国家能够实施,学习并推广这种手术能够更大程度地使病患受惠。
| 1 |
Martinez H, Weakland AP, Bailey LB, et al. Improving maternal folate status to prevent infant neural tube defects:working group conclusions and a framework for action[J]. Ann N Y Acad Sci, 2018, 1414(1): 5-19. DOI:10.1111/nyas.13593. |
| 2 |
Blount JP, George TM, Koueik J, et al. Concepts in the neurosurgical care of patients with spinal neural tube defects:An embryologic approach[J]. Birth Defects Res, 2019, 111(19): 1564-1576. DOI:10.1002/bdr2.1588. |
| 3 |
Blencowe H, Kancherla V, Moorthie S, et al. Estimates of global and regional prevalence of neural tube defects for 2015:a systematic analysis[J]. Ann N Y Acad Sci, 2018, 1414(1): 31-46. DOI:10.1111/nyas.13548. |
| 4 |
顾硕. 先天性脊柱裂常见类型及治疗策略思考[J]. 临床小儿外科杂志, 2019, 18(2): 88-90. DOI:10.3969/j.issn.1671-6353.2019.02.003. Gu S. Common types and treatment strategies for congenital spinal bifida[J]. J Clin Ped Sur, 2019, 18(2): 88-90. DOI:10.3969/j.issn.1671-6353.2019.02.003. |
| 5 |
Chen G, Pei LJ, Huang J, et al. Unusual patterns of neural tube defects in a high risk region of northern China[J]. Biomed Environ Sci, 2009, 22(4): 340-344. DOI:10.1016/S0895-3988(09)60065-9. |
| 6 |
Avagliano L, Massa V, George TM, et al. Overview on neural tube defects:From development to physical characteristics[J]. Birth Defects Res, 2019, 111(19): 1455-1467. DOI:10.1002/bdr2.1380. |
| 7 |
Yorifuji T. Long-term Trends in Prevalence of Neural Tube Defects in Japan[J]. J Epidemiol, 2019, 29(4): 123-124. DOI:10.2188/jea.JE20180126. |
| 8 |
van GJ, Hirche H, Lax H, et al. Folic acid and primary prevention of neural tube defects:A review[J]. Reprod Toxicol, 2018, 80: 73-84. DOI:10.1016/j.reprotox.2018.05.004. |
| 9 |
Wilson RD, SOGC Genetics Committee, Special Contributor, et al. Prenatal screening, diagnosis, and pregnancy management of fetal neural tube defects[J]. J Obstet Gynaecol Can, 2014, 36(10): 927-939. DOI:10.1016/S1701-2163(15)30444-8. |
| 10 |
Tonni G, Grisolia G, Santana EF, et al. Assessment of fetus during second trimester ultrasonography using HDlive software:What is its real application in the obstetrics clinical practice?[J]. World J Radiol, 2016, 8(12): 922-927. DOI:10.4329/wjr.v8.i12.922. |
| 11 |
Bahlmann F, Reinhard I, Schramm T, et al. Cranial and cerebral signs in the diagnosis of spina bifida between 18 and 22 weeks of gestation:a German multicentre study[J]. Prenat Diagn, 2015, 35(3): 228-235. DOI:10.1002/pd.4524. |
| 12 |
Suresh S, Sudarshan S, Rangaraj A, et al. Spina bifida scr-eening in the first trimester using ultrasound biparietal diameter measurement adjusted for crown-rump length or abdominal circumference[J]. Prenat Diagn, 2019, 39(4): 314-318. DOI:10.1002/pd.5433. |
| 13 |
Zugazaga CA, Martín MC, Duran FC, et al. Magnetic resonance imaging in the prenatal diagnosis of neural tube defects[J]. Insights Imaging, 2013, 4(2): 225-237. DOI:10.1007/s13244-013-0223-2. |
| 14 |
Krantz DA, Hallahan TW, Carmichael JB, et al. Screening for open neural tube defects[J]. Clin Lab Med, 2016, 36(2): 401-406. DOI:10.1016/j.cll.2016.01.004. |
| 15 |
Roman AS, Gupta S, Fox NS, et al. Is MSAFP still a useful test for detecting open neural tube defects and ventral wall defects in the era of first-trimester and early second-trimester fetal anatomical ultrasounds?[J]. Fetal Diagn Ther, 2015, 37(3): 206-210. DOI:10.1159/000363654. |
| 16 |
Masini L, De Luca C, Noia G, et al. Prenatal diagnosis, natural history, postnatal treatment and outcome of 222 cases of spina bifida:experience of a tertiary center[J]. Ultrasound Obstet Gynecol, 2019, 53(3): 302-308. DOI:10.1002/uog.20136. |
| 17 |
Melekoglu R, Eraslan S, Celik E, et al. Perinatal and neonatal outcomes of patients who were diagnosed with neural tube defect in midtrimester fetal ultrasound scan and refused request for termination of pregnancy[J]. Biomed Res Int, 2016, 2016: 6382825. DOI:10.1155/2016/6382825. |
| 18 |
Król M, Sibiński M, Stefański M, et al. Assessment of life quality in children with spina bifida[J]. Chir Narzadow Ruchu Ortop Pol, 2011, 76(1): 52-55. |
| 19 |
Barf HA, Post MW, Verhoef M, et al. Life satisfaction of young adults with spina bifida[J]. Dev Med Child Neurol, 2007, 49(6): 458-463. DOI:10.1111/j.1469-8749.2007.00458.x. |
| 20 |
Bowman RM, McLone DG, Grant JA, et al. Spina bifida outcome:a 25-year prospective[J]. Pediatr Neurosurg, 2001, 34(3): 114-120. DOI:10.1159/000056005. |
| 21 |
Rehman L, Shiekh M, Afzal A, et al. Risk factors, presentation and outcome of meningomyelocele repair[J]. Pak J Med Sci, 2020, 36(3): 422-425. DOI:10.12669/pjms.36.3.1237. |
| 22 |
Tolcher MC, Shazly SA, Shamshirsaz AA, et al. Neurological outcomes by mode of delivery for fetuses with open neural tube defects:a systematic review and meta-analysis[J]. BJOG, 2019, 126(3): 322-327. DOI:10.1111/1471-0528.15342. |
| 23 |
Yorifuji T. Long-term trends in prevalence of neural tube defects in Japan[J]. J Epidemiol, 2019, 29(4): 123-124. DOI:10.2188/jea.JE20180126. |
| 24 |
Sivarajah K, Relph S, Sabaratnam R, et al. Spina bifida in pregnancy:A review of the evidence for preconception, antenatal, intrapartum and postpartum care[J]. Obstet Med, 2019, 12(1): 14-21. DOI:10.1177/1753495X18769221. |
| 25 |
Merrill DC, Goodwin P, Burson JM, et al. The optimal route of delivery for fetal meningomyelocele[J]. Am J Obstet Gynecol, 1998, 179(1): 235-40. DOI:10.1016/s0002-9378(98)70278-9. |
| 26 |
Luthy DA, Wardinsky T, Shurtleff DB, et al. Cesarean section before the onset of labor and subsequent motor function in infants with meningomyelocele diagnosed antenatally[J]. N Engl J Med, 1991, 324(10): 662-666. DOI:10.1056/NEJM199103073241004. |
| 27 |
Adzick NS, Thom EA, Spong CY, et al. A randomized trial of prenatal versus postnatal repair of myelomeningocele[J]. N Engl J Med, 2011, 364(11): 993-1004. DOI:10.1056/NEJMoa1014379. |
| 28 |
Committee on Obstetric Practice, Society for Maternal-Fetal Medicine. Committee Opinion No.720:Maternal-Fetal Surgery for Myelomeningocele[J]. Obstet Gynecol, 2017, 130(3): e164-e167. DOI:10.1097/AOG.0000000000002303. |
| 29 |
Tuite GF, Thompson DNP, Austin PF, et al. Evaluation and management of tethered cord syndrome in occult spinal dysraphism:Recommendations from the international children's continence society[J]. Neurourol Urodyn, 2018, 37(3): 890-903. DOI:10.1002/nau.23382. |
| 30 |
Blencowe H, Kancherla V, Moorthie S, et al. Estimates of global and regional prevalence of neural tube defects for 2015:a systematic analysis[J]. Ann N Y Acad Sci, 2018, 1414(1): 31-46. DOI:10.1111/nyas.13548. |
 2020, Vol. 19
2020, Vol. 19


