胆道闭锁(biliary atresia, BA)是发生于婴儿期的胆汁淤积性肝病之一,Kasai手术是其首选手术方式,可重建胆汁引流,减轻胆汁淤积对肝脏的进一步损害,达到自体肝生存的目的[1]。但目前BA具体病因尚不明确,即使Kasai手术成功重建了胆汁引流通路,术后仍有部分病人肝纤维化持续进展,不能达到自体肝长期生存[2]。肝脏硬度测量值(liver stiffness measurement, LSM)是反应肝纤维化程度的量化指标,术后监测可以及时了解肝纤维化程度及变化趋势[3]。本研究旨在探索LSM用于早期预测BA患儿术后5年自体肝生存的价值,以帮助临床医生尽早判断患儿是否达到自体肝长期生存,为肝移植及诊疗提供依据。
材料与方法 一、临床资料收集2012年4月至2013年2月于首都医科大学附属北京儿童医院普通外科行Kasai手术治疗的BA患儿临床资料,并进行回顾性分析,共31例,其中男童11例,女童20例。收集BA患儿Kasai手术前、术后2周、术后4周和术后8周的LSM及血生化检查结果,并对术时肝脏病理进行肝纤维化分级。随访终点为发生死亡、肝移植或术后自体肝生存满5年,并以5年是否自体肝生存为依据分为5年自体肝生存组和5年非自体肝生存组。
二、肝脏硬度测量方法本研究使用Fibroscan(Echosans, France)测量肝脏硬度值,由一名操作熟练的技术人员完成,统一取患儿右侧肋间,探头(S号)垂直于皮肤表面,在一维超声的辅助下,选取肝实质厚度符合探头要求并且无大血管的位置,取10个值,由图像数据处理系统取中位数为最终结果。
三、术中肝脏病理肝纤维化分级本研究所观察肝脏病理均取自肝右叶侧缘。由2名有经验的病理医师分别对Masson三色染色切片在光镜下进行观察,按照1994年法国Metavir研究组提出的肝脏纤维化评定标准进行判定[4]。若评估结论不一致,则由第3名病理医师给出会诊意见,获得一致结论。
四、统计学处理本研究采用SPSS19.0统计软件进行数据整理与分析,比较两组连续性计量资料的差异采用独立样本t检验或者秩和检验。对于分类资料采用卡方检验,以P<0.05为差异有统计学意义。采用ROC曲线分析LSM对5年自体肝生存的预测能力。ROC曲线下面积(Area Under Curve, AUC)在0.7~0.9时具有一定准确性,在0.9以上具有较高准确性,以约登指数最大者为最佳截点值,并获得相应的灵敏度和特异度。
结 果 一、基本情况5年自体肝生存组16例(男童8例,女童8例),5年非自体肝生存组15例(男童3例,女童12例),两组患儿性别差异无统计学意义(χ2=1.874,P=0.171)。两组患儿手术日龄分别为(78.2±23.4)d和(83.2±21.6)d,差异无统计学意义(t=-0.620,P=0.540)。以Metavir肝纤维化分级标准,31例术中肝脏病理分级包括Ⅱ级4例(2/2),Ⅲ级20例(12/8),Ⅳ级7例(2/5),5年自体肝生存组和5年非自体肝生存组的不同病理分级比例的差异无统计学意义(χ2=2.056,P=0.358),如表 1。
|
|
表 1 两组患儿的基本情况 Table 1 Basic profiles of two groups |
在5年非自体肝生存组中,术后8周内发生胆管炎3例(均发生在术后4周时),术后1年内发生死亡13例、肝移植1例,占比为93.3%(14/15)。在5年自体肝生存组中,术后8周内无胆管炎病例发生。
二、两组各项指标的变化趋势以术前、术后1周、术后2周、术后4周和术后8周为时间点,绘制LSM以及生化指标的变化趋势图(图 1)。术前和术后2周的各项指标在两组中的差异均无统计学意义(P>0.05);5年自体肝生存组术后4周的LSM为(11.3±4.3)kPa、总胆红素(total bilirubin, TBIL)为(63.7±34.9)μmol/L、总胆汁酸(total bile acid, TBA)为(78.6±46.4)μmol/L;5年非自体肝生存组术后4周的LSM为(19.6±9.7)kPa、TBIL为(122.4±52.7)μmol/L、TBA为(140.8±67.0)μmol/L,差异均有统计学意义(P<0.05)。5年自体肝生存组术后8周的LSM为(14.6±7.7)kPa、TBIL为(23.8±16.8)μmol/L、TBA为(67.9±65.1)μmol/L;5年非自体肝生存组术后8周的LSM为(38.2±22.3)kPa、TBIL为(99.5±65.1)μmol/L、TBA为(178.4±85.1)μmol/L,差异均有统计学意义(P<0.05),详见表 2。

|
Download:
|
| 图 1 两组BA患儿LSM、TBIL和TBA在不同时间点的变化趋势图 注 A:5年自体肝生存组术后8周内的LSM在一定范围内波动,5年非自肝生存组持续升高;B:TBIL术后2周内明显下降,5年非自体肝生存组术后2~8周波动上升,5年自体肝生存组术后持续下降至接近正常;C:5年非自体肝生存组TBA术后1周明显下降,术后2周趋于平稳,术后4周开始明显上升,而5年自体肝生存组术后1周明显下降后趋于稳定 Fig. 1 Trend charts of LSM, TBIL and TBA | |
|
|
表 2 两组不同时间点LSM、TBIL和TBA的比较 Table 2 Inter-group comparisons of LSM, TBIL and TBA at different timepoints |
采用ROC曲线分析得出,术前和术后2周LSM用于预测术后5年自体肝生存的AUC均小于0.7,分别为0.569和0.692(图 2A)。术后4周LSM用于预测术后5年自体肝生存的AUC为0.871,其最佳截点值为13.2kPa,灵敏度为81.8%,特异度为75.0%。术后8周LSM用于预测术后5年自体肝生存的AUC为0.898,其最佳截点值为21.6kPa,灵敏度为81.8%,特异度为91.7%(图 2B)。
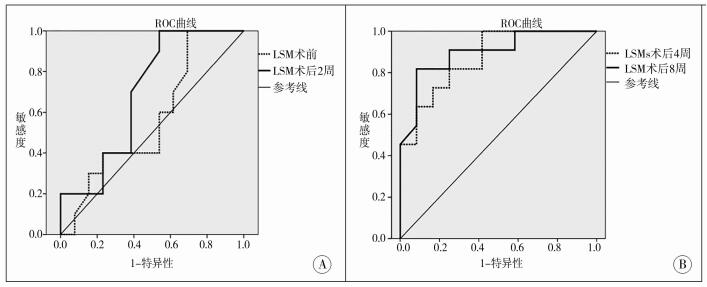
|
Download:
|
| 图 2 不同时间点LSM预测BA患儿5年自体肝生存的ROC曲线图 注 A:术前和术后2周LSM的ROC曲线图;B:术后4周和8周LSM的ROC曲线图 Fig. 2 ROC curves of LSM for predicating five-year native liver survival at different timepoints A:ROC curve of LSM before operation and 2 weeks after operation; B:ROC curve of LSM at 4 and 8 weeks after operation | |
胆道闭锁(biliary atresia, BA)是发生于婴儿时期的一种严重肝胆疾病,其发病率具有种族和地区差异,亚洲发病率高于欧美,北美发病率为0.45/10 000,中国台湾地区为1.78/10 000[5, 6]。目前主张序贯治疗,包括Kasai手术和肝移植。Kasai手术即切除肝外闭锁胆道及肝门部纤维块,以空肠和肝门部Roux-en-Y吻合的方式重建肝外胆道,借助肝门部残存的小胆管恢复部分胆汁引流[1]。肝纤维化是BA患儿的重要病理改变,其发生早,进展快,即便行Kasai手术后仍会持续进展[2]。通过Kasai手术,部分BA患儿可达到长期自体肝生存;不能长期自体肝生存的患儿则需肝移植。若能在术后早期预测是否可达到长期自体肝生存,可为临床诊疗,特别是肝移植的及时介入提供依据。
手术日龄对术后自体肝生存的影响目前仍存在争议。中国一项纳入244例BA患儿的单中心研究发现BA患儿5年自体肝生存率低与手术时日龄超过90 d有关[7];另有研究提示手术时年龄<65 d与术后长期自体肝生存有关[8]。但也有研究提出手术时年龄和术后自体肝生存情况并无相关性[9, 10];手术日龄超过100 d的患儿,5年和10年的自体肝生存率可达45%和40%[11]。本研究结果显示术后5年自体肝生存情况与手术时日龄并无明显相关性,但因本中心的BA患儿手术日龄<30 d或>120 d的患儿较少,故不能排除这种极大或极小的手术日龄对预后的影响。
肝纤维化持续进展、发生肝硬化并出现肝硬化相关合并症是影响Kasai手术后自体肝生存的关键。本研究显示,手术时肝纤维化程度与5年自体肝生存情况并无相关性,也说明BA的肝纤维化在Kasai手术后依然是持续变化的。评价肝纤维化程度的金标准是肝脏病理活检,但肝活检为有创性检查,目前在中国临床中并没有实现肝脏病理活检纳入BA术后随访的常规检查。LSM是一种利用弹性剪切波定量测定肝纤维化程度的检测手段,其原理是肝脏质地越硬,一维弹性剪切波在肝脏走行速度越快,所得出的LSM越高。LSM具有无创、准确、快速、可重复性高等特点,且肝硬度测量取样容积比肝穿刺活检标本量大。LSM在成人肝纤维化评估中已有较广泛的应用[12-15]。但是目前,国际上在儿童肝脏疾病中LSM的应用较成人相对少,有文献报道可应用于不同肝脏疾病的肝脏纤维化程度评估、辅助诊断门脉高压以及上消化道静脉曲张等,正常儿童的LSM约为5.0 kPa,与成人标准相符[3, 16-19]。LSM检查是本中心BA的常规检查,术前以及术后随访均需该项检查。本中心的前期研究结果显示LSM能有效用于BA患儿肝纤维化程度的评估,达到肝硬化程度对应的LSM为15.15 kPa,故考虑LSM是一项可以部分替代肝脏活检的无创检查方式[3]。
那么,胆道闭锁术前以及术后早期的LSM与5年自体肝生存是否存在相关性值得进一步探究。本研究发现5年自体肝生存组患儿的LSM在术后8周内相对平稳,在术后8周时有轻度上升趋势,而5年非自体肝生存组患儿的LSM在术后8周内持续升高,以术后4周至8周尤为明显, 且两组患儿在术前、术后2周时的LSM差异无统计学意义,而在术后4周开始出现统计学差异。从血生化指标可以看出,通过Kasai手术,胆汁得到有效引流,在术后2周内两组患儿的胆汁酸以及总胆红素均呈下降趋势,此时胆汁淤积对肝脏细胞的损害明显减轻,而胆汁淤积对肝脏损害是造成肝纤维化的主要原因,故此阶段两组的LSM并无明显上升且无统计学差异。术后4周开始两组的胆汁酸值出现差异,5年非自体肝生存组的胆汁酸明显呈上升趋势,而5年自体肝生存组处于相对平缓状态,胆汁淤积对肝脏的损害主要是胆汁酸毒性对肝细胞以及胆管细胞的损害,进而导致肝纤维化加重,这与LSM的变化趋势是一致的。
至于为何在术后4周时开始出现胆汁淤积反弹、肝脏纤维化加重,目前尚不明确,考虑可能与胆管炎发作有关。本研究中有3例在术后4周时发生胆管炎,均属于5年非自体肝生存组,发生早期胆管炎可导致肝纤维化加重,使得LSM升高。另一方面,过度免疫炎症反应是胆管损伤以及肝脏纤维化发生的重要因素[20]。虽然通过外科手段解决了肝外胆道阻塞问题,但若因各种原因其免疫炎症反应未能停止,最终可导致肝门部小胆管因炎症而再次阻塞,从而导致胆汁淤积再次发生。
进一步行ROC曲线分析发现,在术后4周时LSM超过13.2 kPa、术后8周时LSM超过21.6 kPa,均预示着Kasai术后5年自体肝生存的可能性降低。Wu等[21]对15例行Kasai手术的BA患儿随访18个月后,发现在术后1周时LSM超过16 kPa,预示着需要接受肝移植的风险增加。本研究结果提示死亡或肝移植事件大部分发生在术后1年内,故建议在术后早期LSM超过相应界值时,尽早进入肝移植评估,以达到BA最佳的总体生存率(自体肝+移植)。
综上,LSM在Kasai手术后早期即可预测5年自体肝生存的可能性,在临床工作中可起到一定的指导作用,为肝移植及诊疗提供依据,为家长对患儿的自体肝生存预期提供参考。
| 1 |
Worhunsky DJ, Park CJ, Cowles RA, et al. Hepatoportoenterostomy surgery technique[J]. J Pediatr Surg, 2019, 54(8): 1715-1718. DOI:10.1016/j.jpedsurg.2018.10.041. |
| 2 |
Hartley JL, Davenport M, Kelly DA. Biliary atresia[J]. Lancet, 2009, 374(9702): 1704-1713. DOI:10.1016/S0140-6736(09)60946-6. |
| 3 |
Shen QL, Chen YJ, Wang ZM, et al. Assessment of liver fibrosis by Fibroscan as compared to liver biopsy in biliary atresia[J]. World J Gastroenterol, 2015, 21(22): 6931-6936. DOI:10.3748/wjg.v21.i22.6931. |
| 4 |
Intraobserver and interobserver variations in liver biopsy interpretation in patients with chronic hepatitis C. The French METAVIR Cooperative Study Group[J]. Hepatology, 1994, 20(1 Pt 1): 15-20. |
| 5 |
Hopkins PC, Yazigi N, Nylund CM. Incidence of biliary atresia and timing of hepatoportoenterostomy in the United States[J]. J Pediatr, 2017, 187: 253-257. DOI:10.1016/j.jpeds.2017.05.006. |
| 6 |
Chiu CY, Chen PH, Chan CF, et al. Biliary atresia in preterm infants in Taiwan:a nationwide survey[J]. J Pediatr, 2013, 163(1): 100-103. DOI:10.1016/j.jpeds.2012.12.085. |
| 7 |
Qiao G, Li L, Cheng W, et al. Conditional probability of survival in patients with biliary atresia after Kasai portoenterostomy:a Chinese population-based study[J]. J Pediatr Surg, 2015, 50(8): 1310-1315. DOI:10.1016/j.jpedsurg.2015.03.062. |
| 8 |
Pakarinen MP, Johansen LS, Svensson JF, et al. Outcomes of biliary atresia in the Nordic countries-a multicenter study of 158 patients during 2005-2016[J]. J Pediatr Surg, 2018, 53(8): 1509-1515. DOI:10.1016/j.jpedsurg.2017.08.048. |
| 9 |
Bjornland K, Hinna M, Aksnes G, et al. Outcome for biliary atresia patients treated at a low-volume centre[J]. Scand J Gastroenterol, 2018, 53(4): 471-474. DOI:10.1080/00365521.2018.1439097. |
| 10 |
Muthukanagarajan SJ, Karnan I, Srinivasan P, et al. Diagnostic and prognostic significance of various histopathological features in extrahepatic biliary atresia[J]. J Clin Diagn Res, 2016, 10(6): EC23-EC27. DOI:10.7860/JCDR/2016/19252.8035. |
| 11 |
Davenport M, Puricelli V, Farrant P, et al. The outcome of the older(≥ 100 days)infant with biliary atresia[J]. J Pediatr Surg, 2004, 39(4): 575-581. DOI:10.1016/j.jpedsurg.2003.12.014. |
| 12 |
Kamarajah SK, Chan WK, Nik Mustapha NR, et al. Repeated liver stiffness measurement compared with paired liver biopsy in patients with non-alcoholic fatty liver disease[J]. Hepatol Int, 2018, 12(1): 44-55. DOI:10.1007/s12072-018-9843-4. |
| 13 |
Huang Z, Huang J, Zhou T, et al. Prognostic value of liver stiffness measurement for the liver-related surgical outcomes of patients under hepatic resection:A meta-analysis[J]. PLoS ONE, 2018, 13(1): e0190512. DOI:10.1371/journal.pone.0190512. |
| 14 |
Tag-Adeen M, Alsenbesy M, Ghweil AA, et al. Liver stiffness measurement and spleen diameter as predictors for the presence of esophageal varices in chronic hepatitis C patients[J]. Medicine(Baltimore), 2017, 96(46): e8621. DOI:10.1097/MD.0000000000008621. |
| 15 |
Garg H, Aggarwal S, Shalimar, et al. Utility of transient elastography(fibroscan)and impact of bariatric surgery on nonalcoholic fatty liver disease(NAFLD)in morbidly obese patients[J]. Surg Obes Relat Dis, 2018, 14(1): 81-91. DOI:10.1016/j.soard.2017.09.005. |
| 16 |
Behairy Bel-S, Sira MM, Zalata KR, et al. Transient elastography compared to liver biopsy and morphometry for predicting fibrosis in pediatric chronic liver disease:Does etiology matter?[J]. World J Gastroenterol, 2016, 22(16): 4238-4249. DOI:10.3748/wjg.v22.i16.4238. |
| 17 |
Elkrief L, Ronot M, Andrade F, et al. Non-invasive evaluation of portal hypertension using shear-wave elastography:analysis of two algorithms combining liver and spleen stiffness in 191 patients with cirrhosis[J]. Aliment Pharmacol Ther, 2018, 47(5): 621-630. DOI:10.1111/apt.14488. |
| 18 |
Sohn H, Park S, Kang Y, et al. Predicting variceal bleeding in patients with biliary atresia[J]. Scand J Gastroenterol, 2019, 54(11): 1385-1390. DOI:10.1080/00365521.2019.1683225. |
| 19 |
Zeng J, Zhang X, Sun C, et al. Feasibility study and reference values of FibroScan 502 with M probe in healthy preschool children aged 5 years[J]. BMC Pediatr, 2019, 19(1): 129. DOI:10.1186/s12887-019-1487-6. |
| 20 |
詹江华, 余展. 胆道闭锁发病机制研究概述与启示[J]. 临床小儿外科杂志, 2018, 17(11): 801-804. DOI:10.3969/j.issn.167l-6353.2018.11.001. Zhan JH, Yu Z. An overview and enlightenment of the pathogenesis of biliary atresia[J]. J Clin Ped Sur, 2018, 17(11): 801-804. DOI:10.3969/j.issn.167l-6353.2018.11.001. |
| 21 |
Wu JF, Lee CS, Lin WH, et al. Transient elastography is useful in diagnosing biliary atresia and predicting prognosis after hepatoportoenterostomy[J]. Hepatology, 2018, 68(2): 616-624. DOI:10.1002/hep.29856. |
 2020, Vol. 19
2020, Vol. 19


