2. 湖南省儿童医院新生儿科(湖南省长沙市, 410007);
3. 湖南省儿童医院编辑部(湖南省长沙市, 410007)
2. Department of Neonatal Surgery, Hunan Children's Hospital, Changsha 410007, China;
3. The Editorial Office of Journal of Clinical Pediatric Surgery, Hunan Children's Hospital, Changsha 410007, China
慢性肝病的主要原因包括感染、先天性代谢缺陷、化学毒物损害及自身免疫性肝病等。由慢性肝病发展而来的晚期肝纤维化和肝硬化与肝功能衰竭及肝细胞癌等疾病所致的死亡有关。对肝纤维化的早期判断及评估有助于临床上阻断肝纤维化进展为肝硬化等终末疾病状态。目前,肝纤维化评估的金标准是肝活检(liver biopsy, LB),但肝活检是一种侵入性操作,可引起疼痛、出血、感染、麻醉意外等一系列并发症。此外,因为肝活检仅取肝脏中部分样本进行检测, 可能存在采样误差[1]。目前临床上已有许多像Fibroscan、FibroTouch、实时弹性成像、二维横波弹性成像、磁共振弹性成像等无创性评估工具来评价肝纤维化程度,一方面这些操作比肝活检实施起来更容易,另一方面,可以从很大程度上减少肝活检给患儿带来的痛苦。TE技术是新兴的无创性肝纤维化评估工具之一,已越来越多地被用于评估肝纤维化严重程度。本研究通过超声肝硬化检测仪检测所有研究对象的LSM值,旨在为慢性乙型病毒性肝炎(chronic hepatitis B,CHB)及胆道闭锁患儿的肝纤维化分期提供依据。
材料与方法 一、研究对象及分组选择2015年1月1日至2018年12月31日就诊于湖南省儿童医院,符合《2015年中国慢性乙型肝炎防治指南》[2]中诊断标准的CHB患儿和2016年1月1日至2018年12月31日经手术探查确诊为胆道闭锁并行Kasai术的患儿作为研究对象, 收集患儿术中肝脏病理活检标本, 并收集胆道闭锁患儿手术前2周内及CHB患儿肝活检术前或术后2周内TE检测的LSM值。排除合并其他嗜肝病毒感染者、合并其他慢性病毒感染、血液系统疾病、免疫系统缺陷疾病、其他遗传代谢性肝病及酒精性肝病、非酒精性脂肪肝、肝脏占位性病变等患儿。根据肝脏病理检查结果将肝纤维化程度分为F0~F4期,再根据病理检查所得肝纤维化程度将患儿分为肝纤维化组(F≥1)和无肝纤维化组(F=0);明显肝纤维化组(F≥2)和无明显肝纤维化组(F<2);进展性肝纤维化组(F≥3)和非进展性肝纤维化组(F<3);肝硬化组(F=4)和非肝硬化组(F<4)。
二、研究方法1. CHB患儿肝脏活组织病理学检查:患儿取仰卧位或稍左侧卧位,在B超定位下确定穿刺点,选择巴德穿刺针,经皮行肝穿刺活组织检查,获取肝组织后予以10%甲醛固定、HE染色、常规制片。
2.胆道闭锁患儿肝脏活组织病理学检查:将手术中获得的肝脏活检病理标本由病理科于30 min内放置于-80℃冰箱中保存,按固定、浸蜡与包埋、切片的顺序进行石蜡切片制作及HE、VG及Masson染色。
3. LSM检测:采用深圳市一体医疗科技股份有限公司生产的超声肝硬化检测仪,选取肋间隙检测患儿的肝实质硬度,测量10次有效值后得出LSM值,正确率60%以上、偏差值小于中位数的1/3的LSM值纳入本研究。
三、质量控制所有操作均由受过专业培训的医师完成。在进行超声肝硬化检测时,要求患儿空腹4 h以上,平卧位,对于哭吵不配合患儿予以镇静,在患儿安静状态下进行操作。对于肥胖及极度消瘦难以操作患儿需多次操作以确保检测的准确性。由同一高级职称病理科医师统一阅片,按病毒性肝炎防治方案将肝纤维化程度分为F0~F4期[2]。
四、统计学方法所有数据经Excel表格录入,采用SPSS20.0、MedCalc软件进行统计学分析,以P<0.05为差异有统计学意义。因LSM值为连续性非正态分布计量资料,以中位数和四分位间距[M (P25~P75)]表示。两组间比较采用两个独立样本的Wilcoxon秩和检验。行LSM值与肝纤维化金标准的受试者工作特征(receiver operating characteristic, ROC)曲线分析,计算ROC曲线下面积(area under the curve, AUC)[3]。选择约登指数最大时对应的点作为截点(cut-off),然后根据专业知识选择最佳截点值,并得出灵敏度(sensitivity, Se)、特异度(specificity, Sp),使用MedCalc软件算出阳性预测值(positive predictive value, PPV)、阴性预测值(negative predictive value, NPV)、阳性似然比(positive likelihood ratio, +LR)、阴性似然比(negative likelihood ratio, -LR)。
结 果 一、临床资料及特征纳入CHB患儿43例,其中男童29例(67.4%),女童14例(32.6%);患儿年龄分布的中位数和四分位间距为4.50(3.17~7.33)岁。纳入胆道闭锁患儿110例,其中男童39例(35.5%),女童71例(64.5%);患儿月龄分布的中位数和四分位间距是2.03(1.77~2.31)个月。
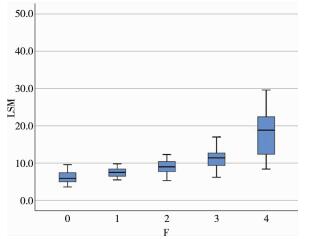
153例患儿中,F0期9例(5.88%);F1期29例(18.96%);F2期40例(26.14%);F3期51例(33.33%);F4期24例(15.69%)。F0~F4期LSM值的中位数和四分位数间距分别为5.9(4.9~8.4)kPa、7.5(6.5~8.5)kPa、9.0(7.7~10.5)kPa、11.4 (9.4~12.7)kPa、18.9(12.5~22.4)kPa,见图 1。
|
Download:
|
| 图 1 各期肝纤维化对应LSM值的中位数和四分位数间距 Fig. 1 Median and interquartile spacing of LSM for liver fibrosis during each phase | |
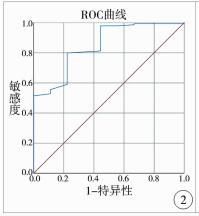
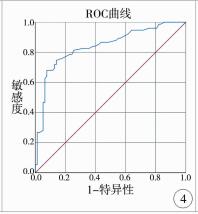
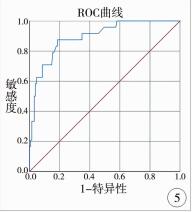
肝纤维化组和无肝纤维化组、明显肝纤维化组和无明显肝纤维化组、进展性肝纤维化组和非进展性肝纤维化组、肝硬化组和非肝硬化组各两组间LSM值进行比较,差异均有统计学意义(P < 0.05)。本研究发现LSM值诊断肝纤维化的最佳截点值为7.4 kPa,灵敏度和特异度分别为79.86%、77.78%,AUC为0.850(95%CI:0.728~0.971);LSM值诊断明显肝纤维化的最佳截点值为9.2 kPa,灵敏度和特异度分别为70.43%、84.21%,AUC为0.864(95%CI:0.807~0.921);LSM值诊断进展性肝纤维化的最佳截点值为11.2 kPa,灵敏度和特异度分别为62.67%、93.59%,AUC为0.840(95%CI:0.776~0.905);LSM值诊断肝硬化的最佳截点值为13.3 kPa,灵敏度和特异度分别为70.83%、91.47%,AUC为0.894(95%CI:0.828~0.961)(见表 1,图 2~图 5)。
|
|
表 1 LSM值诊断各期肝纤维化的ROC曲线下面积及其相关参数 Table 1 Area under the ROC curve and related parameters of LSM for liver fibrosis during each stage |
|
Download:
|
| 图 2 LSM诊断肝纤维化的ROC曲线 Fig. 2 ROC curve of LSM in the diagnosis of hepatic fibrosis | |

|
Download:
|
| 图 3 LSM诊断明显肝纤维化的ROC曲线 Fig. 3 ROC curve of LSM in the diagnosis of obvious hepatic fibrosis | |
|
Download:
|
| 图 4 LSM诊断进展性肝纤维化的ROC曲线 Fig. 4 ROC curve of LSM in the diagnosis of progressive hepatic fibrosis | |
|
Download:
|
| 图 5 LSM诊断肝硬化的ROC曲线 Fig. 5 ROC curve of LSM in the diagnosis of cirrhosis | |
LB是目前诊断肝纤维化的金标准,然而LB可引起患儿明显不适和各种并发症,且LB取样少,无法反映整个肝脏的情况。目前迫切需要诊断肝纤维化和肝硬化的无创性方法来减少临床上特别是儿科领域LB的实施。已有大量研究表明血清学检查如以谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、血小板(platelet, PLT)为基础的无创性诊断指标FIB-4指数[4]、APRI(AST相当于正常值上限的倍数×100/PLT(109/L))[5]、γ-谷氨酰转肽酶与血小板计数的比值(gamma-glutamyltraspeptidase (GGT)-to-PLT ratio, GPR)[6]等和新的成像技术如Fibroscan、FibroTouch[7]、实时弹性成像[8]、二维横波弹性成像[9]、磁共振弹性成像[10]等均能较好地诊断肝纤维化。但由于它们的诊断效能受到争议及其对仪器和操作者专业的要求,目前均未广泛应用于临床。
TE是一种超声领域内的新技术,通过瞬时弹性记录仪测量肝硬度测定值对肝纤维化进行无创、客观及定量评估。超声肝硬化检测仪就是以TE技术为原理,通过无创性检测方法来评估患儿的肝纤维化程度。本研究将胆道闭锁及CHB患儿按不同程度肝纤维化进行分组,探讨LSM值对儿童不同原因肝纤维化程度的诊断价值,以期LSM值能用于儿童不同病因肝纤维化程度的早期评价,以减少有创性检查LB在儿科临床的使用。本研究通过分析肝纤维化、明显肝纤维化、进展性肝纤维化、肝硬化LSM值的中位数和四分位间距,发现随着肝纤维化程度的加重,LSM值也相应增大,这说明LSM值可以用于评估肝纤维化程度。
本研究发现LSM值诊断发生肝纤维化、明显肝纤维化、进展性肝纤维化、肝硬化的AUC分别为0.850、0.864、0.840、0.894,提示TE技术对儿童各期肝纤维化的诊断准确性均较高,这与许多对成人肝纤维化的研究结果一致,这也提示TE技术可用于儿童肝纤维化分期的辅助诊断[11-13]。在儿科领域,沈秋龙等[14]研究得出LSM用于判断胆道闭锁肝硬化(F4)的AUC为0.88,但是目前对于LSM值诊断胆道闭锁不同程度肝纤维化以及儿童CHB肝纤维化的研究仍较少。同时,Zeng等[15]研究发现APRI、FIB-4诊断明显肝纤维化的AUC分别为0.619、0.621,闫珊玲等[16]研究得出APRI值与FIB4诊断明显肝纤维化的AUC分别为0.726和0.775,诊断进展性肝纤维化的AUC分别为0.757和0.782,诊断肝硬化的AUC分别为0.715和0.7,提示瞬时弹性成像技术诊断肝纤维化程度的准确性可能优于APRI、FIB-4,更适用于临床。本研究发现LSM值诊断肝纤维化、明显肝纤维化、进展性肝纤维化、肝硬化的最佳截点值分别为7.4 kPa、9.2 kPa、11.2 kPa、13.3 kPa,灵敏度均在60%以上,特异度均在75%以上,提示当LSM值>7.4 kPa时,可考虑存在肝纤维化的可能,当LSM值>9.2 kPa时,可考虑达到明显肝纤维化的可能,以此类推,提示随着肝纤维化程度逐渐加重,TE技术测得的LSM值也逐渐增大,再次说明LSM值可很好地反应肝纤维化程度。
同时本研究也存在一定的局限性。与2015年版中国慢性乙型肝炎防治指南相比,由于样本量较少,本研究得出LSM值诊断发生肝纤维化、明显肝纤维化、进展性肝纤维化、肝硬化相对应的最佳截点值并未将患儿肝功能状态等可能影响因素考虑在内。已有研究表明TE检测结果可能与AST、ALT、白蛋白、总胆红素等水平有关[17]。其次,肋间隙过窄、肥胖、检测深度、部位以及检测角度,甚至呼吸时相、进食状态等因素都会影响TE检测成功率及结果的准确性[18]。因此,下一步将扩大样本量进行进一步分层分析,排除患儿肝功能、体型及检查时状态等对TE结果的影响。最后,本研究发现各肝纤维化期的LSM值对应的中位数和四分位数间距存在交叉,故单纯依靠LSM值来评估肝纤维化程度会造成一定的漏诊或误诊,如何将其他临床指标与LSM值联合起来评估肝纤维化程度是接下来需要进一步研究的问题。
综上,TE已被2015年版中国慢性乙型肝炎防治指南首次列入无创性诊断推荐,但该指南并未进行年龄的限定。目前关于儿童肝纤维化诊断的研究并不多,本研究结果可得出TE对儿童不同程度肝纤维化均有较好的诊断价值。
| 1 |
Bedossa P, Dargere D, Paradis V. Sampling variability of liver fibrosis in chronic hepatitis C[J]. Hepatology, 2003, 38(6): 1449-1457. DOI:10.1016/j.hep.2003.09.022. |
| 2 |
中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31(12): 1941-1960. DOI:10.3969/j.issn.1001-5256.2015.12.002. Chinese Society of Hepatology & Chinese Society of Infectious Diseases, Chinese Medical Association. Guideline of Prevention and Treatment for Chronic Hepatitis B:a 2015 update[J]. J Clin Hepatol, 2015, 31(12): 1941-1960. DOI:10.3969/j.issn.1001-5256.2015.12.002. |
| 3 |
Qiu J, Yan HP, Cheng NC, et al. The clinical and epidemiological study of children with hand, foot, and mouth disease in Hunan, China from 2013 to 2017[J]. Sci Rep, 2019, 9(1): 11662. DOI:10.1038/s41598-019-48259-1. |
| 4 |
Lee J, Kim MY, Kang SH, et al. The gamma-glutamyl transferase to platelet ratio and the FIB-4 score are noninvasive markers to determine the severity of liver fibrosis in chronic hepatitis B infection[J]. Br J Biomed Sci, 2018, 75(3): 128-132. DOI:10.1080/09674845.2018.1459147. |
| 5 |
Sanai FM, Farah T, Albeladi K, et al. Diminished accuracy of biomarkers of fibrosis in low replicative chronic hepatitis B[J]. BMC Gastroenterol, 2017, 17(1): 101. DOI:10.1186/s12876-017-0658-x. |
| 6 |
Schiavon LL, Narciso-Schiavon JL, Ferraz M, et al. The γ-glutamyl transpeptidase to platelet ratio (GPR) in HBV patients:just adding up[J]. Gut, 2017, 66(6): 1169-1170. DOI:10.1136/gutjnl-2016-312658. |
| 7 |
欧晓娟, 王晓明, 吴晓宁, 等. FibroTouch与FibroScan在慢性乙型肝炎患者肝纤维化评估中的比较[J]. 中华肝脏病杂志, 2015, 23(2): 103-106. DOI:10.3760/cma.j.issn.1007-3418.2015.02.006. X J, Wang XM, Wu XN, et al. Comparison of FibroTouch and FibroScan for the assessment of fibrosis in chronic hepatitis B patients[J]. Chin J Hepatol, 2015, 23(2): 103-106. DOI:10.3760/cma.j.issn.1007-3418.2015.02.006. |
| 8 |
Ippolito D, Schiavone V, Talei Franzesi CR, et al. Real-time elastography:noninvasive diagnostic tool in the evaluation of liver stiffness in patients with chronic viral hepatitis, correlation with histological examination[J]. Dig Dis, 2018, 36(4): 289-297. DOI:10.1159/000480699. |
| 9 |
Petzold G, Hofer J, Ellenrieder V, et al. Liver stiffness measured by 2-dimensional shear wave elastography:prospective evaluation of healthy volunteers and patients with liver cirrhosis[J]. J Ultrasound Med, 2019, 38(7): 1769-1777. DOI:10.1002/jum.14866. |
| 10 |
Liu J, Li Y, Yang X, et al. Comparison of two-dimensional shear wave elastography with nine Serum fibrosis indices to assess liver fibrosis in patients with chronic hepatitis B:A prospective cohort study[J]. Ultraschall Med, 2019, 40(2): 237-246. DOI:10.1055/a-0796-6584. |
| 11 |
Orasan OH, Iancu M, Sava M, et al. Non-invasive assessment of liver fibrosis in chronic viral hepatitis[J]. Eur J Clin Invest, 2015, 45(12): 1243-1251. DOI:10.1111/eci.12543. |
| 12 |
郭峰, 庄小芳, 王晓波, 等. 三种肝纤维化无创诊断对慢性乙型肝炎进展性肝纤维化(≥ F3)诊断价值评估[J]. 肝脏, 2018, 23(3): 235-238. DOI:10.3969/j.issn.1008-1704.2018.03.016.. Guo F, Zhuang XF, Wang XB, et al. Evaluation of three non-invasive tools of liver fibrosis for the diagnosis of chronic hepatitis B progressive liver fibrosis (≥ F3)[J]. Chinese Hepatology, 2018, 23(3): 235-238. DOI:10.3969/j.issn.1008-1704.2018.03.016.. |
| 13 |
Qi X, An M, Wu T, et al. Transient elastography for significant liver fibrosis and cirrhosis in chronic hepatitis B:a meta-analysis[J]. Can J Gastroenterol Hepatol, 2018, 2018: 3406789. DOI:10.1155/2018/3406789. |
| 14 |
沈秋龙, 陈亚军, 王增萌, 等. 瞬时弹性成像应用于胆道闭锁肝纤维化评估的研究[J]. 中华小儿外科杂志, 2014, 35(4): 275-279. DOI:10.3760/cma.j.issn.0253-3006.2014.04.009. Q L, Chen YJ, Wang ZM, et al. Assessment of liver fibrosis with transient elastography in biliary atresia[J]. Chin J Pediatr Surg, 2014, 35(4): 275-279. DOI:10.3760/cma.j.issn.0253-3006.2014.04.009. |
| 15 |
Zeng X, Xu C, He D, et al. Performance of several simple, noninvasive models for assessing significant liver fibrosis in patients with chronic hepatitis B[J]. Croat Med J, 2015, 56(3): 272-279. DOI:10.3325/cmj.2015.56.272. |
| 16 |
闫珊玲, 郑研, 韦馨, 等. 瞬时弹性成像技术与多参数模型评估慢性肝病肝纤维化程度的临床研究[J]. 实用医院临床杂志, 2017, 14(4): 157-160. DOI:10.3969/j.issn.1672-6170.2017.04.043. S L, Zheng Y, Wei X, et al. Liver transient elastography FibroTouch and multi-parameters model in the diagnosis of liver fibrosis[J]. Practical Journal of Clinical Medicine, 2017, 14(4): 157-160. DOI:10.3969/j.issn.1672-6170.2017.04.043. |
| 17 |
Lin Z, Liang J, Zhu J, et al. Diverse correlations between fibrosis-related factors and liver stiffness measurement by transient elastography in chronic hepatitis B[J]. Eur J Gastroenterol Hepatol, 2018, 30(2): 217-225. DOI:10.1097/MEG.0000000000001023. |
| 18 |
夏清蓉, 段星星, 何静波. 超声弹性成像在肝纤维化中的应用进展[J]. 临床小儿外科杂志, 2016, 15(3): 295-298. DOI:10.3969/j.issn.1671-6353.2016.03.025. Q R, Duan XX, He JB. Advances in applying ultrasonic elastic imaging for liver fibrosis[J]. J Clin Ped Surg, 2016, 15(3): 295-298. DOI:10.3969/j.issn.1671-6353.2016.03.025. |
 2020, Vol. 19
2020, Vol. 19


