代谢性骨病(metabolic bone disease,MBD)是指先天性或后天性的骨量减少,其生化改变特征主要为类骨质组织和骨矿物质成分的减少以及磷钙代谢异常,好发于早产儿。该病可能受多种营养和生物力学因素的影响(如长期营养缺乏、制动和肠外营养以及骨代谢拮抗药物的摄入等)[1-3]。人们通常用代谢性骨病、佝偻病或早产儿骨量减少来描述早产儿骨密度低的情况,并通过生化结果(低磷血症、高磷血症、继发性甲状旁腺功能亢进和(或)佝偻病)和影像学证据(脆性骨折)支持诊断[3, 4]。随着新生儿重症监护技术的进步和早产儿存活率的提高,MBD在早产儿中的发病率越来越高。尽管人们普遍认识到这一问题,但对该病的诊断、护理和治疗尚无统一的认识[5]。因此,如何对新生儿(特别是早产儿)骨代谢疾病进行早期诊断和治疗是亟需解决的问题。
过去人们认为,血钙可以在一定程度上反映骨密度,但是人体血钙水平基本维持恒定,不会随骨密度的变化而出现大幅度变化。既往,血清总碱性磷酸酶水平是检测钙磷代谢最常用的指标,但也不能可靠地诊断MBD并预测其严重程度[6, 7]。近期研究表明,一些骨代谢标志物可作为MBD的早期诊断指标,并可有效预测MBD的长期影响(如长期持续生长受损和骨量峰值降低)[8, 9]。同时维生素D作为一种激素,也可以通过肠钙转运增加钙吸收,并直接影响成骨和破骨作用。有学者认为新生儿维生素D水平与骨密度密切相关,并能够较好地反映骨骼的健康状态[10]。维生素D、骨保护素(osteoprotegerin, OPG)、甲状旁腺激素(parathyroid hormone, PTH)和Ⅰ型胶原C末端肽(C-telopeptides type Ⅰ collagen, CTX)等正逐渐成为不同年龄患者检测骨量的重要指标。本研究以维生素D、OPG、PTH和CTX为检测指标,旨在探讨早产与维生素D和骨代谢指标的关系,为早产引起的代谢性骨病的预测和防治提供理论指导。
材料与方法 一、研究对象与诊断标准选择2012年11月至2013年10月在中国医科大学附属盛京医院产科住院选择剖宫产终止妊娠的新生儿作为研究对象。入选标准:①孕妇怀孕前和孕期无疾病,新生儿无先天性畸形;②孕妇怀孕前和孕期没有吸烟、喝酒和药物滥用;③孕期没有药物摄入。所有参与者均被告知研究内容并签署知情同意书,本研究获得医院医学伦理委员会批准。早产儿的诊断标准参照第七版《妇产科学》的定义:妊娠满28周,但不满37周的活产婴儿。同时对妊娠期进行分组:妊娠28~32周为重度早产组;妊娠32~36周为轻度早产组;妊娠满37周为足月产组[11]。最终共有814例新生儿纳入本研究,其中24例为重度早产,134例为轻度早产,656例为足月产。
二、研究方法 (一) 标本与一般资料的采集取得所有参与者同意,在孕妇剖腹产手术中于脐带抽取4~5 mL脐带血。血样放入4℃冰箱保存,24 h后离心取血清。离心机参数:温度4℃,转速4 000/min,时间5 min。取离心后的血清1~1.5 mL,编码后放入-80℃冰箱保存,统一待检。由专业产科医生完成新生儿一般资料的采集并记录,包括性别、胎龄、出生体重、头围和身长。
(二) 实验步骤25-(OH)-D血清浓度及骨代谢标志物浓度的测定使用人25-(OH)-D ELISA试剂盒及OPG、PTH和CTX ELISA试剂盒,向预先包被抗体的酶标孔中加入标准品、待测样本和HRP标记的抗体,经过温育和洗涤,去除未结合的组分,然后再加入底物A、B,产生蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅与ELISA试剂盒中样品的浓度呈正比。操作步骤:①使用前,将各种试剂充分混匀;②加样:向每个反应孔中加入50 μL稀释好的标准品(同时做空白孔,阴性对照孔及阳性对照孔),再加入生物素标记的抗体。盖上膜板轻轻振荡混匀,37℃孵育1 h。倒净孔内液体,手动洗板4次, 每次30 s;③加酶标抗体:每孔加入新鲜稀释的酶标抗体,轻轻振荡混匀,37℃孵育30 min。倒净孔内液体,手动洗板4次,每次30 s;④加底物液显色:将底物溶液A、B各50 μL加入各反应孔,振荡混匀,37℃孵育10 min;⑤终止反应:将50 μL终止液加入各反应孔;⑥测定数值:在ELISA检测仪上,于450 nm波长处测定各孔的OD值。
三、统计学处理采用SPSS17.0进行统计学分析。对于计量资料采用均数±标准(x±s)进行统计描述,多组间比较采用单因素方差分析。评价两参数间线性关系采用Pearson相关。以P < 0.05为差异有统计学意义。
结 果 一、一般情况814例新生儿中男性432例,女性378例;平均胎龄(37.66±2.15)周。新生儿平均出生体重(3 154.45±687.96)g,平均身长(49.28±3.82)cm,平均头围(34.45±2.27)cm,平均胸围(33.30±3.01)cm。平均血清25-(OH)-D水平(58.88±33.15)nmol/L,平均血清OPG水平(2.43±1.25)ng/L,平均血清PTH水平(13.63±8.48)pg/mL,平均血清CTX水平(0.40±0.20)ng/mL。
二、各孕期组指标比较三组新生儿体重、身长、头围、胸围、25-(OH)-D水平、OPG、PTH和CTX的统计结果见表 1,足月产组体重、身长、头围、胸围大于重度和轻度早产组,差异均有统计学意义(P < 0.05)。三组间25-(OH)-D和PTH水平均存在统计学差异(P < 0.05)。重度早产组与足月产组、重度早产组与轻度早产组OPG水平之间存在统计学差异(P < 0.05),但轻度早产组与足月产组之间无统计学差异(P>0.05),三组间CTX水平无统计学差异(P>0.05)。
|
|
表 1 不同孕产期组中新生儿体格测量和实验室指标的比较(x±s) Table 1 Comparison of neonatal physical measurements and laboratory indices in different pregnant groups |
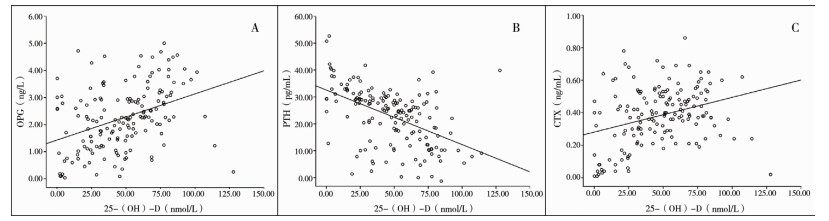
对早产组中共158例早产儿进行25-(OH)-D与骨代谢指标的相关性分析,结果显示维生素D浓度与OPG、CTX的浓度呈正相关(r=0.385,P<0.05; r=0.319,P < 0.05),见图 1A、图 1C;25-(OH)-D与PTH浓度呈负相关(r=-0.500,P < 0.05),见图 1B。OPG与PTH的浓度呈负相关(r=-0.457,P < 0.05),与CTX浓度呈正相关(r=0.364,P < 0.05)。PTH与CTX浓度呈负相关(r=-0.484,P < 0.05)。
|
Download:
|
| 图 1 早产组中维生素D与骨代谢指标的相关性 Fig. 1 Correlation between vitamin D and bone metabolic markers of two preterm groups | |
早产是威胁新生儿健康的重要因素,而MBD为早产引起的骨生化改变之一。胎儿期是骨骼发育最迅速的时期,同时在妊娠晚期胎儿的矿物质累积达到最大值。但早产儿由于过早失去胎盘的营养供给,导致其矿物质累积减少,使其成为骨代谢疾病的高危群体[1, 5]。代谢性骨病通常发生在出生后6~16周,一般在骨矿化严重丢失后才出现临床症状,但是随着人们对该类疾病的重视程度不断增加,MBD的诊断时间越来越早[4, 12]。MBD并发症包括骨折风险增加、呼吸功能受损和早产儿近视,其中骨折为MBD的主要并发症,且胎龄越小MBD的患病率越高,骨折发生率也越高[3, 13]。既往早产儿长骨和肋骨骨折的发生率为10% ~32%,但随着对MBD的关注程度增加,通过有针对性的护理及治疗干预,目前骨折的发生率较之前明显降低[14]。由此可见,加强对MBD的认识对改善早产儿的骨骼健康有重要意义。
骨代谢标志物是检测骨质形成及成骨破骨状态的重要指标,骨代谢标志物来源于骨代谢过程中成骨细胞和破骨细胞的代谢产物,这些标志物能有效评估骨骼生长发育状态,为临床疾病诊治提供有效依据。
OPG是一种成骨细胞分泌的生长因子受体,对骨细胞的生物学作用为抑制成熟破骨细胞的活化,诱导细胞凋亡[15]。有学者指出OPG对主要参与骨吸收过程中组织蛋白酶K的表达有明显的抑制作用[15]。Hauser等[16]研究发现,OPG与髂骨骨密度和髋关节骨折密切相关,在髋关节骨折的患者中OPG低表达可能是导致骨量流失的因素,说明OPG与骨量的维持密切相关。PTH能促进破骨细胞的增殖和分化,而破骨细胞能加速骨骼去矿物化的进程。Hong等[17]研究发现,内源性PTH的增加与骨密度降低相关,内源性PTH过多对皮质骨和小梁骨均有分解代谢作用。而早产儿骨骼的矿化程度相对不足,PTH增高会进一步导致早产儿骨骼破坏和骨量减少。Czech等[18]在一项早产儿的前瞻性研究中发现,PTH是一种简单的骨代谢疾病的早期标志物,与骨量呈负相关。本研究结果显示,重度早产组和轻度早产组的PTH水平高于足月产组,重度早产组的OPG水平明显低于足月产组。故本研究认为早产儿OPG降低,不能有效抑制破骨细胞的分化和活化成骨细胞,同时PTH升高使得破骨细胞异常活跃,加剧了早产儿骨质的破坏和骨量的流失。
CTX是骨吸收过程中破骨细胞酶解Ⅰ型胶原的产物,是骨吸收特异且敏感的指标,对骨骼和软骨的生长起着至关重要的作用。Shiff等[19]研究发现,早产低体重儿CTX水平低于正常水平。本研究结果显示,三组间CTX水平无显著性差异,与之前研究结果不同,可能与本研究中重度早产组的病例数较少有关,可在后续的前瞻性研究中增加重度早产儿的病例数,进一步论证早产与CTX之间的相关性。
维生素D是一种脂溶性维生素,其最重要的作用是调节钙磷代谢,促进钙的吸收、重吸收和钙在骨骼的沉积。有研究发现,维生素D不仅能促进钙吸收,而且能活化成骨细胞功能,影响新生儿骨质形成,同时能够阻止PTH的释放并防止MBD[20]。Ramon等[21]研究发现,25-(OH)-D水平较低时MBD风险增加,且25-(OH)-D水平高于70 nmol/L时似乎可以预防严重MBD的进展。同时,孕晚期的3个月至关重要,因为胎儿在25~40周获得了80%左右的钙磷储备[22]。由于早产多发生在这一时期,新生儿将部分或完全错过获取钙磷储备的最佳阶段[23]。近期研究表明,妊娠25~35周早产儿的维生素D水平受胎龄影响显著,这表明早产也会影响新生儿的维生素D储备[24]。此外,胎龄越小,器官系统越不成熟,需要药物干预的可能性就越大。使用氨茶碱、利尿剂和类固醇激素也会导致骨矿物质的流失以及钙和磷代谢紊乱[25]。本研究结果显示,重度早产组和轻度早产组的维生素D水平明显低于足月产组,进一步说明,早产儿维生素D储备低下,不能有效阻止PTH的释放,而PTH可以活化破骨细胞功能,促进新生儿骨质破坏和BDM的发生和进展。因此,早产儿MBD的发病率高可能与维生素D水平较低相关。
新生儿骨量储备、骨量的增加高峰出现在妊娠中晚期,胎儿骨量状态、骨质强度、破骨和成骨动态平衡均与胎龄相关,其中成骨活动与破骨活动应处于动态平衡中,两者相互调节、相互影响[5]。本研究结果显示早产儿OPG和CTX的水平呈正相关,两者与PTH均呈负相关,由此推断,早产儿PTH含量高,破骨活动异常亢进,导致骨质破坏;同时OPG和CTX相对降低,导致成骨作用相对减弱,不能有效增加骨量,从而引起早产儿MBD。维生素D不仅通过钙肠吸收而影响骨质沉积,近期研究表明维生素D还可直接作用于骨代谢标志物而直接影响成骨破骨功能。Nakamichi等[26]研究发现通过增加小鼠1α,25-(OH)-D3(维生素D的活化形态)的含量可直接刺激小鼠成骨细胞的形成,该研究认为这是维生素D参与骨矿物沉积及骨重建的主要途径,因此新生儿维生素D缺乏很可能导致新生儿骨形成障碍。有学者认为新生儿低维生素D水平不但影响新生儿骨质形成,甚至可减少青少年时期的骨量峰值[27, 28]。本研究显示,早产儿中维生素D浓度、OPG与CTX的浓度三者互为正相关,与PTH浓度呈负相关,同时早产组维生素D水平明显低于足月组,以上数据提示,早产儿中的低维生素D水平与骨转换标志物的水平密切相关。因此,低维生素D水平可能通过抑制OPG和CTX的升高,抑制成骨活动,也可能调控PTH升高,激活破骨活动而增加骨量流失,从而导致早产儿成骨功能障碍及骨量减少,导致MBD的发生。
综上所述,早产儿维生素D和OPG水平较足月儿低,同时PTH水平较高,提示早产儿成骨活动障碍及破骨活动亢进可能是其易患代谢性骨病的关键因素。研究表明维生素D与骨代谢标志物密切相关,说明维生素D缺乏可能是代谢性骨病的原因之一。本研究还提示,监测血清25-(OH)-D、OPG、PTH和CTX水平能很好地反映新生儿(特别是早产儿)骨代谢状态,并可用于指导早产儿维生素D的添加,以帮助早产儿增加骨量。
| 1 |
Backstrom MC, Kuusela AL, Maki R. Metabolic bone disease of prematurity[J]. Ann Med, 1996, 28(4): 275-282. DOI:10.3109/07853899608999080. |
| 2 |
Greenblatt MB, Tsai JN, Wein MN. Bone turnover markers in the diagnosis and monitoring of metabolic bone disease[J]. Clin Chem, 2017, 63(2): 464-474. DOI:10.1373/clin-chem.2016.259085. |
| 3 |
Harrison CM, Johnson K, McKechnie E. Osteopenia of prematurity:a national survey and review of practice[J]. Acta paediatrica, 2008, 97(4): 407-413. DOI:10.1111/j.1651-2227.2007.00721.x. |
| 4 |
Rustico SE, Calabria AC, Garber SJ. Metabolic bone disease of prematurity[J]. J Clin Transl Endocrinol, 2014, 1(3): 85-91. DOI:10.1016/j.jcte.2014.06.004. |
| 5 |
Wood CL, Wood AM, Harker C, et al. Bone mineral density and osteoporosis after preterm birth:the role of early life factors and nutrition[J]. Int J Endocrino, 2013, 2013: 902513. DOI:10.1155/2013/902513. |
| 6 |
Mitchell SM, Rogers SP, Hicks PD, et al. High frequencies of elevated alkaline phosphatase activity and rickets exist in extremely low birth weight infants despite current nutritional support[J]. BMC pediatrics, 2009, 29(9): 47. DOI:10.1186/1471-2431-9-47. |
| 7 |
Faerk J, Peitersen B, Petersen S, et al. Bone mineralisation in premature infants cannot be predicted from serum alkaline phosphatase or serum phosphate[J]. Arch Dis Child Fetal Neonatal Ed, 2002, 87(2): F133-F136. DOI:10.1136/fn.87.2.f133. |
| 8 |
Fewtrell MS, Cole TJ, Bishop NJ, et al. Neonatal factors predicting childhood height in preterm infants:evidence for a persisting effect of early metabolic bone disease?[J]. The Journal of pediatrics, 2000, 137(5): 668-673. DOI:10.1067/mpd.2000.108953. |
| 9 |
Zamora SA, Belli DC, Rizzoli R, et al. Lower femoral neck bone mineral density in prepubertal former preterm girls[J]. Bone, 2001, 29(5): 424-427. DOI:10.1016/s8756-3282(01)00596-8. |
| 10 |
Fu Y, Hu Y, Qin Z, et al. Association of serum 25-hydro-xyvitamin D status with bone mineral density in 0-7 year old children[J]. Oncotarget, 2016, 7(49): 80811-80819. DOI:10.18632/oncotarget.13097. |
| 11 |
Zhu T, Liu TJ, Ge X, et al. High prevalence of maternal vitamin D deficiency in preterm births in northeast China, Shenyang[J]. Int J Clin Exp Pathol, 2015, 8(2): 1459-1465. |
| 12 |
Chin LK, Doan J, Teoh YS, et al. Outcomes of standardised approach to metabolic bone disease of prematurity[J]. J Paediatr Child Health, 2018, 54(6): 665-670. DOI:10.1111/jpc.13813. |
| 13 |
Bowden LS, Jones CJ, Ryan SW. Bone mineralisation in ex-preterm infants aged 8 years[J]. Eur J Pediatr, 1999, 158(8): 658-661. DOI:10.1007/s004310051171. |
| 14 |
Harrison CM, Gibson AT. Osteopenia in preterm infants[J]. Arch Dis Child Fetal Neonatal Ed, 2013, 98(3): F272-F275. DOI:10.1136/archdischild-2011-301025. |
| 15 |
Wittrant Y, Couillaud S, Theoleyre S, et al. Osteoprotegerin differentially regulates protease expression in osteoclast cultures[J]. Biochem Biophys Res Commun, 2002, 293(1): 38-44. DOI:10.1016/S0006-291X(02)00179-1. |
| 16 |
Hauser B, Zhao S, Visconti MR, et al. Autoantibodies to osteoprotegerin are associated with low hip bone mineral density and history of fractures in axial spondyloarthritis:a cross-sectional observational study[J]. Calcified Tissue International, 2017, 101(4): 375-383. DOI:10.1007/s00223-017-0291-2. |
| 17 |
Hong AR, Lee JH, Kim JH, et al. Effect of endogenous parathyroid hormone on bone geometry and skeletal microarchitecture[J]. Calcified Tissue International, 2019, 104(4): 382-389. DOI:10.1007/s00223-019-00517-0. |
| 18 |
Czech-Kowalska J, Czekuc-Kryskiewicz E, Pludowski P, et al. The clinical and biochemical predictors of bone mass in preterm infants[J]. PloS one, 2016, 11(11): e0165727. DOI:10.1371/journal.pone.0165727.eCollection2016. |
| 19 |
Shiff Y, Eliakim A, Shainkin-Kestenbaum R, et al. Measurements of bone turnover markers in premature infants[J]. J Pediatr Endocrinol Metab, 2001, 14(4): 389-395. DOI:10.1515/jpem.2001.14.4.389. |
| 20 |
Rehman MU, Narchi H. Metabolic bone disease in the preterm infant:Current state and future directions[J]. World J Methodol, 2015, 5(3): 115-121. DOI:10.5662/wjm.v5.i3.115. |
| 21 |
Montaner Ramon A, Fernandez Espuelas C, Calmarza Calmarza P, et al. Risk factors and biochemical markers in metabolic bone disease of premature newborns[J]. Rev Chil Pediatr, 2017, 88(4): 487-494. DOI:10.4067/S0370-41062017000400007. |
| 22 |
Lothe A, Sinn J, Stone M. Metabolic bone disease of prematurity and secondary hyperparathyroidism[J]. J Paediatr Child Health, 2011, 47(8): 550-553. DOI:10.1111/j.1440-1754.2011.02019.x. |
| 23 |
Mimouni FB, Mandel D, Lubetzky R, et al. Calcium, phosphorus, magnesium and vitamin D requirements of the preterm infant[J]. World Rev Nutr Diet, 2014, 110: 140-151. DOI:10.1159/000358463. |
| 24 |
Henriksen C, Helland IB, Ronnestad A, et al. Fat-soluble vitamins in breast-fed preterm and term infants[J]. Eur J Clin Nutr, 2006, 60(6): 756-762. DOI:10.1038/sj.ejcn.1602379. |
| 25 |
Viswanathan S, Khasawneh W, McNelis K, et al. Metabolic bone disease:a continued challenge in extremely low birth weight infants[J]. J Parenter Enteral Nutr, 2014, 38(8): 982-990. DOI:10.1177/0148607113499590. |
| 26 |
Nakamichi Y, Takahashi N. Current Topics on Vitamin D.The role of active forms of vitamin D in regulation of bone remodeling[J]. Clin Calcium, 2015, 25(3): 395-402. |
| 27 |
Marwaha RK, Garg MK, Sethuraman G, et al. Impact of three different daily doses of vitamin D3 supplementation in healthy schoolchildren and adolescents from North India:a single-blind prospective randomised clinical trial[J]. Br J Nutr, 2019, 121(5): 538-548. DOI:10.1017/S0007114518003690. |
| 28 |
Holick MF. Resurrection of vitamin D deficiency and rickets[J]. J Clin Invest, 2006, 116(8): 2062-2072. DOI:10.1172/JCI29449. |
 2020, Vol. 19
2020, Vol. 19


