肝母细胞瘤(hepatoblastoma,HB)是婴幼儿最常见的胚胎源性肝脏肿瘤,多发生于3岁以下婴幼儿,占儿童原发肝脏恶性肿瘤的80%[1]。该病发展迅速,瘤体生长迅速,恶性程度高,易发生浸润和侵袭转移,目前多采用手术联合化疗的多学科综合治疗方案[2]。由于术后残留、复发,对化疗药物的不耐受及耐药性等问题一直未得到有效解决,因此寻找安全、低毒的化疗药物是目前国内外研究热点之一[3]。目前有关PI3K激酶小分子抑制剂的研究已经成为肿瘤学研究的热点,但是有关靶向亚型的小分子抑制剂对肝母细胞瘤效应的研究较少。因此,本研究将采用新型的小分子抑制剂Serabelisib,通过靶向PI3K/Akt信号通路,探讨其对于肝母细胞瘤细胞增殖、凋亡的作用,同时检测相关的分子机制,为肝母细胞瘤的治疗寻找新的药物和途径,并为Serabelisib治疗肝母细胞瘤的临床前研究提供实验依据和理论基础。
材料与方法 一、细胞系与试剂人肝母细胞瘤细胞系HepG2由本实验室保存[4]。Serabelisib、二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Selleck公司;胎牛血清购自美国Gibco公司;DMEM高糖培养基、胰酶购自美国HyClone公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)购自美国Sigma公司,PBS缓冲液配制成5 mg/mL储存液,0.22 μM滤膜过滤除菌,分装后于-20℃避光保存;Annexin V-FITC/PI apoptosis kit购自联科生物公司;FACS Calibur流式细胞仪购自美国BD公司;针对89KD PARP裂解片段的cleaved-PARP抗体、Akt抗体及p-Akt抗体购自美国Cell Signaling公司;β-Actin抗体购自美国Santa Cruz公司;SuperSignal West Pico Chemiluminescent substrate trial kit(34079)购自美国Thermo公司。显影剂、定影剂和X光片均购自日本柯达公司。
二、实验方法 (一) HepG2细胞培养及Serabelisib的配制HepG2细胞培养于含10%胎牛血清的DMEM高糖培养基中,于37 ℃、5%CO2细胞培养箱中培养。细胞经0.25%胰酶消化传代,取对数生长期的细胞进行培养。Serabelisib先用DMSO配成原液,分装冻存,临用时细胞培养基稀释成所需浓度,DMSO终浓度为0.1%。
(二) MTT比色法调整处于对数期细胞悬液的浓度,将HepG2细胞接种在96孔板上(每孔100 μL),12 h后加入不同浓度Serabelisib并处理不同时间;加入MTT(每孔10 μL),37℃、5% CO2培养4 h;1 800 rpm离心5 min,小心弃上清,加入DMSO溶解各孔MTT代谢产物,酶标仪内震荡孵育10 min,检测492 nm波长下吸光度值(A)。细胞生长抑制率(%)=[1-(处理组A均值/对照组A均值)]×100%;细胞活性(%)=(处理组A均值/对照组A均值)×100%。重复实验3次,取平均值,计算标准差。
(三) 细胞凋亡测定将HepG2细胞接种在6孔板上,12 h后加入不同浓度Serabelisib处理48 h后,使用AnnexinV-FITC/PI细胞凋亡检测试剂盒。收集细胞于离心管中,1 000 rpm离心5 min,加入500 μL 1×结合缓冲液、5 μL Annexin V-FITC和5 μL PI混匀,避光孵育20 min,流式细胞仪进行检测,使用Cellquest软件进行结果分析。
(四) Western blot检测相关蛋白HepG2细胞以不同浓度Serabelisib处理48 h后,以蛋白裂解液裂解细胞,提取上清液即为总蛋白,按照BCA蛋白浓度测定试剂盒测定蛋白质浓度。99℃、10 min加热变性后,进行10%SDS-PAGE凝胶电泳。然后将蛋白质转移置PVDF膜上,封闭、孵育一抗、二抗,X光片曝光、显影、定影显示目标条带。使用NIH ImageJ软件对条带进行密度分析。
三、统计学处理应用SPSS16.0对数据进行统计分析。所有服从正态分布的计量数据以(x±s)表示。多组间均数独立样本采用单因素方差分析,两样本均数间比较采用t检验。P < 0.05为差异有统计学意义。
结 果 一、Serabelisib对HepG2细胞增殖的抑制作用为证实小分子抑制剂Serabelisib对人肝母细胞瘤细胞株的抑制作用,以不同浓度Serabelisib(0 μmol/L,2 μmol/L,4 μmol/L,8 μmol/L)处理人肝母细胞瘤细胞系HepG2细胞24 h、48 h、72 h,以MTT法检测细胞活性,并计算细胞生存率。结果显示随着浓度的升高,Serabelisib对于细胞增殖的抑制作用增强,且抑制作用呈剂量和时间依赖性(图 1)。

|
Download:
|
| 图 1 Serabelisib抑制人肝母细胞瘤细胞系的增殖。HepG2细胞以104个细胞/孔种植于96孔板,不同浓度Serabelisib(0 μmol/L, 2 μmol/L, 4 μmol/L, 8 μmol/L)处理不同时间(24 h,48 h,72 h)后,以MTT法检测细胞活性。平行3孔,柱状图表示生存率和标准差。*表示与对照组(0 μmol/L)相比P<0.05 Fig. 1 Serabelisib inhibited cellular growth of human hepatoblastoma cell lines | |
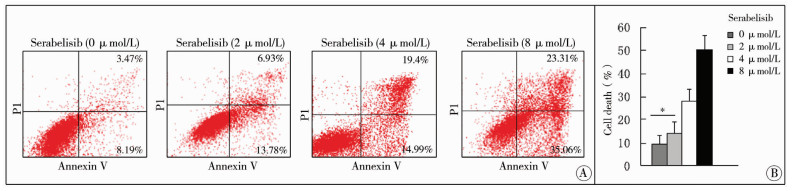
不同浓度Serabelisib(0 μmol/L,2 μmol/L,4 μmol/L,8 μmol/L)处理人肝母细胞瘤细胞系HepG2细胞48 h后,以Annexin V-FITC/PI双标法检测细胞早期凋亡率和晚期凋亡率。发现HepG2细胞早期和晚期凋亡率均随Serabelisib浓度增加而增加,呈明显剂量依赖性(图 2),实验重复3次,取均值和标准差。细胞凋亡趋势与MTT结果相一致。提示Serabelisib对人肝母细胞瘤细胞具有抑制作用,可能与其诱导细胞凋亡有关。
|
Download:
|
| 图 2 Serabelisib诱导HepG2细胞系凋亡,呈明显剂量依赖性 注 A:HepG2细胞以不同浓度Serabelisib处理48 h后,Annexin V和PI染色后,流式细胞仪检测细胞凋亡率。本组图片为其中1次检测结果,分别标识早期凋亡(Annexin V-FITC+/PI-)和晚期凋亡(Annexin V+/P+)和完全坏死细胞(Annexin V-FITC-/PI+)比例; B:柱状图表示早期凋亡和晚期凋亡细胞总比例,为3次实验平均值,bar表示标准差。*表示与对照(0 μmol/L)相比P<0.05 Fig. 2 The apoptosis of HepG2 cell line was induced by Serabelisib in a dose-dependent manner | |
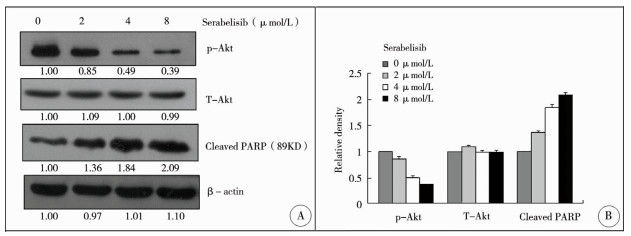
Akt的本质是大小为56kD的丝氨酸/苏氨酸蛋白激酶,处于PI3-K信号转导通路的核心部位。Akt在PI3-K等作用下发生磷酸化后充分活化,其磷酸化水平反映信号通路活化水平。PARP (polyADP-ribose polymerase)是一种DNA修复酶,为Caspase的催化底物,可被催化为89KD和24KD的裂解产物而失活,其裂解片段是细胞凋亡的分子标志之一。为进一步证明Serabelisib可以抑制PI3K-Akt信号通路并且诱导HepG2细胞凋亡,我们用Western印迹检测了Serabelisib作用下HepG2细胞株Akt蛋白磷酸化水平及PARP裂解产物水平的变化。结果显示,Serabelisib抑制Akt激酶磷酸化水平存在剂量依赖性,提示该小分子抑制剂可以抑制PI3K/Akt信号通路活性;而PARP 89KD裂解片段随Serabelisib浓度增加而增加,呈剂量依赖性(图 3)。
|
Download:
|
| 图 3 Serabelisib抑制人肝母细胞瘤细胞PI3K/Akt信号通路活性及促进凋亡相关蛋白表达 注 A:HepG2细胞以不同浓度Serabelisib(0 μmol/L,2 μmol/L,4 μmol/L,8 μmol/L)处理48 h后,提取细胞总蛋白,Western blot检测p-Akt、T-Akt及PARP 89KD裂解产物,以β-actin作为上样量参照。条带使用ImageJ软件进行扫描并分析; B:采用NIH ImageJ软件分析各条带灰度值,并与β-actin进行比较 Fig. 3 Serabelisib inhibited the activity of PI3K/Akt signaling pathway and promoted the expression of apoptosis-related proteins in HepG2 cells | |
肝母细胞瘤(hepatoblastoma,HB)是婴幼儿最常见的胚胎源性肝脏肿瘤,其主要形成机制是在胚胎发育期间,由肝脏内的多能干细胞分化增殖产生恶性肿瘤细胞,多发生于3岁以下婴幼儿,占儿童原发肝脏恶性肿瘤的80%[1, 2]。目前的治疗手段主要是手术联合化疗。HB治愈率在80%左右,而剩余20%的侵袭性更强的肿瘤对化疗基本没有反应,这些患者的预后很差,但是由于术后残留、复发,患者对化疗药物的不耐受及耐药性等负面效应一直存在[3, 5]。
目前HB的发病机制尚不清楚,除了肿瘤遗传学事件的发生,肝母细胞瘤的发生、增殖、侵袭与转移同样离不开环境中的各种生物信号,信号转导通路的异常也被认为是肝母细胞瘤的发病机制之一。近期研究表明,PI3K-Akt通路是一个经典的促增殖、抑凋亡的信号转导途径,在促进肿瘤细胞的生长、增殖,抑制细胞凋亡,促进细胞侵袭和转移,促进血管生成,抵抗化疗和放疗中细胞的凋亡上均发挥重要作用,该信号通路的所有成员(包括Akt)被认为是单一治疗或联合治疗的靶点用于治疗各种癌症,阻断PI3K/Akt信号转导通路的异常活化成为肿瘤治疗的新靶点[6-10]。
凋亡是细胞程序化死亡的过程,发生在细胞老化过程中,在正常组织的动态平衡和发育中起着重要作用[11]。细胞凋亡是一种重要的抗肿瘤途径,多种抗肿瘤药物通过诱导细胞凋亡在肿瘤中发挥重要作用,在癌变过程中诱导细胞凋亡被认为能有效减缓癌症的进展[12, 13]。PARP(polyADP-ribose polymerase)是一种DNA修复酶,为Caspase的催化底物,可被催化为89KD和24KD的裂解产物而失活,其裂解片段也是细胞凋亡的分子标志之一[14]。Akt是大小为56kD的丝氨酸/苏氨酸蛋白激酶,处于PI3-K信号转导通路的核心部位。Akt在PI3-K等作用下发生磷酸化后充分活化,其磷酸化水平反映了信号通路活化水平[15]。细胞凋亡的激活受多种信号通路的调控,其中PI3K/AKT通路是最重要的信号通路之一[16]。
研究表明,PI3K/Akt信号通路异常活化在肝母细胞瘤的发生发展中起着重要作用[17, 18]。有研究表明肝母细胞瘤中存在PI3Kα亚基突变,从而导致激酶活性增加。通过PI3K体外抑制和随后的Akt和GSK3β磷酸化的减少证实PI3K/Akt信号通路的异常活化是肝母细胞瘤细胞存活的关键[17]。
Serabelisib(INK-1117,mLN-1117,TAK-117)是一种新型的、有效的、具有高度选择性并且可采用口服的PI3Kα抑制剂[19]。Serabelisib可有效抑制PI3Kα的活性,其选择性比其他Ⅰ类PI3K家族成员高100倍以上。对携带有PIK3α突变的肿瘤细胞系进行Serabelisib处理,细胞内PI3K信号通路被有效抑制,细胞增殖阻滞并引起细胞凋亡,并且有效抑制肿瘤细胞的增殖,抑制胞内Akt的磷酸化和活性。Serabelisib单用或者与其他抑制剂联合应用已经在非血液系统恶性肿瘤、胃癌、乳腺癌、肾肿瘤及非小细胞肺癌在内的实体瘤中进行了体外及临床研究,疗效得到了肯定[9, 19, 20]。
目前PI3K激酶小分子抑制剂的研究已经成为肿瘤学研究的热点,但是靶向亚型的小分子抑制剂对于肝母细胞瘤效应的研究较少。本研究发现,PI3Kα特异性的小分子抑制剂Serabelisib可以抑制肝母细胞瘤细胞系细胞的增殖,诱导其凋亡,并呈剂量依赖性,其分子机制涉及到抑制PI3K/Akt信号通路及PARP的裂解失活;后续我们将在其他HB细胞系及体内实验进一步验证该小分子抑制剂的作用,为Serabelisib用于肝母细胞瘤治疗的临床前研究提供实验依据和理论基础。
| 1 |
金晟, 施诚仁. 儿童肝母细胞瘤研究现状[J]. 临床儿科杂志, 2014, 32(10): 988-992. DOI:10.3969/j.issn.1000-3606.2014.10.31. Jin S, Shi CR. Current research status of pediatric hepatoblastoma[J]. Journal of Clinical Pediatrics, 2014, 32(10): 988-992. DOI:10.3969/j.issn.1000-3606.2014.10.31. |
| 2 |
Lim I, Bondoc AJ, Geller JI, et al. Hepatoblastoma-the evolution of biology, surgery, and transplantation[J]. Children (Basel), 2018, 6(1): E1. DOI:10.3390/children6010001. |
| 3 |
Trobaugh-Lotrario AD, Katzenstein HM. Chemotherapeutic a-pproaches for newly diagnosed hepatoblastoma:past, present, and future strategies[J]. Pediatr Blood Cancer, 2012, 59(5): 809-812. DOI:10.1002/pbc.24219. |
| 4 |
李勇, 肖雅玲, 陈朝晖, 等. 姜黄素对人肝母细胞瘤细胞株HepG2增殖和转移的影响[J]. 中国普通外科杂志, 2014, 23(1): 117-120. DOI:10.7659/j.issn.1005-6947.2014.01.023. Li Y, Xiao YL, Chen ZH, et al. Effects of Curcumin on proliferation and metastasis of human hepatoblastoma cell line HepG2 in vitro[J]. Chin J Gen Surg, 2014, 23(1): 117-120. DOI:10.7659/j.issn.1005-6947.2014.01.023. |
| 5 |
Marin J, Briz O, Herraez E, et al. Molecular bases of the poor response of liver cancer to chemotherapy[J]. Clin Res Hepatol Gastroenterol, 2018, 42(3): 182-192. DOI:10.1016/j.clinre.2017.12.006. |
| 6 |
Vivanco I, Sawyers CL. The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J]. Nat Rev Cancer, 2002, 2(7): 489-501. DOI:10.1038/nrc839. |
| 7 |
Osaki M, Oshimura M, Ito H. PI3K-Akt pathway:its functions and alterations in human cancer[J]. Apoptosis, 2004, 9(6): 667-676. DOI:10.1023/B:APPT.0000045801.15585.dd. |
| 8 |
Liang J, Slingerland JM. Multiple roles of the PI3K/PKB (Akt) pathway in cell cycle progression[J]. Cell Cycle, 2003, 2(4): 339-345. |
| 9 |
Janku F, Yap TA, Meric-Bernstam F. Targeting the PI3K pathway in cancer:are we making headway?[J]. Nat Rev Clin Oncol, 2018, 15(5): 273-291. DOI:10.1038/nrclinonc.2018.28. |
| 10 |
Alzahrani AS. PI3K/Akt/mTOR inhibitors in cancer:At the bench and bedside[J]. Semin Cancer Biol, 2019, 59: 125-132. DOI:10.1016/j.semcancer.2019.07.009. |
| 11 |
Arends MJ, Wyllie AH. Apoptosis:mechanisms and roles in pathology[J]. Int Rev Exp Pathol, 1991, 32(32): 223-254. DOI:10.1016/b978-0-12-364932-4.50010-1. |
| 12 |
Rybczynska AA, Boersma HH, de Jong S, et al. Avenues to molecular imaging of dying cells:Focus on cancer[J]. Med Res Rev, 2018, 38(6): 1713-1768. DOI:10.1002/med.21495. |
| 13 |
Ucker DS, Levine JS. Exploitation of apoptotic regulation in cancer[J]. Front Immunol, 2018, 27(9): 241. DOI:10.3389/fimmu.2018.00241. |
| 14 |
Boice A, Bouchier-Hayes L. Targeting apoptotic caspases in cancer[J]. Biochim Biophys Acta Mol Cell Res, 2020, 1867(6): 118688. DOI:10.1016/j.bbamcr.2020.118688. |
| 15 |
Rai N, Sarkar M, Raha S. Piroxicam, a traditional non-steroidal anti-inflammatory drug (NSAID) causes apoptosis by ROS mediated Akt activation[J]. Pharmacol Rep, 2015, 67(6): 1215-1223. DOI:10.1016/j.pharep.2015.05.012. |
| 16 |
Jiang C, Ma S, Hu R, et al. Effect of CXCR4 on apoptosis in osteosarcoma cells via the PI3K/Akt/NF-κβ signaling pathway[J]. Cell Physiol Biochem, 2018, 46(6): 2250-2260. DOI:10.1159/000489593. |
| 17 |
Hartmann W, Küchler J, Koch A, et al. Activation of phosphatidylinositol-3'-kinase/AKT signaling is essential in hepatoblastoma survival[J]. Clin Cancer Res, 2009, 15(14): 4538-4545. DOI:10.1158/1078-0432.CCR-08-2878. |
| 18 |
Xia Z, Zhang N, Ding D. Proliferation and migration of hepatoblastoma cells are mediated by IRS-4 via PI3K/Akt pathways[J]. Int J Clin Exp Med, 2014, 7(10): 3763-3769. |
| 19 |
Juric D, de Bono JS, LoRusso PM, et al. A first-in-human, phase I, dose-escalation study of TAK-117, a selective PI3Kα isoform inhibitor, in patients with advanced solid malignancies[J]. Clin Cancer Res, 2017, 23(17): 5015-5023. DOI:10.1158/1078-0432.CCR-16-2888. |
| 20 |
Patel CG, Rangachari L, Patti M, et al. Characterizing the sources of pharmacokinetic variability for TAK-117 (Serabelisib), an investigational phosphoinositide 3-kinase alpha inhibitor:a clinical biopharmaceutics study to inform development strategy[J]. Clin Pharmacol Drug Dev, 2019, 8(5): 637-646. DOI:10.1002/cpdd.613. |
 2020, Vol. 19
2020, Vol. 19

