肝母细胞瘤是儿童最常见的肝脏恶性实体肿瘤,约占所有儿童肝脏恶性肿瘤的2/3[1]。尽管目前肝母细胞瘤经过化疗、手术、介入等综合治疗后,生存率提高到70% ~80%[2],但对于治疗后疾病程度分期(post-treatment extent of disease, POST-TEXT)为Ⅲ期和Ⅳ期肝母细胞瘤患儿的治疗仍然存在着较大的困难和挑战。以往认为,对于这部分病例应首选肝移植治疗,可使生存率达到80% ~90%[3]。近年来,越来越多的研究结果显示对POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤进行非移植性肝肿瘤切除术也可取得与肝移植相似的治疗效果[4, 5]。因此,本研究回顾性分析复旦大学附属儿科医院收治的POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤患儿临床资料,旨在探讨肝肿瘤切除术治疗POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤的中长期治疗效果。
材料与方法 一、临床资料2009年1月至2019年6月,复旦大学附属儿科医院肿瘤外科收治POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤患儿共37例,其中男25例,女12例,发病年龄2~91个月,平均年龄(23.92±22.45)个月。收集所有患儿治疗前、治疗后两个时点的AFP、CT或MRI影像学检查及手术情况等资料。采用国际儿童肿瘤研究会肝脏上皮肿瘤研究组(SIOP Epithelial Liver Tumor Study Group,SIOPEL)的治疗前疾病程度分期(pre-treatment extent of disease,PRETEXT)及POST-TEXT分期系统评估新辅助化疗前、后的肿瘤分期。该研究获得复旦大学附属儿科医院伦理委员会批准。
二、治疗流程所有患儿根据美国儿童肿瘤协会(Children Oncology Group,COG)诊治流程进行了新辅助化疗(采取C5V方案,即顺铂+长春新碱+5-氟尿嘧啶);若疗效不佳,更换化疗方案为C5VD(顺铂+长春新碱+5-氟尿嘧啶+阿霉素)。术前化疗2~4个疗程(最多不超过6个疗程)后评估手术条件,选择合适手术方式。对累及肝三叶者行标准肝三叶切除术;累及半肝+1个肝段者行扩大半肝切除术;中央型肝母细胞瘤尽量选择肝中叶切除术;累及多个肝段者行不规则肝切除术,且尽可能多保留残余肝脏;对肝三叶切除或不规则肝切除后残肝比例 < 40%者,选择联合肝脏离断和门静脉结扎二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS),若以上术式仍无法切除肿瘤则选择肝移植。术后3周开始辅助化疗,复查甲胎蛋白2次均结果正常后停止治疗。
三、随访与统计采用邮寄信件、电话联系、网络问诊、患儿复诊等方式进行随访,随访终点为2020年1月。已死亡者的相关数据判定为完全数据,仍存活者或失访者的相关数据判定为截尾数据。采用SPSS18.0进行统计分析。采用Kaplan-Meier法进行生存分析, 采用Log-rank法分析生存曲线之间的差异是否显著;服从正态分布的数值变量资料以(x±s)表示, 采用独立样本t检验进行组间比较。P < 0.05为差异有统计学意义。
结 果 一、临床特征37例患儿血清甲胎蛋白(alpha fetoprotein, AFP)均明显高于正常水平,其中1例 < 1 000 ug/L,9例1 000~100 000 ug/L,27例>100 000 ug/L。PRETEXT Ⅱ期、Ⅲ期和Ⅳ期病例数分别为1例、31例和5例;肺转移6例,门静脉瘤栓3例。术前病理活检明确诊断29例(78.4%),临床诊断8例(21.6%)。治疗前肿瘤体积大小为105.23~1235.06 cm3,平均(581.26±290.89)cm3。POST-TEXT Ⅲ期和Ⅳ期病例数分别为34例和3例,其中有1例PRETEXT Ⅱ期升级为POST-TEXT Ⅳ期,3例PRETEXT Ⅳ期降级为POST-TEXT Ⅲ期。于新辅助化疗2个疗程内手术者8例(21.6%);4个疗程内手术者22例(59.4%);6个疗程内手术者7例(18.9%),术前疗程与分期之间的关系见表 1。37例中,有5例因初始化疗方案疗效不佳更换了方案。化疗后肿瘤体积20.66~1235.77 cm3,平均(268.78±256.52)cm3,其中体积缩小30例(81.1%),平均缩小(67.45±14.98)%;无变化2例(5.4%);增大5例(13.5%),平均增大(92.14±74.71)%,在体积增大的病例中有2例系瘤内出血所致。
|
|
表 1 术前化疗疗程及肿瘤体积变化与分期关系(n) Table 1 Relationship between preoperative chemotherapeutic course and tumor volume change/stage(n) |
除2例被建议肝移植手术而放弃治疗外,其余35例行肝肿瘤切除术,其中肝三叶切除术7例(左肝三叶切除3例,右肝三叶切除4例);扩大半肝切除术8例(左半肝+Ⅴ段切除4例,右半肝+Ⅳ段切除4例);不规则肝切除术4例;肝中叶切除术12例;ALPPS术4例。平均手术时间(262.29±107.16)min,术中平均出血量(236.86±212.41)mL。术中阻断肝门仅4例(均未采用Glisson蒂横断技术),22例采用Glisson蒂横断技术,其平均出血量与未采用该技术手术的病例相比明显减少,差异有统计学意义[(147.73±137.46)mL vs.(387.69±235.69)mL,P=0.001]。术后出现胆漏9例,再次手术引流4例,其中采用Glisson蒂横断技术者发生胆漏6例(27.3%);未采用该技术者发生胆漏3例(23.1%),两者间差异无统计学意义(P=0.784)。术中有3例未采用Glisson蒂横断技术的病例因肝门部胆道损伤,额外行肝管空肠吻合术。所有病例术后肝功能均恢复正常。POST-TEXT分期、手术时间、出血量和胆漏与手术方式的关系见表 2。
|
|
表 2 采取不同手术方式患儿的手术时间、出血量及预后 Table 2 Comparison of outcomes for different surgical approaches |
病理检查证实切缘阳性1例,阴性34例,其中切缘>1 cm 7例(20.0%),切缘0.5~1 cm 15例(42.9%),切缘 < 0.5 cm 7例(18.9%),紧贴肿瘤边缘切除6例(16.2%)。所有病例病理诊断均为肝母细胞瘤(包括术前活检及手术切除标本病理检查),其中胚胎型6例,胎儿型9例,混合型22例。术后AFP恢复正常30例,平均恢复正常时间(11.8±10.5)周,90%的病例在12周内恢复。术后辅助化疗33例,平均(4.76±2.36)个疗程后停止化疗。
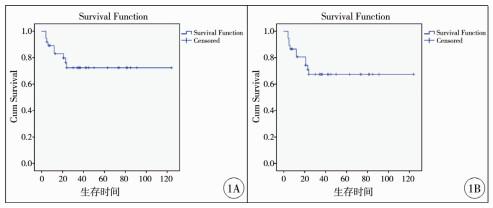
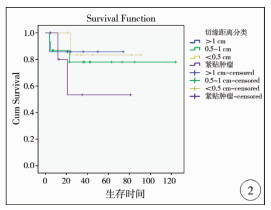
三、随访结果截至2020年1月,成功随访34例,失访3例,随访率91.9%。随访时间4~124个月,平均随访时间(35.73±29.72)个月。术后肿瘤复发7例,肝脏局部复发3例,肺转移3例,骨转移1例,平均复发时间(6±3.96)个月。手术方式及术中切缘距离与肿瘤复发之间的关系见表 3,肿瘤复发与手术方式(P=0.352)及术中切缘距离(P=0.932)之间无统计学关联性。至随访结束,无瘤生存26例,带瘤生存2例,5年总体生存率为72.3%,5年无瘤生存率为67.4%,术后死亡6例(图 1)。切缘>1 cm、切缘0.5~1 cm、切缘 < 0.5 cm和切缘紧贴肿瘤者5年总体生存率分别为85.7%、78.0%、83.3%和53.3%(图 2),不同切缘距离之间差异无统计学意义(P=0.701)。
|
Download:
|
| 图 1 Kaplan-Meier生存曲线 注 1A:5年总体生存率;1B:5年无瘤生存率 Fig. 1 Kaplan-Meier survival curve. A:5-year survival rate; B:tumor-free survival rate | |
|
Download:
|
| 图 2 Kaplan-Meier生存曲线显示不同肿瘤切缘距离的5年总体生存率 Fig. 2 Kaplan-Meier survival curve depicting survival rates for margin distances of different tumors | |
|
|
表 3 不同手术方式及不同切缘距离病例肿瘤复发情况 Table 3 Relationship between surgical approaches and intraoperative marginal distance and tumor recurrence |
肿瘤切除是否完整是影响肝母细胞瘤能否治愈的重要因素之一。尽管COG和SIOPEL对于早期肝母细胞瘤是否需要新辅助化疗后再手术存在争议,但由于进展期病例往往无法一期完整切除肿瘤,因而对于该类病例新辅助化疗后再手术的治疗策略已形成共识[6, 7]。目前,以铂类药物为基础的新辅助化疗能够缩小肿瘤的体积,降低肿瘤破溃的风险,并可使肿瘤与周围肝组织和血管结构形成解剖间隙,从而大大提高PRETEXT Ⅲ期和Ⅳ期病例的肿瘤切除率[8, 9]。SIOPEL相关临床研究表明,在高强度新辅助化疗后,超过一半的PRETEXT Ⅳ期病例可以完整切除肿瘤[10]。因而,本研究中的所有进展期病例均接受了新辅助化疗,其中有30例(81.1%)肿瘤体积缩小,平均缩小幅度达67.45%。尽管新辅助化疗疗程越多,肿瘤体积缩小可能越明显,但目前观点认为当肿瘤与主要肝脏血管(左右门静脉分叉、肝后下腔静脉、肝中静脉)有一定距离,并保证一定的残肝大小时,可考虑行肝肿瘤切除术。因而,SIOPEL主张4个疗程后即可评估能否手术[11],而COG则主张每2个疗程后进行1次评估,最多不超过6个疗程[12]。本研究采用了COG的治疗策略,在新辅助化疗4个疗程内有81.1%的病例具备了手术条件,而在6个疗程后,仅2例(5.4%)因无法切除肿瘤需要进行肝移植。因此,新辅助化疗4~6个疗程可为绝大部分进展期肝母细胞瘤病例创造肿瘤根治性手术的条件。
肝移植被认为是新辅助化疗后晚期肝母细胞瘤(特别是累及肝门的POST-TEXT Ⅲ期和POST-TEXT Ⅳ期)的首选治疗方案,可使该类患儿的生存率提高到80% ~90%[10, 11]。近年来,随着化疗方案的优化、影像评估的进步及手术技术的提高,越来越多的研究对一些POST-TEXT Ⅲ期和Ⅳ期的病例进行肝肿瘤切除术,并取得了与肝移植相似的生存率[4, 5, 13]。对于POST-TEXT Ⅲ期和Ⅳ期的肝母细胞瘤应采用何种肿瘤切除术式,一方面取决于肿瘤与主要肝脏血管之间的关系,并尽可能多保留残余肝脏组织;另一方面取决于能否完整切除肿瘤,确保切缘阴性。因此,在本研究中除了常规肝三叶切除外,根据肿瘤累及肝段的多少和与肝脏血管的关系,分别选择了扩大半肝切除术、肝中叶切除术和不规则肝切除术等术式,在保证完整切除肿瘤的基础上,尽可能多保留残余肝脏,并且各种术式的手术时间和出血量无明显差异。对于残肝不足而无法行肝肿瘤切除术的病例,ALPPS术通过分步手术的方法,可在短期内使残肝体积迅速增大,从而为极限肝脏切除创造条件。2015年有学者首次报道了ALPPS术在儿童肝母细胞瘤中的运用,完成了肿瘤的R0期切除,并避免了肝衰竭的发生[14]。本研究中有4例因残余肝脏体积 < 40%而进行了ALPPS术,所有患儿残肝体积在2周内迅速增大,均顺利切除了肝脏肿瘤而未出现肝功能不全。因此,我们认为对于因残肝不足而无法行肿瘤根治术的肝母细胞瘤,可开展ALPPS术,在保证切除肿瘤的基础上,减少肝衰竭的发生。
POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤往往体积较大,累及较多肝叶或肝段,需要进行非解剖性肝切除,术中采用Glisson蒂横断式解剖性肝肿瘤切除术,根据肝切除范围高选择性阻断二级Glisson蒂,可减少术中出血量,降低胆道损伤和胆漏的发生率,并最大程度避免术中阻断肝门[15, 16]。在本研究中,有4例术中未采用Glisson蒂横断技术因而阻断了肝门,而22例采用Glisson蒂横断技术,且其平均出血量明显少于未采用Glisson蒂横断技术的病例。尽管采用Glisson蒂横断技术者胆漏的发生率与未采用该技术者相似,且以ALPPS术的发生率最高,但胆道损伤出现的概率明显降低,体现了Glisson蒂横断技术的优势,值得在肝肿瘤切除术中推广使用。虽然采用Glisson蒂横断技术可减少胆道损伤的发生,但对于肝脏切面毛细胆管出现的渗漏,则需保证创面的引流通畅,尤其是出现包裹性积液时,更需充分引流,往往都能通过保守治疗达到痊愈。
近年来,对POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤进行非移植性肝肿瘤切除术的报道逐渐增多,5年总体生存率为80.7% ~88%,5年无瘤生存率为62.2% ~75%[4, 5],取得了与肝移植近似的治疗结果。我们的研究结果与文献报道类似,说明对POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤进行肝肿瘤切除是切实可行的。对POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤进行肝肿瘤切除时,有时很难保证切缘>1 cm。尽管肿瘤肉眼残留是影响肝母细胞瘤预后的重要因素,但镜下肿瘤残留对预后的影响还存在争议[17]。最近,SIOPEL分析了其在2期和3期临床试验中的431例肝母细胞瘤病例,发现切缘镜下残留病例无论是肿瘤复发率(6%)还是5年生存率(91%)均与切缘阴性病例相似(复发率5%,5年生存率92%),因而认为在以顺铂为基础的化疗中,镜下残留肿瘤并不会影响肝母细胞瘤的最终预后。在本研究中,我们发现紧贴肿瘤进行手术的病例肿瘤复发率高于有一定切缘距离的病例,且5年生存率也低于具有切缘距离的病例。另外,我们的研究中也观察到切缘距离的远近与肿瘤的复发率、生存率无明显相关性。以上结果表明,对于POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤进行肝肿瘤切除时,只要确保一定的切缘距离,就可以减少肿瘤的复发,提高远期生存率。
综上所述,对于POST-TEXT Ⅲ期和Ⅳ期肝母细胞瘤,可根据肿瘤累及的不同部位选择相应术式,在熟练掌握Glisson鞘分离技术并且保证一定切缘的基础上,可取得与肝移植相似的治疗效果。
| 1 |
Aronson DC, Meyers RL. Malignant tumors of the liver in children[J]. Semin Pediatr Surg, 2016, 25(5): 265-275. DOI:10.1053/j.Sempedsurg.2016.09.002.2. |
| 2 |
Yoon HM, Hwang J, Kim KW, et al. Prognostic Factors for Event-Free Survival in Pediatric Patients with Hepatoblastoma Based on the 2017 PRETEXT and CHIC-HS Systems[J]. Cancers (Basel), 2019, 11(9): E1387. DOI:10.3390/cancers11091387. |
| 3 |
Ismail H, Broniszczak D, Kaliciński P, et al. Changing treatment and outcome of children with hepatoblastoma:analysis of a single center experience over the last 20 years[J]. J Pediatr Surg, 2012, 47(7): 133-1339. DOI:10.1016/j.jpedsurg.2011.11.073. |
| 4 |
Lautz TB, Ben-Ami T, Tantemsapya N, et al. Successful nontransplant resection of POSTTEXT Ⅲ and Ⅳ hepatoblastoma[J]. Cancer, 2011, 117(9): 197-183. DOI:10.1002/cncr.25722. |
| 5 |
Fuchs J, Cavdar S, Blumenstock G, et al. POST-TEXT Ⅲ and Ⅳ Hepatoblastoma:Extended Hepatic Resection Avoids Liver Transplantation in Selected Cases[J]. Ann Surg, 2017, 266(2): 318-323. DOI:10.1097/SLA.0000000000001936. |
| 6 |
Perilongo G, Maibach R, Shafford E, et al. Cisplatin versus cisplatin plus doxorubicin for standard-risk hepatoblastoma[J]. N Engl J Med, 2009, 361(17): 1662-1670. DOI:10.1056/NEJMoa0810613. |
| 7 |
Schnater JM, Aronson DC, Plaschkes J, et al. Surgical view of the treatment of patients with hepatoblastoma-Results from the first prospective trial of the International Society of Pediatric Oncology Liver Tumor Study Group (SIOPEL1)[J]. Cancer, 2002, 94(4): 1111-1120. DOI:10.1002/cncr.10282. |
| 8 |
Tajiri T, Kimura O, Fumino S, et al. Surgical strategies for unresectable hepatoblastomas[J]. J Pediatr Surg, 2012, 47(12): 2194-2198. DOI:10.1016/j.jpedsurg.2012.09.006. |
| 9 |
金晟, 施诚仁. 儿童肝母细胞瘤研究现状[J]. 临床儿科杂志, 2014, 32(10): 988-992. DOI:10.3969/j.issn.1000-3606.2014.10.31. Jin S, Shi CR. Current research of hepatoblastoma in children[J]. J Clin Pediatr, 2014, 32(10): 988-992. DOI:10.3969/j.issn.1000-3606.2014.10.31. |
| 10 |
Zsíros J, Maibach R, Shafford E, et al. Successful treatment of childhood high-risk hepatoblastoma with dose-intensive multiagent chemotherapy and surgery:final results of the SIOPEL-3HR study[J]. J Clin Oncol, 2010, 28(15): 2584-2590. DOI:10.1200/JCO.2009.22.4857. |
| 11 |
Meyers RL, Tiao G, de Ville de, et al. Hepatoblastoma state of the art:pre-treatment extent of disease, surgical resection guidelines and the role of liver transplantation[J]. Curr Opin Pediatr, 2014, 26(1): 29-36. DOI:10.1097/MOP.0000000000000042. |
| 12 |
Yang T, Whitlock RS, Vasudevan SA. Surgical Management of Hepatoblastoma and Recent Advances[J]. Cancers (Basel), 2019, 11(12): E1944. DOI:10.3390/cancers11121944. |
| 13 |
El-Gendi A, Fadel S, El-Shafei M, et al. Avoiding liver transplantation in post-treatment extent of disease Ⅲ and Ⅳ hepatoblastoma[J]. Pediatr Int, 2018, 60(9): 862-868. DOI:10.1111/ped.13634. |
| 14 |
Wiederkehr JC, Avilla SG, Mattos E, et al. Associating liver partition with portal vein ligation and staged hepatectomy (ALPPS) for the treatment of liver tumors in children[J]. J Pediatr Surg, 2015, 50(7): 1227-1231. DOI:10.1016/j.jpedsurg.2014.10.019. |
| 15 |
袁妙贤, 尹强, 刘朝阳. 肝脏中叶切除术治疗小儿肝脏肿瘤疗效与安全性分析[J]. 临床小儿外科杂志, 2019, 18(10): 859-863. DOI:10.3969/j.issn.1671-6353.2019.10.012. Yuan MX, Yin Q, Liu CY. Experience of mesohepatectomy in the treatment of hepatic tumors in children[J]. J Clin Ped Sur, 2019, 18(10): 859-863. DOI:10.3969/j.issn.1671-6353.2019.10.012. |
| 16 |
Xie KL, Zeng Y, Wu H. Hepatic trisectionectomy for hepatocellular carcinoma using the Glisson pedicle method combined with anterior approach[J]. World J Surg, 2014, 38(9): 2358-2362. DOI:10.1007/s00268-014-2579-y. |
| 17 |
Dicken BJ, Bigam DL, Lees GM. Association between surgical margins and long-term outcome in advanced hepatoblastoma[J]. J Pediatr Surg, 2004, 39(5): 721-725. DOI:10.1016/j.jpedsurg.2004.01.035. |
 2020, Vol. 19
2020, Vol. 19


