炎性肌纤维母细胞瘤(inflammatory myofibroblast tumor, IMT)也曾被称作炎性假瘤,由分化的肌纤维母细胞性梭形细胞组成,是一种伴有大量浆细胞和(或)淋巴细胞的间叶性肿瘤[1]。目前病因尚不明,无特异性症状,可发生于全身任何部位,较多发生于肺部[2]。由于其部位特点,关于儿童腹部IMT的研究较为少见,部分病例难治且易于复发。本研究收集2006—2018年由首都医科大学附属北京儿童医院肿瘤外科收治的18例手术病理确诊为腹部IMT患儿的临床资料,分析与总结其临床表现、实验室检查、影像学检查、病理学诊断、外科治疗方法及预后等情况,旨在提高其诊治水平。
材料与方法 一、研究对象分析2006—2018年由首都医科大学附属北京儿童医院肿瘤外科收治的18例手术病理确诊为腹部IMT患儿的临床资料,其中男童11例,女童7例,发病年龄1~89个月,平均28.4个月,2例病灶为多发,其余病灶为单发。所有病例术前均经超声定位,部分行CT或MRI检查。病灶位于腹膜后者2例及腹部多灶病变者2例予化疗及手术治疗,其余患儿均经单纯手术切除治疗。单纯手术治疗者中8例术中重建消化道,其他6例仅行肿瘤全切术。18例患儿的性别、年龄、首发症状及体征、肿瘤侵犯位置、肿瘤大小、治疗方式、有无复发或转移见表 1。
|
|
表 1 18例患儿临床特征、治疗方式及预后 Table 1 Clinical characteristics, treatments and prognoses of 18 children |
患儿入院诊疗流程及治疗方案见图 1,化疗方案均首选VAC方案(长春新碱、环磷酰胺、放线菌素D)。手术后病理标本均经4%甲醛溶液固定,常规制片,经HE染色及免疫组化标记,由两位病理科医生作出诊断。免疫组化标记物包括平滑肌肌动蛋白(smooth muscle actin, SMA)、波形蛋白(vimentin)、结蛋白(desmin)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)、增殖细胞核抗原(Ki-67)和S-100。

|
Download:
|
| 图 1 炎性肌纤维母细胞瘤诊疗流程 Fig. 1 Diagnosis and treatment of inflammatory myofibroblast tumor | |
术后采用电话及门诊方式随访,复查以超声检查为准。
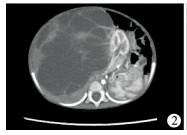
结 果 一、临床表现本研究中IMT起自腹部各部位,18例中全身症状包括小细胞低色素贫血7例(38.9%)及发热6例(33.3%)。2例腹部弥漫病变,分别累及回肠系膜、阑尾、大网膜、结肠肠壁全层、输尿管以及小肠、降结肠、横结肠中段、肝门,其余16例均为单发肿瘤。11例单发病灶发生于消化道及周围系膜,其中发生在回肠系膜者(含回肠)4例,回盲部肠系膜2例,乙状结肠系膜1例,大网膜3例和直肠1例,主要表现有局部包块、肠套叠、排尿困难、排便困难等;2例肿瘤发生在腹膜后间隙,表现为梗阻性黄疸和腹部膨隆;1例发生于胰腺头部,亦导致黄疸;另2例起源于肝脏,分别引起腹部包块和持续发热,具体详见表 1。所有病例无传染病史、风湿疾病史或其他恶性肿瘤治疗史。单发肿瘤体积最小者2.4 cm×2.1 cm×0.9 cm,来源于距离回盲部30 cm小肠处;肿瘤体积最大18 cm×16 cm×8 cm,重1 370 g,来源于腹膜后间隙(图 2)。
|
Download:
|
| 图 2 病例15腹部CT增强图 右侧腹膜后见巨大囊实性占位性病变,边界清晰,CT值为13~33 Hu,增强后瘤灶内实性成分明显强化,囊性成分无强化。瘤灶内可见多发迂曲动脉分支血管影。右肾位于瘤灶左前上方,并肾轴旋转,肾门朝后,右肾动静脉走行于瘤灶左侧缘,肾实质强化尚均匀,皮质连续。腹主动脉受压略向左后移位 Fig. 2 CT-enhanced phase of abdominal mass of No.15 | |
甲胎蛋白(Alpha-fetoprotein,AFP)、神经元特异性希醇化酶(Neuron specific enolase, NSE)等儿童常见实体肿瘤标志物未见异常。18例均行超声检查,12例表现为低回声,占66.6%(12/18),其余为囊实混合回声,边界清楚或不清;12例可见明显丰富血供,占66.6%(12/18),其余血供不明显;15例行CT(含增强)检查,9例可见明显或不均匀增强,占60%(9/15)。2例行MRI平扫检查提示为不规则软组织包块影,并可侵犯周围血管及器官(图 3)。

|
Download:
|
| 图 3 病例16腹部核磁共振平扫图 MRI平扫见上腹部胰腺区偏右不规则软组织包块,侵及肝门,包绕腹腔干及其分支、肠系膜上动静脉及门静脉。肝门部见囊状长T2信号-扩张的胆管不除外,余肝内外胆管未见扩张,胆囊增大、胆囊管扭曲 Fig. 3 Abdominal MRI scan of Case No.16 | |
18例均行开放手术治疗,并清除可疑淋巴结。1例病变位于腹膜后的患儿(No.15)穿刺后于当地确诊为肾母细胞瘤,随即予以长春地辛及表阿霉素化疗,未见明显疗效,遂于我院行肿瘤完整切除术。另1例腹膜后病变的3月龄患儿(No.16)由于手术风险高仅行胆道外引流及活检术,术后按VAC规律化疗(长春新碱、环磷酰胺、放线菌素D)。根据术中肿瘤与消化道及血管的毗邻关系确立是否行消化道重建。所有开放手术中含胰头十二指肠切除术1人次和肠切除吻合术6人次。病变位于直肠者先于当地行肠造瘘术,后于我院行关瘘、肿瘤切除术及肛门直肠成形术。1例腹部弥漫性病变患儿(No.18)于当地及我院共行4次肿瘤肉眼全切及消化道重建术,术后均出现肿瘤复发,共予以10周期的化疗(VAC方案);另1例腹部侵犯多部位IMT患儿(No.17)于当地行开腹活检,后于我院行2次肿瘤肉眼全切及消化道、泌尿系统重建术,术后肿瘤亦复发,继予以6周期的化疗(VAC方案),后家属拒绝治疗。
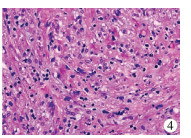
四、病理检查结果术后病理报告均为炎性肌纤维母细胞瘤。大体标本直观表现为实性,质稍韧或软,切面灰白、灰黄或灰粉,局部可呈编织状,腹部多部位IMT可呈结节状。HE染色下可见肿瘤细胞呈短梭形或椭圆形,间质可见多量淋巴组织及浆细胞等炎性浸润,部分可见玻璃样变(图 4)、黏液样变或大片状出血坏死。3例存在区域淋巴结转移,6例肿瘤侵犯肠壁(程度由部分累及至侵犯全层不等)。免疫组化阳性率分别如下:平滑肌肌动蛋白SMA为91.7%,vimentin为83.3%,desmin为72.7%,ALK为54.5%。Ki-67阳性率为3% ~30%,中位数8%,S-100阴性者占87.5%。
|
Download:
|
| 图 4 病例16病理切片镜下图(HE, ×400) Fig. 4 Pathological section of Case No.16 (HE, ×400) | |
1例腹部弥漫IMT的患儿(No.17)出院后家属拒绝治疗并失访,预测存活概率较小;1例腹膜后病变仅行活检及化疗的患儿(No.16)于活检术及化疗后3个月死于消化道感染;其余16例经常规门诊及电话随访4~29个月未见死亡或术后严重并发症发生,其中含1例弥漫腹部IMT病灶患儿(No.18)带瘤存活,但目前放弃治疗,并发现左胸部疑似转移。
讨 论IMT是一种少见的临床表现多样、病因不明的软组织肿瘤,多见于儿童和青年人群[3]。尽管目前普遍认为肺部是IMT最多见的部位,但亦有研究提示儿童腹部IMT在儿童炎性肌纤维母细胞肿瘤(inflammatory myofibroblastic tumors, IMTs)中占比较高[4]。有研究认为该病起因于感染、创伤或手术后的过度炎症反应,亦可能与其他恶性肿瘤或自身免疫性疾病有关[5]。自1939年首次由Brunn等[6]报道以来,该病由于病理表型的多样曾被多次更名为浆细胞肉芽肿、孤立性肥大细胞肉芽肿、炎性纤维肉瘤、炎性假瘤等。直至2002年,世界卫生组织软组织肿瘤国际组织学分类专家组建议将炎性肌纤维母细胞瘤定义为“由分化的肌纤维母细胞性梭形细胞组成的,常伴大量浆细胞和(或)淋巴细胞的一种肿瘤”[1]。
文献报道IMT较多见于男性,本研究结果与之类似[4]。该病临床表现不一,常见临床表现包括不明原因的发热、易疲劳和体重下降。疾病症状大多也与肿瘤所在位置有关,例如原发于肺部者可引起咳嗽、咯血、气短等,原发于腹部可引起腹痛、腹胀、发热及腹部肿块等[7]。本项研究中肿瘤涉及腹部器官较多,含肝脏、胰腺等罕见部位,除发热、贫血、腹部包块等常见症状外,腹部IMT可能引起梗阻性黄疸,排尿、排便困难,甚至继发性肠套叠等罕见症状。因此,当临床上病例出现上述类似体征时,应考虑IMT。IMT体积也因部位而异,腹膜后IMT少见且症状无明显特异性,但由于腹膜后解剖空间较大,因此发生于其中的IMT也往往较大,部分病例难以全切,有时亦可继发患侧肾积水等[8]。
本病缺乏特异性的肿瘤标志物,常见儿童肿瘤标志物如AFP、NSE等往往在正常范围内。术前主要依靠超声、CT和MRI等影像学检查来诊断。超声检查下,IMT可有清楚边界、形态较规则、低回声为主的表现,部分可表现为囊实性回声,血流信号可不丰富[9]。CT及MRI检查常无特异性,CT平扫下多为等或低密度软组织肿块,边界清楚或不清楚,部分内部可见片状低密度坏死区,增强像中肿瘤可均匀或不均匀增强,或仅边缘增强[10]。炎性细胞和纤维组织的组成不同可影响MRI序列的动态增强和信号强度[7]。与之类似,PET/CT中放射性药物FDG的聚集程度亦因肿瘤细胞的生物学组成、炎性细胞比例及活化程度的不同而变化。具有异型细胞核或增殖指数较高的肿瘤对于FDG的摄取较强,而增殖指数低或Ki-67阴性的肿瘤细胞则摄取能力相对较低。这对于原发肿瘤、局部复发和远处转移的风险监测具有重要价值[11]。此外,有研究认为影像学中病变周围及邻近组织出现炎性改变有利于IMT的诊断[12]。
腹部IMT具有自愈倾向,此类情况尤其多见于肝脏病变,观察疗法对于腹部IMT可能有效[13]。但结合国内外文献,开腹手术仍为绝大多数腹部单发IMT的首选且有效的治疗方式,但有个别病例于术后发生感染等并发症而死亡[14]。本研究中所有患儿经开腹手术活检或治疗。说明肿瘤完整切除并酌情行消化道重建在儿童单病灶腹部IMT的治疗中耐受性较好,且不易复发。Stefanie等[15]报道3例IMT术后死亡患儿均由于不完全切除所致,占7.9%,但亦有3例患儿(肿瘤直径 < 5 cm,ALK阴性)存在镜下残留但随访未见进展或复发。本研究中1例来源于腹膜后的IMT患儿死亡,考虑与患儿年龄小、抵抗力差及营养不良有关。本病目前尚无确切的标准化化疗方案,但有文献报道对于无法全切的肿瘤术后化疗可改善预后。对于弥漫性IMT,多结节或不明确的边界往往提示其局部侵袭性强,且复发率约是单发病灶的6倍(35% vs.6%)[16]。对于腹部多部位或弥漫性IMT病变暂无明确治疗方案。Müller等[17]的经验提示术前VCD化疗方案疗效较好。长春新碱、环磷酰胺、阿霉素、5-氟尿嘧啶、顺铂、异环磷酰胺和依托泊苷等药物曾被用于该病的化疗,但效果各异[18]。Inadomi等[19]曾报道1例肠系膜来源、伴胸腹主动脉旁及锁骨上转移的IMT病例,经阿霉素和异环磷酰胺4周期的联合化疗,肿瘤体积缩小50%。Ming等[20]对1例腹膜IMT术后复发并转移者使用表柔比星、达卡巴嗪、多西他赛联合化疗方案,复发病灶未继续进展。此外,大剂量糖皮质激素及非甾体类抗炎药(尤其是环氧化酶Ⅱ抑制剂)也被用于难治及复发性的IMT,这类药物有助于通过3种不同的机制诱导肿瘤性炎性肿块的消退:①抑制血管内皮促生长因子的促增殖作用;②直接抑制内皮细胞的活化、增殖;③抗细胞因子作用[21]。本研究中病例均使用较温和的VAC方案,但其治疗效果不显著,与文献相符,非甾体类药物的疗效有待进一步研究证实。
随着精准治疗的推进,靶向抑制剂等药物可有助于IMT的治疗。约50%的IMT肿瘤携带有染色体2p23上的ALK基因重排。James等[22]通过对比研究发现,难治性的ALK阳性患者经靶向抑制剂克唑替尼治疗后可获得部分缓解,而ALK阴性患者未见好转。Yael等[23]对儿童IMT患者使用克唑替尼治疗后,86%(12/14)的患儿得到了部分缓解或完全缓解,疗效显著。Nagumo等[24]对膀胱IMT患者辅助性使用克唑替尼,使肿瘤缩小,以此为膀胱部分切除赢得了时机。此外,Kentaro等[25]研究膀胱IMT时还首次发现了与ALK相关的新基因融合HNRNPA1-ALK,对于新靶点的发现和疾病的进展研究具有意义。
腹部IMT的诊断完全依靠病理检查。镜下形态主要为梭形的纤维母细胞与肌纤维母细胞混合增生,间质见大量炎细胞弥漫浸润,可见不同程度的玻璃样变及多量细小血管形成的黏液疏松背景。Coffin[26]通过观察将肺外IMT分为3种组织学类型,即:①黏液型,以黏液、血管、炎症细胞为主,类似结节性筋膜炎;②梭形细胞密集型,以梭形细胞为主,夹杂炎症细胞,类似纤维组织细胞瘤;③纤维型,以致密成片的胶原纤维为主,类似瘢痕组织。术后免疫组化结果对明确诊断具有辅助作用。免疫组化中的SMA、vimentin、desmin弥漫或灶性呈阳性,S-100呈阴性对于诊断IMT有意义,本研究中ALK阳性率54.5%,接近于Coffin等[26]报道的56%,亦支持IMT呈ALK阳性倾向发生于儿童及青少年患者。单发病灶者经完整切除后预后较好,且定期复查暂未见复发或新转移灶,但有报道复发多发生于术后1年,且部分病例可在术后9年复发[27]。而本研究中单发病灶切除术后最大随访时间为29个月,不能完全排除远期复发可能,因而需要继续定期随访。
综上,腹部IMT常见于肠系膜,也可来源于肝脏、胰腺、腹膜后等罕见部位,不同部位的病变可能引起不同症状。CT及超声等影像学检查有利于定位和诊断,但目前尚未发现明确的特异性。腹部单发病变大部分可以经手术完整切除治愈,部分结合消化道重建术,整体预后较好,但需要长期随访。对于患有弥漫性腹部病变的难治性病例的综合治疗方案亟待经验积累及进一步研究。
| 1 |
Fletcher CD, Unni KK, Mertens F, et al. World Health Organization Classification of Tumours Pathology and Genetics of Tumours of Soft Tissue and Bone[J]. Lyon:IARC Press, 2002, 33-35. |
| 2 |
Tongue A. Inflammatory Myofibroblastic Tumor[J]. Chin J Clin Oncol, 2007, 69(11): 274-277. DOI:10.4103/0976-237X.91787. |
| 3 |
Shatzel J, Wooten K, Ankola A, et al. Inflammatory myofibroblastic tumor of the mesentery:a clinical dilemma[J]. Int J Clin Oncol, 2012, 17(4): 380-384. DOI:10.1007/s10147-011-0297-0. |
| 4 |
Kube S, Vokuhl C, Dantonello T, et al. Inflammatory myofibroblastic tumors-A retrospective analysis of the Cooperative Weichteilsarkom Studiengruppe[J]. Pediatr Blood Cancer, 2018, 65(6): e27012. DOI:10.1002/pbc.27012. |
| 5 |
Narla LD, Newman B, Spottswood SS, et al. Inflammatory pseudotumor[J]. Radiographics, 2003, 23(10): 719-729. DOI:10.1148/rg.233025073. |
| 6 |
Brunn H. Two interesting benign lung tumors of contradictory histopathology[J]. J Thorac Cardiovasc Surg, 1939, 9: 119-131. DOI:10.1186/1479-5876-9-72. |
| 7 |
祁艳卫, 李杨, 刘伟栋, 等. 小儿腹部炎症性肌纤维母细胞瘤4例[J]. 临床小儿外科杂志, 2015, 14(5): 443-444. DOI:10.3969/j.issn.1671-6353.2015.05.029. Qi YW, Li Y, Liu WD, et al. Abdominal inflammatory myofibroblastoma in children:a report of 4 cases[J]. J Clin Ped Sur, 2015, 14(5): 443-444. DOI:10.3969/j.issn.1671-6353.2015.05.029. |
| 8 |
Wang X, Zhao X, Chin J, et al. Recurrent retroperitoneal inflammatory myofibroblastic tumor:A case report[J]. Oncol Lett, 2016, 12(2): 1535-1538. DOI:10.3892/ol.2016.4767. |
| 9 |
李刚, 解丽梅, 刘守君, 等. 21例炎性肌纤维母细胞瘤的超声表现分析[J]. 生物医学工程与临床, 2014, 18(2): 137-140. DOI:10.13339/j.cnki.sglc.2014.02.008. Li G, Xie LM, Liu SJ, et al. Ultrasound manifestations analysis of inflammatory myofibroblastic tumor:a report of 21 cases[J]. Biomed Eng Clin Med, 2014, 18(2): 137-140. DOI:10.13339/j.cnki.sglc.2014.02.008. |
| 10 |
Bo L, Xu J, Wang J, et al. Computed tomography appearance of inflammatory myofibroblastic tumor in the abdomen:CT features and pathologic correlation[J]. Int J Clin Exp Med, 2015, 8(9): 16745-16755. DOI:10.13339/j.cnki.sglc.2014.02.008. |
| 11 |
Dong A, Wang Y, Dong H, et al. Inflammatory myofibroblastic tumor:FDG PET/CT findings with pathologic correlation[J]. Clin Nucl Med, 2014, 39(2): 113-121. DOI:10.1097/RLU.0b013e3182952caa. |
| 12 |
徐凡, 吴梅, 郭媛, 等. 腹盆部炎性肌纤维母细胞瘤的影像征象及病理分析并文献复习[J]. 磁共振成像, 2015, 6(1): 40-44. DOI:10.3969/j.issn.1674-8034.2015.01.008. Xu F, Wu M, Guo Y, et al. Imaging features and pathological manifestations of inflammatory myoifbroblastic tumor of abdominal-pevic and review of literature[J]. Chin J Magnet Res Imag, 2015, 6(1): 40-44. DOI:10.3969/j.issn.1674-8034.2015.01.008. |
| 13 |
Zhao JJ, Ling JQ, Fang Y, et al. Intra-abdominal inflammatory myofibroblastic tumor:Spontaneous regression[J]. World J Gastroenterol, 2014, 20(37): 13625-13631. DOI:10.3748/wjg.v20.i37.13625. |
| 14 |
Ziadi S. Retroperitoneal inflammatory myofibroblastic tum-or:case report and immunohistochemistry study[J]. World J Oncol, 2010, 1(2): 94. |
| 15 |
Kube S, Vokuhl C, Dantonello T, et al. Inflammatory myofibroblastic tumors-A retrospective analysis of the Cooperative Weichteilsarkom Studiengruppe[J]. Pediatric Blood & Cancer, 2018, 65(6): e27012.. DOI:10.1002/pbc.27012. |
| 16 |
Bertocchini A, Lo ZC, Callea F, et al. Unresectable multifocal omental and peritoneal inflammatory myofibroblastic tumor in a child:revisiting the role of adjuvant therapy[J]. J Ped Sur, 2011, 46(4): e17-e21. DOI:10.1016/j.jpedsurg.2011.01.007. |
| 17 |
Müller C, Bernig T, Barthlen W. Multifocal inflammatory myofibroblastic tumor in the abdomen[J]. J Biom Graph Comput, 2013, 4(1): 42-46. |
| 18 |
Mattei P, Barnaby K. Rapid regression of duodenal inflammatory myofibroblastic tumor after intravenous ketorolac:case report and review of the literature[J]. J Pediatr Surg, 2008, 43(6): 1196-1199. DOI:10.1016/j.jpedsurg.2008.01.012. |
| 19 |
Inadomi K, Kumagai H, Takayoshi K, et al. Successful combination chemotherapy for metastatic inflammatory myofibroblastic tumor:A case report[J]. Oncol Lett, 2015, 10(5): 2981-2985. DOI:10.3892/ol.2015.3708. |
| 20 |
Chen M, Zhang L, Cao G, et al. Partial response to chemotherapy in a patient with retroperitoneal inflammatory myofibroblastic tumor[J]. Mol Clin Oncol, 2016, 5(4): 463-466. DOI:10.3892/mco.2016.967. |
| 21 |
Applebaum H, Kieran MW, Cripe TP, et al. The rationale for nonsteroidal anti-inflammatory drug therapy for inflammatory myofibroblastic tumors:A Children's Oncology Group study[J]. J Pediatr Surg, 2005, 40(6): 999-1003. DOI:10.1016/j.jpedsurg.2005.03.016. |
| 22 |
Butrynski JE, D'Adamo DR, Hornick JL, et al. Crizotinib in ALK-rearranged inflammatory myofibroblastic tumor[J]. N Engl J Med, 2010, 363(18): 1727-1733. DOI:10.1056/NEJMoa1007056. |
| 23 |
Mossã YP, Voss SD, Lim MS, et al. Targeting ALK with crizotinib in pediatric anaplastic large cell lymphoma and inflammatory myofibroblastic tumor:a children's oncology group study[J]. J Clin Oncol, 2017, 35(28): 3215-3221. DOI:10.1200/JCO.2017.73.4830. |
| 24 |
Nagumo Y, Maejima A, Toyoshima Y, et al. Neoadjuvant crizotinib in ALK-rearranged inflammatory myofibroblastic tumor of the urinary bladder:A case report[J]. Int J Surg Case Rep, 2018, 48: 1-4. DOI:10.1016/j.ijscr.2018.04.027. |
| 25 |
Inamura K, Kobayashi M, Nagano H, et al. A novel fusion of HNRNPA1-ALK in inflammatory myofibroblastic tumor of urinary bladder[J]. Hum Pathol, 2017, 69: 96-100. DOI:10.1016/j.humpath.2017.04.022. |
| 26 |
Coffin CM, Hornick JL, Fletcher CD. Inflammatory myofibroblastic tumor:comparison of clinicopathologic, histologic, and immunohistochemical features including ALK expression in atypical and aggressive cases[J]. Am J Surg Pathol, 2007, 31(4): 509-520. DOI:10.1097/01.pas.0000213393.57322.c7. |
| 27 |
Bonnet JP, Basset T, Dijoux D. Abdominal inflammatory myofibroblastic tumors in children:report of an appendiceal case and review of the literature[J]. J Pediatr Sur, 1996, 31(9): 1311-1314. DOI:10.1016/S0022-3468(96)90262-6. |
 2020, Vol. 19
2020, Vol. 19


