2. 郑州市中心医院(河南省郑州市, 450007)
2. Zhengzhou Central Hospital, Zhengzhou 450052, China
先天性尿道下裂、尿道损伤、尿道狭窄等是泌尿外科常见病,其有效解决办法仍然依赖于外科手术治疗,而尿道成形及重建术是其主要的治疗方式。然而,对于长段尿道缺损、尿道狭窄及复杂型尿道损伤的患儿而言,术后出现尿瘘、尿道狭窄等并发症的情况仍然较多[1]。随着组织工程技术的发展,近年来,脂肪干细胞(adipose derived stem cell, ADSCs)和血管内皮细胞(vascular endothelial cell, VEC)分别单独或联合支架材料用来修复尿道的研究报道逐渐增多,并取得了一定效果。本实验拟构建ADSCs联合VEC共培养复合支架材料,初步探讨其在组织工程尿道重建中的应用,以期为今后尿道成形及重建术提供理论依据。
材料与方法 一、实验动物收集新西兰成年雄性大白兔50只,体重2.5~3.0 kg。由河南省动物实验中心提供。
二、仪器与试剂10%水合氯醛(郑州大学第一附属医院试剂科)、优质胎牛血清、DMEM低糖培养基/MEM高糖培养基、PBS缓冲液、F12培养基、胰蛋白酶、EDTA(Gibco公司,USA)、青霉素、链霉素(华北制药集团有限公司)、硫酸庆大霉素(安阳九州药业有限责任公司)、胶原酶Ⅰ(Sigma USA)、98%无水乙醇(上海化学试剂厂)、血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)鼠抗兔单抗、平滑肌肌动蛋白(a-SMA)鼠抗兔单克隆抗体(北京博奥森试剂公司)、超净工作台(苏州安泰空气技术有限公司)、一次性细胞培养瓶(Hyclone公司)、CO2细胞培养箱(SANYO, 日本)、倒置显微镜(LEICA德国)、微量移液枪(Gilson, USA)、人真皮脱细胞基质材料(清源伟业生物科技有限公司)。
三、方法(一)细胞的分离培养
1.脂肪干细胞(ADSCs)的分离培养:取1只雄性成年新西兰白兔,右侧腹股沟区备皮,10%水合氯醛(1 mL/kg)经兔耳缘静脉缓慢推注麻醉白兔,应用络合碘及75%乙醇消毒右侧腹股沟区。在无菌条件下取兔右侧腹股沟区约1.5 cm×2.0 cm大小的皮肤,立即放入4℃低糖DMEM培养基中以作备用。严格缝合创面,每日给予2次青霉素针25万单位肌肉注射,连续注射4 d。将取得的脂肪组织在超净工作台上经过处理后,加入含有Ⅳ型胶原酶的DMEM,在37℃的条件下,通过震荡消化45 min。然后采用等量含有10%胎牛血清的低糖DMEM培养液用来中和胶原酶组织,200目滤网过滤后,按照2 200 r/min离心15~20 min。将离心管底部细胞团接种到10%的低糖DMEM培养基的透气培养瓶中。选择37℃、5%CO2的培养箱进行培养。每2~3 d进行换液。倒置显微镜下观察细胞情况,当原代细胞铺满培养瓶底80%时进行细胞传代培养至第三代。
2.血管内皮细胞的提取、培养及鉴定:取1只雄性成年新西兰白兔无菌环境下获取兔胸主动脉,将动脉管腔内外用PBS缓冲液反复冲洗,目的是将附壁血细胞完全去除,筋膜和多余脂肪剪除后再将血管置入不含血清DMEM培养基器皿中,血管组织经剪刀充分剪碎至约1 mm3大小,将其转移至24孔细胞培养板中,放置于37℃培养箱,约4 h后,见组织块充分紧贴于培养板,再加入含15%胎牛血清的内皮细胞培养基于培养板中,然后将培养板放置于37℃、5%CO2的培养箱进行培养。24 h后将培养基完全更换,清除未贴壁的细胞及杂质,以后每3 d将一半培养基更换为新鲜培养基。约10~14 d后,观察细胞情况,铺满约90%培养瓶底后,用0.25%胰酶-0.02% EDTA消化,按1 : 2传代培养,依次传代培养4周。
3. ADSCs和VEC体外共培养:取第3代ADSCs,浓度2.5×104个/mL和培养4周VECs,浓度2.5×104个/mL,将ADSCs与VECs均匀混合后,按1 : 1比例置入6孔板中进行接触式共培养,每孔加入10%FBS的L-DMEM1.5 mL,每隔1天换液,置于37℃、5%CO2级饱和湿度培养箱中共同培养。倒置显微镜下分别于7 d、14 d观察联合细胞的形态变化。
(二)细胞与材料的复合
1.材料的处理:ADSCs和VEC及二者共培养细胞接种前72 h,在无血清培养的6孔版中浸泡基质材料,更换培养液时间为隔天1次。用移液枪在细胞种植前24 h将6孔板内的培养液吸干,另外再将50 μL血清在材料两侧涂抹均匀后以作备用。
2.细胞接种:将ADSCs及VEC二者共培养细胞用0.02%乙二胺四乙酸+0.25%胰蛋白酶常规消化后,经过1 000 r/min离心5 min,加1 mL完全培养基制成细胞混悬液。在2 cm×2 cm基质材料的黏膜一面均匀滴加制备好的细胞悬液100 μL,将其保存在37℃细胞培养箱4 h。对照组采取同样的方法进行处理。
(三)建立实验动物模型及分组
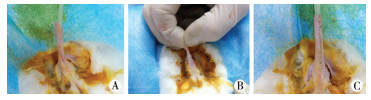
1.建立实验动物模型:将剩余48只实验兔固定后于耳缘静脉注入10%水合氯醛(/kg)进行麻醉。麻醉完成后,取平卧位,会阴区备皮后,常规消毒、铺巾。经尿道外口留置6号双腔导尿管进行导尿,阴茎头处缝牵引线固定尿管(图 1A),配制庆大霉素盐水经尿管外口进行膀胱冲洗。尿管可作为兔子尿道支撑,用尖刀片沿阴茎腹侧中段切开一长约3.0 cm切口,依次切开各层组织,将实验所需局部尿道组织充分游离暴露,眼科剪剪除长约2.0 cm尿道,完成缺损尿道模型的制作(图 1B)。
|
Download:
|
| 图 1 动物模型制作及尿道手术 A:术前固定尿管;B:术前尿道缺损动物模型的制作;C:术后成形尿道外观 Fig. 1 Animal modeling and urethral operative pictures | |
2.对实验动物进行分组:采用随机数字表法将上述48只体重2.0~2.5 kg新西兰成年雄性兔分为4组,每组12只。无细胞对照组为单采用真皮脱细胞基质材料修复组;ADSCs组为复合有ADSCs的脱细胞基质材料修复组;VEC组为复合有VEC的脱细胞基质材料修复组;ADSCs与VEC共培养组为复合有ADSCs和VEC二者共培养细胞的脱细胞基质材料修复组。
(四)尿道修复的手术操作与术后管理
1.尿道修复的手术方法:无细胞对照组将备用的脱细胞基质材料包裹在尿管外表面,修剪边缘使其呈管状结构,然后用6 - 0可吸收缝线缝合材料边缘。将人为形成的尿道缺损端与制成的管状结构进行端端吻合并用6 - 0可吸收缝线进行缝合(图 1C)。检查手术区未见明显活动性出血后,将阴茎腹侧皮下、皮肤组织依次间断缝合。距尿道外口约1.0 cm处将尿管剪断并用缝线将其固定于尿道外口处。为预防伤口感染,手术区域伤口用庆大霉素盐水进行冲洗。ADSCs组将载有ADSCs的基质材料与缺损尿道进行断端吻合后用6 - 0可吸收缝线做缝合,其余手术步骤同无细胞对照组。VEC组将载有VEC的基质材料与缺损尿道进行断端吻合后用6 - 0可吸收缝线做缝合,其余手术步骤同无细胞对照组。ADSCs与VEC共培养组将载有ADSCs和VEC二者共培养细胞的基质材料与缺损尿道进行断端吻合后用6 - 0可吸收缝线做缝合,其余手术步骤同无细胞对照组。
2.实验动物的术后管理:术后每天给实验动物肌肉注射2次50万单位青霉素钠针,手术伤口区域每日给予络合碘进行局部消毒清洗,连续给予庆大霉素冲洗伤口,第14天时观察尿管支撑管情况,并将其拔出。为避免局部伤口污染情况,需要及时清理动物的粪便及周围其余杂物。
(五)术后主要观察项目
1.种子细胞及支架材料观察:ADCSs、VEC及共培养细胞三者各自的形态学及其在培养过程中的生长特征情况。
2.新生尿道标本的观察:术后2、4、8周时对各组重建尿道进行观察,分别从每组中取2只实验动物切取其尿道标本后观察尿道腔面情况。通过尿道标本截面的HE染色观察尿道黏膜上皮再生情况,通过FⅧ、a-SMA免疫组化观察血管内皮细胞及尿道平滑肌细胞再生情况。各组平均血管数目/视野、平均平滑肌数目/视野可于术后8周时在显微镜下观察,并比较各组间有无差别。
3.术后相关并发症的情况:对各组动物在术后8周时观察实验动物排尿情况。使用外力作用于动物下腹部促使其排尿,观察有无尿瘘、尿道狭窄等并发症发生。
四、统计学处理本研究采用SPSS18.0进行统计学处理与分析,对于各组间并发症发生率的比较采用χ2检验;对于各组尿道经过VEGF及a-SMA免疫组化染色阳性指标数目等计量资料采用中位数和四分位数间距[M(P25~P75)]表示,多组间比较采用Kruskal-Wallis检验。以P < 0.05为差异有统计学意义。
结 果 一、ADSCs的形态及生长特征ADSCs的原代细胞在培养时开始贴壁的时间较早,培养2.5 h时即开始贴壁;第2天可见贴壁细胞数量较多,以多角形或小梭形细胞居多,另外还有一些血细胞夹杂在两者之间;第3天时进行换液,未贴壁的细胞被清除后,可见ADSCs存在许多呈多角形或长梭形的突起,其中一些区域可见簇状生长;第4天细胞增殖较迅速,第6~7天时培养瓶底部几乎被细胞铺满,需要进行传代。经传代后脂肪干细胞增殖速度更快,80%培养瓶底面积在3~5 d时间内即可被细胞铺满,细胞密度达到一定程度时,可见其呈现出漩涡状、放射状或平行状,并且排列比较紊乱的情况很少见。第3代ADSCs可见均匀一致,类似于成纤维细胞样形态。
二、VEC的形态及生长特征原代内皮细胞大约16 h开始贴壁,细胞最初分离时形态多为圆形或椭圆形,有着较强的立体感和折光性,呈小团聚集;7 d时可见细胞长满单层,细胞排列较紧密,多角形特别显著。
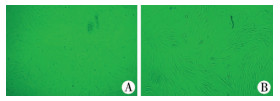
三、共培养细胞的形态及生长特征ADSCs与VEC按1:1进行共培养第1天时,细胞数量之间无明显区别。第2天时,VEC细胞增长速度明显增加,于1~3 d时细胞数量呈对数增长期,3 d后达到平台期。ADSCs在1~5 d时增长速度较明显,5 d时达到平台期。ADSCs长梭形未发生明显变化,且其体积较大;而VEC体积则较小,细胞性状呈鹅卵石状,细胞间生长相互影响,且未见明显细胞排斥及吞噬情况的发生。共培养7 d时部分细胞仍保留原有的梭形,另外一部分细胞形态不同于前者,可呈多角形、巢样分布(图 2A),14 d时可见细胞间存在许多相互连接的突触,并且部分细胞可融合成团块状(图 2B)。
|
Download:
|
| 图 2 共培养细胞镜下观 A:共培养7 d时细胞镜下观(200×);B共培养14 d时细胞镜下观(400×) Fig. 2 Microscopic observation of cell co-culturing | |
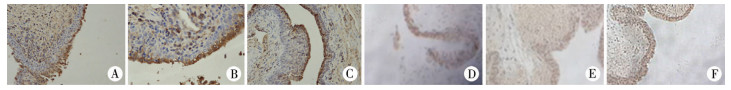
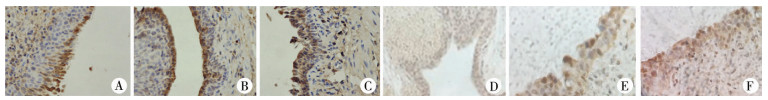
术后1周:各实验组尿道修复区域未完全愈合,无明显伤口感染及切口处缝线脱落情况,尿道修复区域与周围正常皮肤间的界限仍较明显。术后4周:各实验组尿道修复区域已基本愈合,局部缝线可见脱落,尿道修复区域与周围正常皮肤趋向一致。术后4周、8周分别对各组兔子尿道行免疫组织化学染色分析(图 3, 图 4),可见ADSCs与VEC共培养组上皮血管内皮细胞因子(VEGF)、平滑肌肌动蛋白(a-SMA)明显多于无细胞对照组、ADSCs组、VEC组(表 1)。
|
Download:
|
| 图 3 术后第4周尿道组织VEGF和a-SMA染色图 A:术后第4周ADSCs组再造尿道VEGF因子免疫组化检查(200×);B:术后第4周VEC组再造尿道VEGF因子免疫组化检查(200×);C:术后第4周ADSCs与VEC共培养组再造尿道VEGF因子免疫组化检查(200×);D:术后第4周ADSCs组再造尿道a-SMA免疫组化检查(200×);E:术后第4周VEC组再造尿道a-SMA免疫组化检查(200×);F:术后第4周ADSCs与VEC共培养组再造尿道a-SMA免疫组化检查(200×) Fig. 3 VEGF and a-SMA staining of urethral tissue at 4 weeks post-operation | |
|
Download:
|
| 图 4 术后第8周尿道组织VEGF和a-SMA染色图 A:术后第8周ADSCs组再造尿道VEGF因子免疫组化检查(200×);B:术后第8周VEC组再造尿道VEGF因子免疫组化检查(200×);C:术后第8周ADSCs与VEC共培养组再造尿道VEGF因子免疫组化检查(200×);D:术后第8周ADSCs组再造尿道a-SMA免疫组化检查(200×);E:术后第8周VEC组再造尿道a-SMA免疫组化检查(200×);F:术后第8周ADSCs与VEC共培养组再造尿道a-SMA免疫组化检查(200×) Fig. 4 VEGF and a-SMA staining of urethral tissue at 8 weeks post-operation | |
|
|
表 1 术后第8周各组尿道经过VEGF及a-SMA免疫组化染色阳性指标数目(个/HPE) Table 1 Number of VEGF and a-SMA immunohistochemical staining positive indicators in urethra of each group at 8 weeks post-operatio |
术后第8周通过人为使用外力作用于动物下腹部促使其排尿,评估尿道狭窄和尿瘘发生率情况。无细胞对照组动物出现并发症9只(其中尿瘘6只,尿道狭窄3只)。ADSCs组、VEC组和ADSCs与VEC共培养组出现并发症数量分别为5只(其中尿瘘3只,尿道狭窄2只)、4只(其中尿瘘3只,尿道狭窄1只)、2只(其中尿瘘2只)。并发症的发生率ADSCs组41.7%(5/12),VEC组33.3%(4/12),ADSCs与VEC共培养组16.7%(2/12),明显低于无细胞对照组的75%(9/12),差异有统计学意义(χ2=8.914,P<0.05)。进一步两两比较,无细胞对照组与ADSCs与VEC共培养组相比,差异有统计学意义(P < 0.0083)。无细胞对照组与ADSCs组、无细胞对照组与VEC组、ADSCs组与VEC组、ADSCs组与ADSCs与VEC共培养组及VEC组与ADSCs与VEC共培养组比较,差异无统计学意义(P>0.0083), 见表 2。
|
|
表 2 各组术后并发症发生率比较[n(%)] Table 2 Comparing the incidence of postoperative complications in all groups[n(%)] |
尿道下裂的发生随着环境的变化及污染情况的加重而呈现逐渐上升的趋势,其发病率在男性新生儿中可达到3/1 000,且重度尿道下裂所占比例较大[2]。由相关报道可知,在美国每年需要行尿道手术的患儿可达50 000余例[3]。对于复杂尿道损伤和尿道缺损较长的病例,获得足够的组织来进行尿道重建是该类手术成功的关键因素,这成为泌尿外科的难题之一[4]。为解决这一难题,目前采用较多的方法是将自体干细胞种植到脱细胞基质上制成人工尿道,然后再进行尿道修复。到目前为止,研究者把可用的自身组织材料都做了尝试,包括输尿管、动静脉、阑尾等管腔样组织和包皮、颊黏膜、阴囊皮肤、口腔黏膜等上皮样组织[5, 6]。然而,此类方法存在缺点,其进行尿道重建是以损害自体其他部位组织为代价。
组织工程学的出现为尿道修复材料来源的难题提供了一种全新的解决思路[7]。组织工程的研究方法多种多样,但其基本要素是不变的,包括:①培养种子细胞;②制备所需的支架材料;③细胞与支架材料之间相互作用和构建功能性组织[8]。脂肪干细胞来源较广泛、取材方便,并且给病人带来的痛苦比较少。有研究发现在尿道修复时采用接种有种子细胞的基质材料可以产生较为理想的效果,能够降低尿瘘、尿道狭窄等并发症的发生率[9]。脂肪干细胞来源较广泛, 取材方便, 再生能力较强。随着研究的不断深入,ADSCs成功应用于尿道缺损修复, 为组织工程在尿道修复重建中的应用积累了一定经验[10]。血管内皮细胞是一种多功能细胞,位于血管内壁。大量动物实验及临床资料表明,VEC在改善机体缺血部位和损伤部位的血供方面有着得天独厚的优势[11]。另有研究发现血管内皮生长因子在促进内皮细胞增殖和新生血管的增生方面发挥着重要作用,若其缺乏则有可能导致严重的血管畸形和缺失[12]。
共培养体系技术是将两种细胞共同培养,其细胞可来源于不同组织,也可来源于同一组织,组织工程化尿道成功与否取决于新生组织血供情况,而血管内皮细胞在这个过程中所起的作用比较关键。Peichev等[13]将间充质干细胞(mesenchymal stem cells, MSC)和内皮细胞共培养后观察,发现间充质干细胞平滑肌肌动蛋白表达的高低程度与内皮细胞之间有着紧密的联系,与之接触的内皮细胞能促进其增加。脂肪干细胞和血管内皮细胞共培养首先在组织工程骨的研究中取得一定成功,并且积累了一定的经验。研究表明,血管内皮细胞联合培养除了使血管化速度提高之外,还能够促进间充质干细胞分化、增殖[14]。
尿道上皮细胞和平滑肌细胞作为一种成熟细胞,二者的再生能力均欠佳,所以一旦出现缺失的情况,尿道自身很难再自行修复[15]。本研究中,我们将脂肪干细胞和血管内皮细胞采用接触式共培养方式进行培养,7 d时观察部分细胞仍保留原有的梭形,另外一部分细胞形态可呈多角形、巢样分布,14 d时观察细胞间可见许多相互连接的突触,部分细胞可融合成团块状。术后4周时对经过修复的尿道行组织学检查,镜下可见2~3层上皮细胞紊乱地排列在基质表面,平滑肌组织可见位于上皮细胞下。术后8周时可见明显增多的上皮细胞层均匀排列在基质表面,黏膜上皮下可见增多的新生小血管、平滑肌及纤维组织。免疫组化结果显示共培养细胞组在新生小血管和平滑肌细胞再生方面与对照组相比有着明显的优势,并且术后重建尿道组织血管化及上皮化程度、血管数目及平滑肌数逐渐增多并且逐渐规则化,形成的尿道组织与正常尿道组织比较接近。此外,共培养细胞组新生的血管数目较单纯脂肪干细胞组和血管内皮细胞组增多。术后排尿结果提示共培养组的术后并发症发生率明显低于单纯支架组和单一细胞复合支架组。本研究说明应用脂肪干细胞和血管内皮细胞体外共培养联合脱细胞基质材料构建组织工程尿道是可行的。
目前共培养细胞的研究已取得了一定的成就,并且有着广泛的应用前景。但是,共培养细胞之间相关作用的机制以及种植到机体后细胞的存活迁移情况尚未清楚。相信经过科研工作者的不懈努力,细胞共培养技术将会日趋成熟完善,其在组织工程中的应用将会更加广泛。
| 1 |
Atala A, Danilevskiy M, Lyundup A, et al. The potential role of tissue-engineered urethral substitution:clinical and preclinical studies[J]. J Tissue Eng Regen Med, 2017, 11(1): 3-19. DOI:10.1002/term.2112. |
| 2 |
宋鲁杰, 徐月敏, 傅强, 等. 口腔内黏膜尿道成形治疗前尿道狭窄10年经验总结[J]. 中华泌尿外科杂志, 2011, 32(11): 728-731. DOI:10.3760/cma.j.issn.1000-6702.2011.11.003. Song LJ, Xu YM, Fu Q, et al. Oral mucosal grafts urethroplasty for the treatment of anterior urethral strictures:a ten-year clinical experience[J]. Chin J Urol, 2011, 32(11): 728-731. DOI:10.3760/cma.j.issn.1000-6702.2011.11.003. |
| 3 |
李虹, 罗德毅. 尿道修复重建进展[J]. 现代泌尿外科杂志, 2012, 17(1): 6-9. DOI:10.3969/j.issn.1009-8291.2012.01.004. Li H, Luo DY. Recent advances in urethral reconstruction[J]. J Mod Urol, 2012, 17(1): 6-9. DOI:10.3969/j.issn.1009-8291.2012.01.004. |
| 4 |
杨嗣星, 申复进, 王玲珑. 组织工程化尿道研究现状与前景[J]. 中华泌尿外科杂志, 2006, 27(12): 861-863. DOI:10.3760/j:issn:1000-6702.2006.12.020. Yang SX, Shen FJ, Wang LL, et al. Current status and future prospects of tissue engineered urethra[J]. J Chin J Urol, 2006, 27(12): 861-863. DOI:10.3760/j:issn:1000-6702.2006.12.020. |
| 5 |
Feil G, Daum L, Amend B, et al. From tissue engineering to regenerative medicine in urology-the potential and the pitfalls[J]. Adv Drug Deliv Rev, 2011, 63(4-5): 375-378. DOI:10.1016/j.addr.2010.12.003. |
| 6 |
Wood D, Southgate J. Current status of tissue engineering in urology[J]. Curr Opin Urol, 2008, 18(6): 564-569. DOI:10.1097/MOU.0b013e32830f9402. |
| 7 |
Gimble JM, Katz AJ, Bunnell BA. Adipose-derived stem cells for regenerative medicine[J]. Circ Res, 2007, 100(9): 1249-1260. DOI:10.1161/01.RES.0000265074.83288.09. |
| 8 |
徐月敏, 乔勇, 吴登龙, 等. 游离黏膜组织重建尿道治疗复杂性尿道狭窄的临床研究[J]. 中华泌尿外科杂志, 2005, 26(7): 485-487. DOI:10.3760/j:issn:1000-6702.2005.07.016. Xu YM, Qiao Y, Wu DL, et al. Clinical study of one-stage urethroplasty using free mucosa for the treatment of complex urethral stricture,[J]. J Chin J Urol, 2005, 26(7): 485-487. DOI:10.3760/j:issn:1000-6702.2005.07.016. |
| 9 |
Caplan AI. Tissue engineering designs for the future:new logics, old molecules[J]. Tissue Eng, 2000, 6(1): 1-8. DOI:10.1089/107632700320838. |
| 10 |
Newman KD, McBurney MW. Poly(D, L lactic-co-glycolic acid) microspheres as biodegradable microcarriers for pluripotent stem cells[J]. Biomaterials, 2004, 25(26): 5763-5771. DOI:10.1016/j.biomaterials.2004.01.027. |
| 11 |
Mantovani F, Trinchieri A, Castelnuovo C, et al. Reconstructive urethroplasty using porcine acellular matrix[J]. Eur Urol, 2003, 44(5): 600-602. |
| 12 |
韩平, 杨志明, 智伟, 等. 膀胱平滑肌细胞与小肠黏膜下层体外复合培养的实验研究[J]. 中国修复重建外科杂志, 2007, 21(12): 1366-1370. Han P, Yang ZM, Zhi W, et al. Experimental studies on canine bladder smooth muscle cells cultured on acellular small intestinal submucosa in vitro[J]. J Chin J Repair Recon Sur, 2007, 21(12): 1366-1370. |
| 13 |
Sievert KD, Bakircioglu ME, Nunes L, et al. Homologous acellular matrix graft for urethral reconstruction in the rabbit:histological and functional evaluation[J]. J Urol, 2000, 163(6): 1958-1965. |
| 14 |
Fliniaux I, Viallet JP, Dhouailly D, et al. Transformation of amnion epithelium into skin and hair follicles[J]. Differentiation, 2004, 72(9-10): 558-565. DOI:10.1111/j.1432-0436.2004.07209009.x. |
| 15 |
Atala A. Tissue engineering for the replacement of organ function in the genitourinary system[J]. Am J Transplant, 2004, 4(Suppl 6): 58-73. |
 2020, Vol. 19
2020, Vol. 19


