股骨近端是儿童青少年良性骨肿瘤的好发部位之一。良性骨肿瘤,如单纯性骨囊肿、动脉瘤样骨囊肿、非骨化性纤维瘤、骨纤维结构不良等经常发生于该区域[1-2]。肿瘤较小时可无任何临床症状,当肿瘤较大时可出现疼痛、跛行甚至不能行走,容易发生病理性骨折。当骨肿瘤开始进展并累及股骨近端时,需积极手术干预。手术目的在于充分刮除病灶、防止局部复发、恢复骨的完整性和防止继发病理性骨折或畸形[3]。当继发病理性骨折时,需要提供稳定的内固定和(或)外固定。术后容易发生肿瘤复发、骨不连、髋内翻畸形、骺板损伤及股骨头缺血性坏死等并发症[4]。
目前国内外关于儿童股骨近端良性骨肿瘤的治疗方法尚不统一,存在较多争议,包括手术前是否需要单独行组织活检、如何更好地处理病灶、如何合理选择内固定等[5, 6]。本研究回顾性分析浙江大学医学院附属儿童医院2010年1月至2016年12月收治的儿童股骨近端良性骨肿瘤患儿病例资料,收集其临床表现、影像学资料、手术记录及病理检查结果,探讨儿童股骨近端良性骨肿瘤的手术治疗策略。
材料与方法 一、临床资料回顾性分析浙江大学医学院附属儿童医院2010年1月至2016年12月收治的所有儿童股骨近端良性骨肿瘤患儿的临床资料,手术策略基于股骨近端肿瘤的位置、累及范围、初步诊断及骨骼发育成熟程度。肿瘤的位置和累及范围根据股骨正侧位X线片来评估,肿瘤病灶宽度与肿瘤在同一水平股骨近端周径的最大比值为病灶累及百分比。初步诊断基于术前影像学检查及术中发现。骨骼发育成熟程度根据股骨近端X线片上骺板形态及是否闭合来评估。纳入标准:①病灶范围 < 50%合并有症状;②病灶范围>50%;③合并或不合并病理性骨折;④病理检查结果显示为良性骨肿瘤;⑤临床资料完整,随访2年以上。排除标准:①病理检查结果显示为侵袭性肿瘤或恶性肿瘤;②曾于院外接受治疗。
最终本研究纳入21例股骨近端良性骨肿瘤患儿,所有患儿存在临床症状,表现为疼痛、跛行或者不能行走。其中男童13例,女童8例;左侧10例,右侧11例;年龄2岁4个月至13岁1月,平均7.3岁;病理检查结果显示为单纯性骨囊肿9例,动脉瘤样骨囊肿5例,非骨化性纤维瘤3例,骨纤维结构不良4例;合并轻微或明显的病理性骨折12例,占总病例数的57.1%(表 1)。
|
|
表 1 21例股骨近端良性骨肿瘤患儿临床特征 Table 1 Clinical profiles for 21 cases of benign bone lesions of proximal femur in children |
1.术前影像学评估:术前常规行X线、三维CT或MRI检查评估肿瘤的位置、范围、性质及骨骺生长发育情况。根据临床表现和影像学结果做出初步诊断。参考Erol等[7]提出的改良儿童股骨近端良性骨肿瘤分类方法进行分类(图 1)。

|
Download:
|
| 图 1 改良儿童股骨近端良性骨肿瘤分类方法 注Ⅰ型:病灶范围<50%合并有症状,行病灶刮除,瘤腔内植骨术;Ⅱ、Ⅲ、Ⅳ型:病灶范围>50%,行病灶刮除,根据不同类型病灶在植骨前选择不同的内固定;SBCs:单纯性骨囊肿;ABCs:动脉瘤样骨囊肿;NOFs:非骨化性纤维瘤 Fig. 1 Modified classification of benign bone lesions of proximal femur in children | |
2.手术方法: 麻醉显效后,患儿取仰卧位,患侧垫高约30°,采用Watson-Jones入路或Smith-Peterson入路(仅限于高位股骨颈病灶)。术中先取病变组织行快速冰冻病理检查以明确诊断,病变类型明确后手术基本方法有以下2种:①Ⅰ型:病灶范围 < 50%者,行病灶刮除,瘤腔内植骨术。即在病变部位做一超出病灶范围的骨皮质窗,直视下用不同型号刮匙从不同方向搔刮病灶,如病变边缘临近股骨头骨骺,注意避免损伤骨骺,随后用动力磨钻在骨腔内打磨骨嵴,充分冲洗骨腔,以去除全部骨碎屑及肿瘤细胞,刮除范围超过病灶反应区,瘤腔内填塞自体髂骨、磷酸三钙人工骨或混合植骨。②Ⅱ型、Ⅲ型和Ⅳ型:病灶范围>50%,先行病灶刮除,根据不同类型病灶在植骨前选择不同的内固定物,包括弹性髓内针、空心螺钉、克氏针或PHP钢板,对所有单纯性骨囊肿和粗隆间广泛动脉瘤样骨囊肿采用弹性髓内针固定,对非骨化性纤维瘤、骨纤维结构不良和其他部位的动脉瘤样骨囊肿,根据病变的部位采用空心螺钉、克氏针或PHP钢板固定,参考图 1。所有病例未行石碳酸或酒精等辅助性治疗。
3.术后处理:术后予单侧髋人字石膏外固定,术后3周、6周复查X线片观察骨折愈合及病灶愈合情况,术后6周拆除石膏外固定,逐渐下地负重行走。术后1年内每3个月复查1次,1年后每6个月复查1次。术前、术后采用骨骼肌肉肿瘤协会(Musculoskeletal Tumor Society,MSTS)评分标准进行功能评价,术后结果分为4级,优:24~30分,良:18~23分,可:12~17分,差:11分以下[8]。病灶愈合参考Chang等[9]骨病变X线愈合评价标准进行影像学评价(表 2)。
|
|
表 2 股骨近端良性骨肿瘤患儿病灶X线愈合标准 Table 2 Radiographic criteria for patient with benign lesions of proximal femur for lesion healing |
应用SPSS19.0统计软件包进行数据分析,计数资料以百分数(%)表示,计量资料以均数±标准差(x ±s)表示;术前、术后末次随访时MSTS评分比较采用配对样本t检验。以P<0.05为差异有统计学意义。
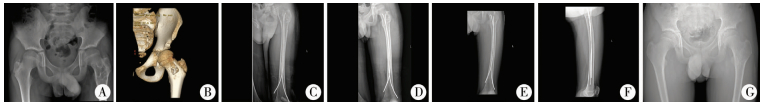
结 果所有病例获随访,随访时间2.0~4.3年,平均2.8年。根据改良Erol分型,Ⅰ型4例,ⅡA型8例,ⅡB型2例,ⅡC型2例,ⅢA型3例,ⅢB型2例;所有患儿股骨近端骺板未闭合,无一例Ⅳ型病例。4例未行内固定治疗,11例使用弹性髓内针固定,2例使用克氏针固定,2例使用空心钉固定,2例使用PHP钢板固定。7例采用自体髂骨和人工骨混合植骨,14例采用人工骨植骨。根据Chang等[9]病灶愈合标准,完全愈合12例(图 2),缺损愈合6例,病变持续存在2例,病理诊断分别为动脉瘤样骨囊肿(病例14)、骨纤维结构不良(病例20),病灶复发1例,病理诊断为单纯性骨囊肿(病例3)。病灶愈合时间4~7个月,平均5.7个月,愈合率85.7%。术前MTST评分3~7分,平均4分;术后MTST评分7~30分,平均27分,与术前相比,差异有统计学意义(t=17.091,P < 0.001)。术后肢体功能:优19例,良1例,差1例。病理性骨折愈合时间6~8周,平均7.2周。术后1例出现髋内翻畸形导致肢体轻度短缩,采用保守治疗。1例出现伤口感染经定期换药和抗炎治疗后恢复。无一例发生骺板损伤、股骨头缺血性坏死或内固定失败。
|
Download:
|
| 图 2 股骨近端良性骨肿瘤患儿手术前后X线及CT图片(病例12,采用弹性髓内针内固定)男,10岁7个月,左股骨近端动脉瘤样骨囊肿,改良Erol ⅡA型。A:术前骨盆正位X线片;B:术前三维CT;C:术后第1天股骨正位片;D:术后第1天股骨侧位片;E:术后第7月股骨正位片,病灶完全愈合;F:术后7个月股骨侧位片;G:术后2年骨盆正位片,未见肿瘤复发 Fig. 2 Radiography before and after surgery for a 127-month old boy with benign bone lesions of proximal femur in left (Case No.12) | |
股骨近端是儿童良性骨肿瘤的好发部位。小而无症状的病灶通常不需要手术干预,可选择密切随访观察。大的或者有症状的病灶,往往伴有进行性浸润或病理性骨折,需积极手术治疗。股骨近端作为人体重要的承重骨,其特殊的解剖位置使肿瘤的处理变得非常棘手。手术治疗既要充分清除病灶防止复发,又要兼顾维持骨的稳定性,同时还要避免骨骺损伤。为了进一步规范儿童股骨近端良性骨肿瘤的治疗,同时观察手术的疗效及并发症,本文从以下几个方面进行讨论。
一、是否需行单独活检切开活检是骨与软组织肿瘤活检的“金标准”,对明确病理类型有重大意义[10]。然而大多数儿童骨良性肿瘤术前影像学检查,包括X线、CT及MRI检查,具有特征性的影像学表现,除一些罕见的类恶性肿瘤侵袭性动脉瘤样骨囊肿以外,多能支持儿童常见良性骨肿瘤的诊断[11]。对怀疑有恶性者,术中病变的大体外观和快速冰冻切片足以做出诊断。因此,在手术前高度怀疑良性骨肿瘤的患儿一般无需单独活检。
二、病灶特点及处理股骨近端范围包括从小段近端股骨干至股骨头,儿童在该部位的良性骨肿瘤多数为囊性病变或纤维性病变,病灶大而深,通常由粗隆下延伸至股骨颈。骨折部位骨皮质菲薄,类似被压碎的蛋壳,容易发生病理性骨折[12]。病灶与正常骨组织边界尚清或病变周围骨性硬化带,尽管骨质破坏明显,但大部分骨膜能保持完整,为骨的重建提供了基础。
据文献报道治疗儿童股骨近端良性骨肿瘤的方法较多,目前还存在争议,尚无一次性根治的方法[3-7]。目前手术方法主要包括:切除重建术和刮除术。切除重建术能够将整个病变骨切除,达到肿瘤彻底清除的效果,但具有损伤骨骺、大出血、大面积骨缺损及术后需长期固定等缺点,主要用于侵袭性良性肿瘤或恶性肿瘤的治疗[13]。刮除术是治疗儿童良性骨肿瘤的常用手段,与切除术相比,刮除术操作简单,能保留良好的肢体功能,但存在局部复发率较高的风险[14]。为了有效地降低刮除术后局部复发的风险,Peeters等[15]在病灶刮除后采用液氮灌注的方法能广泛杀伤肿瘤细胞,显著降低局部肿瘤的复发率,可能与低温冷冻进一步扩大了刮除范围有关,相当于广泛切除,但若有操作不当,可能导致神经损伤等严重并发症。也有学者提出使用苯酚、聚甲基丙烯酸甲酯或热灼术等辅助性治疗方法能降低局部肿瘤的复发率,但在成人中运用较多,且这些材料不容易在手术室获取[16, 17]。鉴于儿童良性骨肿瘤特有的生物学特性和股骨近端独特的骨质结构及力学特点,手术边界的确定和手术方法的选择至关重要。我们认为结合辅助性治疗的广泛灭活并不适合儿童股骨近端,有损伤股骨近端骺板导致骺板早闭、损伤神经及周围软组织等风险,彻底刮除比辅助性治疗更重要,对绝大多数良性骨病变已经足够[18]。本组刮匙病例充分刮除病灶后采用动力磨钻打磨周围骨硬化带扩大至正常骨组织,未行任何辅助性治疗,若病变临近股骨近端骺板,病灶清除时应避免损伤骺板。术后完全愈合12例,缺损愈合6例,本研究中患儿缺损愈合后由于皮质骨相当厚,即使空腔没有完全修复,股骨负重能力和患儿的日常生活也没有受到影响;病变持续存在2例;仅1例单纯性骨囊肿患儿出现复发,占总病例数的4.8%,疗效与国内外文献报道基本一致[15, 19]。
三、骨移植物的选择由于病灶刮除后遗留巨大骨缺损,通常需要大量骨移植物来填充,移植物的填充一方面可以增强骨质强度,另一方面可以减少局部复发风险[20]。目前常用的骨移植物主要有自体骨、同种异体骨和人工骨。自体骨是骨移植的最佳来源,但自体骨来源有限,儿童患者来源更是受到限制,同时增加手术创伤和手术时间[21]。同种异体骨来源不受限制,但有传播疾病、免疫排斥的潜在风险[4]。Roudbari等[22]在比较自体骨和同种异体骨对良性骨肿瘤刮除后填充的临床疗效,发现大部分在术后6个月移植骨完全融入宿主骨,两者最终效果类似。人工骨具有良好的生物相容性、骨传导性及骨诱导性,使用方便并且容易获得。Hirata等[23]报道应用磷酸三钙填充良性骨肿瘤刮除术后的骨缺损,具有安全、无毒、无疾病传播及免疫原性低等优点,同时获得良好的病灶愈合。本组病例中,14例(66.7%)手术中采用磷酸三钙人工骨填充缺损。在年龄较大患儿的治疗过程中,7例(33.3%)采用磷酸三钙骨移植替代物和自体髂骨混合植骨治疗。术后2例出现植骨块部分吸收而病灶持续存在,1例出现植骨块完全吸收而复发,可能与肿瘤本身的生物学行为有关,其余病例均得到满意的病灶愈合。
四、内固定的选择当肿瘤累及股骨近端时常合并病理性骨折,由于周围强大的肌肉牵拉作用,骨折容易移位导致畸形和短缩。因此,需要选择合适的内固定来预防或治疗病理性骨折。儿童股骨近端病理性骨折在内固定装置选择时受到多个因素的限制,包括股骨颈直径的大小、骺板是否闭合、病灶的位置和累及范围等。Dormans等[24]和Erol等[25]首次根据股骨头下骺板远端残留的骨量、股骨近端外侧骨皮质的情况以及骨骼发育成熟的程度,将其治疗分为3大类6个亚型。随后Erol等[7]在此分型的基础上进行了改良,同时考虑病灶的位置和病理诊断,将其分为4大类8个亚型。Ⅰ型:有症状病灶较小,累及范围小于股骨近端周径的50%,手术方法采用刮除植骨术,无需考虑骨骺及病变的位置。Ⅱ型、Ⅲ型、Ⅳ型:病灶累及范围超过股骨近端周径的50%,即将发生或已经发生病理性骨折,病灶刮除植骨后推荐使用内固定。Ⅱ型、Ⅲ型患儿骺板未闭合,其中ⅡA型和ⅢA型病理类型为单纯骨囊肿和广泛的动脉瘤样骨囊肿,病灶分别位于粗隆区和头颈区周围,无论是否存在股骨近端外侧骨皮质或股骨头下骺板远端残留骨量的支撑。ⅡB型为中等大小的动脉瘤样骨囊肿或非骨化性纤维瘤,位于股骨颈基底部的病灶,股骨近端外侧骨皮质和股骨头下骺板远端残留骨量允许空心钉固定。ⅡC型为较大的动脉瘤样骨囊肿或非骨化性纤维瘤位于股骨颈基底部,尽管股骨头下骺板远端尚有足够残留骨量,但股骨近端外侧骨皮质骨量不足,推荐使用动力髋系统固定。ⅢB型为股骨颈有较大的病灶,病理类型为动脉瘤样骨囊肿或非骨化性纤维瘤,股骨头下骺板远端残留骨量不足,需要平行克氏针穿过骺板联合髋人字石膏固定。Ⅳ型骺板即将或已经闭合。ⅣA型包括任何位置的单纯性骨囊肿和广泛的动脉瘤样骨囊肿,这些病灶可以通过髓内固定,如果病灶没有累及粗隆下区,动脉瘤样骨囊肿可以选择动力髋系统固定。ⅣB型病理类型为动脉瘤样骨囊肿或非骨化性纤维瘤,股骨近端外侧骨皮质骨量充足,允许使用空心钉进行固定。本组病例未涉及Ⅳ型病例,在治疗策略选择时进行了一定改良,采用PHP钢板代替动力髋系统固定,亦取得类似的效果,无一例发生骺板损伤、股骨头缺血性坏死或内固定失败。
本研究存在以下不足:①采用回顾性研究,在病例选择方面受到一定限制,存在一定程度的选择偏倚;②病例数量较少,随访时间短,需要更多的病例和随访时间来验证该治疗策略的效果;③研究组病变类型及手术方式存在异质性。因此,总体结果主要显示了对儿童股骨近端良性骨肿瘤常见类型的手术疗效。
儿童股骨近端良性骨肿瘤的手术治疗面临许多困难,由于解剖部位的特殊性,骨折的固定和病灶的清除同等重要,维持骨骼结构长期的稳定能有效避免可能的并发症。应综合考虑肿瘤位置、累及范围、初步诊断及骨骼发育成熟程度,制定个性化的治疗方案,才能有效根治肿瘤,获得满意的功能和影像学结果。
| 1 |
宋得夫, 毕波, 邵景范, 等. OPG及RANKL在小儿单纯性骨囊肿与动脉瘤样骨囊肿中的表达研究[J]. 临床小儿外科杂志, 2015, 14(3): 194-197. DOI:10.3969/j.issn.1671-6353.2015.03.009. Song DG, Bi B, Shao JF, et al. The expression of osteoprotegerin (OPG) and receptor activator nuclear factor κ-B ligand (RANKL) in pediatric bone tumor-like lesions (simple bone cysts and aneurysmal bone cysts)[J]. J Clin Ped Sur, 2015, 14(3): 194-197. DOI:10.3969/j.issn.1671-6353.2015.03.009. |
| 2 |
Canavese F, Samba A, Rousset M. Pathological fractures in children:Diagnosis and treatment options[J]. Orthop Traumatol Surg Res, 2016, 102(1): 149-159. DOI:10.1016/j.otsr.2015.05.010. |
| 3 |
Roposch A, Saraph V, Linhart WE. Treatment of femoral neck and trochanteric simple bone cysts[J]. Arch Orthop Trauma Surg, 2004, 124(7): 437-442. DOI:10.1007/s00402-004-0702-5. |
| 4 |
Jamshidi K, Mirkazemi M, Izanloo AA. Locking plate and fibular strut-graft augmentation in the Reconstruction of unicameral bone cyst of proximal femur in the paediatric population[J]. Int Orthop, 2018, 42(1): 169-174. DOI:10.1007/s00264-017-3648-2. |
| 5 |
Miyamoto W, Takao M, Yasui Y, et al. Endoscopic surgery for symptomatic unicameral bone cyst of the proximal femur[J]. Arthrosc Tech, 2013, 2(4): 467-471. DOI:10.1016/j.eats.2013.07.001. |
| 6 |
Weiss RJ, Ekstrom W, Hansen BH, et al. Pathological subtrochanteric fractures in 194 patients:A comparison of outcome after surgical treatment of pathological and non-pathological fractures[J]. J Surg Oncol, 2013, 107(5): 498-504. DOI:10.1002/jso.23277. |
| 7 |
Erol B, Topkar MO, Aydemir AN, et al. A treatment strategy for proximal femoral benign bone lesions in children and recommended surgical procedures:retrospective analysis of 62 patients[J]. Arch Orthop Trauma Surg, 2016, 136(8): 1051-1061. DOI:10.1007/s00402-016-2486-9. |
| 8 |
Enneking WF, Dunham W, Gebhardt MC, et al. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system[J]. Clin Orthop Relat Res, 1993, 1993(286): 241-246. DOI:10.1007/978-1-4471-5451-8_128. |
| 9 |
Chang CH, Stanton RP, Glutting J, et al. Unicameral bone cysts treated by injection of bone marrow or methylprednisolone[J]. J Bone Joint Surg Br, 2002, 84(3): 407-412. DOI:10.1302/0301-620X.84B3.12115. |
| 10 |
Fritzsche H, Schaser KD, Hofbauer C. Benign tumours and tumour-like lesions of the bone.General treatment principles[J]. Orthopade, 2017, 46(6): 484-497. DOI:10.1007/s00132-017-3429-z. |
| 11 |
Larousserie F, Kreshak J, Gambarotti M, et al. The importance of radiographic imaging in the microscopic assessment of bone tumors[J]. Eur J Radiol, 2013, 82(12): 2100-2114. DOI:10.1016/j.ejrad.2011.11.037. |
| 12 |
Carvallo PI, Griffin AM, Ferguson PC. Salvage of the proximal femur following pathological fractures involving benign bone tumors[J]. J Surg Oncol, 2015, 112(8): 846-852. DOI:10.1002/jso.24072. |
| 13 |
Wijsbek AE, Vazquez-Garcia BL, Grimer RJ, et al. Giant cell tumour of the proximal femur:Is joint-sparing management ever successful[J]. Bone Joint J, 2014, 96B(1): 127-131. DOI:10.1302/0301-620X.96B1.31763. |
| 14 |
Kundu ZS, Gupta V, Sangwan SS, et al. Curettage of benign bone tumors and tumor like lesions:A retrospective analysis[J]. Indian J Orthop, 2013, 47(3): 295-301. DOI:10.4103/0019-5413.111507. |
| 15 |
Peeters SP, Van Der Geest IC, De Rooy JW, et al. Aneurysmal bone cyst:the role of cryosurgery as local adjuvant treatment[J]. J Surg Oncol, 2009, 100(8): 719-724. DOI:10.1002/jso.21410. |
| 16 |
Dürr H, Maier M, Jansson V, et al. Phenol as an adjuvant for local control in the treatment of giant cell tumour of the bone[J]. Eur J Surg Oncol, 1999, 25(6): 610-618. DOI:10.1053/ejso.1999.0716. |
| 17 |
Malek F, Krueger P, Hatmi ZN, et al. Local control of long bone giant cell tumour using curettage, burring and bone grafting without adjuvant therapy[J]. Int Orthop, 2006, 30(6): 495-498. DOI:10.1007/s00264-006-0146-3. |
| 18 |
Wang EH, Marfori ML, Serrano MV, et al. Is curettage and high-speed burring sufficient treatment for aneurysmal bone cysts?[J]. Clin Orthop Relat Res, 2014, 472(11): 3483-3488. DOI:10.1007/s11999-014-3809-1. |
| 19 |
栗向东, 王臻, 郭征. 儿童股骨近端良性骨肿瘤病理骨折的手术治疗[J]. 中国骨肿瘤骨病, 2011, 10(6): 558-562, 585. DOI:10.3969/j.issn.1671-1971.2011.06.006. Li XD, Wang Z, Guo Z. Surgical treatment for children pathological fractures secondary to benign bone tumor of proximal femur[J]. Chin J Bone Tumor & Bone Disease, 2011, 10(6): 558-562, 585. DOI:10.3969/j.issn.1671-1971.2011.06.006. |
| 20 |
Yanagawa T, Watanabe H, Shinozaki TA. Curettage of benign bone tumors without grafts gives sufficient bone strength[J]. Acta Orthop, 2009, 80(1): 9-13. DOI:10.1080/17453670902804604. |
| 21 |
Wang X, Wu X, Xing H, et al. Porous nanohydroxyapatite/collagen scaffolds loading insulin PLGA particles for restoration of critical size bone defect[J]. ACS Appl Mater Interfaces, 2017, 9(13): 11380-11391. DOI:10.1021/acsami.6b13566. |
| 22 |
Roudbari S, Haji Aliloo Sami S, Roudbari M. The clinical results of benign bone tumor treatment with allograft or autograft[J]. Arch Iran Med, 2015, 18(2): 109-13. |
| 23 |
Hirata M, Murata H, Takeshita H. Use of purified beta-tricalcium phosphate for filling defects after curettage of benign bone tumours[J]. Int Orthop, 2006, 30(6): 510-513. DOI:10.1007/s00264-006-0156-1. |
| 24 |
Dormans JP, Pill SG. Fractures through bone cysts:unicameral bone cysts, aneurysmal bone cysts, fibrous cortical defects, and nonossifying fibromas[J]. Instr Course Lect, 2002, 51: 457-467. |
| 25 |
Erol B, Pill SG, Guttenberg ME, et al. Pathologic hip fracture in a 4-year-old boy[J]. Clin Orthop Relat Res, 2002(403): 264-273. DOI:10.1097/00003086-200210000-00038. |
 2020, Vol. 19
2020, Vol. 19


