髓母细胞瘤是儿童时期最常见的恶性脑肿瘤,占儿童中枢神经系统肿瘤的12% ~25%;在 < 15岁的儿童中,年发病率约为5/100 000[1]。一些遗传病(Turcot综合征、Li-Fraumeni综合征、Rubinstein-Taybi综合征)被认为会增加髓母细胞瘤的发病风险,但是大多数病人的病因目前尚不清楚[2]。髓母细胞瘤好发于后颅窝的小脑蚓部及第四脑室,主要临床症状及体征包括:脑积水引起的颅内高压及小脑组织破坏引起的小脑功能障碍。髓母细胞瘤在发病早期易通过脑脊液途径传播转移,肿瘤生长迅速,完全切除困难,总体预后差,病死率高,5年平均生存率在50% ~75%之间[3]。本研究通过分析儿童髓母细胞瘤的临床特点、治疗方法和患者预后关系,探索影响儿童髓母细胞瘤预后相关因素。
材料与方法 一、临床资料收集2004年1月至2014年6月间复旦大学附属儿科医院接受手术治疗且术后病理证实为髓母细胞瘤的病例(典型病理学表现见图 1,可见菊形团、花环样结构)。剔除标准:术后3 d内死亡的病例(因术后3 d内死亡的病例可能和手术操作失误有关,属于住院期间短期死亡的病例,我们研究的病例也未发现3 d内死亡的情况,对本研究结果并无实质性影响)。入组病例共40例。
|
Download:
|
| 图 1 髓母细胞瘤HE染色结果(×200) Fig. 1 HE-stained slide of medulloblastoma (×200) | |
依据2016版WHO中枢神经系统肿瘤分类标准,将入组的40例儿童髓母细胞瘤病理石蜡标本进行组织学分类[4]。统计40例儿童髓母细胞瘤患儿的临床基本资料,包括年龄、性别、肿瘤部位、临床症状的数量、手术切除程度、是否行脑室-腹腔分流术(ventriculoperitoneal shunt, VP)、病理学类型、Chang氏分期[原发灶分期—Tumour(T)分期和转移灶分期—Metastasis(M)分期]、有无放疗/化疗、有无复发等临床指标。本研究中,总体生存时间定义为:自手术日期开始,至随访或死亡截止日期为止,以月为单位进行统计描述。复发由影像学检查(CT、MRI)证实,明确为髓母细胞瘤性质的占位病变即判定为复发。
三、统计学处理采用SPSS19.0进行统计学分析。单因素生存分析采用Kaplan-Meier法统计各组病人的总体生存时间及累计生存率,Log-rank检验比较各组间生存时间及差异,多因素分析采用Cox回归,P < 0.05认为差异有统计学意义。
结 果 一、流行病学特点40例中男29例,女11例,男女性别比2.63 : 1;年龄12个月至13岁,中位年龄为5岁,< 3岁11例,≥3岁29例。
二、临床症状、肿瘤发病部位及病理特征主要临床症状包括头痛、呕吐、共济失调、眼球震颤、颅神经麻痹、头围增大、脑疝、继发性癫痫等,其中18例同时出现两个以上症状。依据Chang氏分期标准,M0期35例,M1~M4期5例,T1~T2期8例,T3~T4期32例[3]。根据影像学资料,中央型髓母细胞瘤(即肿瘤位于小脑蚓部或四脑室)共36例,周围型髓母细胞瘤(即肿瘤位于小脑半球或桥小脑角区)共4例;依据2016版WHO中枢神经系统肿瘤分类标准,各类组织病理学分型所占比例如下:经典型82.5%(33/40),促纤维增生/结节型3%(1/40),大细胞/间变型15%(6/40),未见广泛结节型。
三、治疗手术指征:CT或MR检查证实为颅内肿瘤性病变,并有神经系统表现的病例。放疗指征:①年龄>3岁;②术后病理证实为髓母细胞瘤;③没有严重恶病质。对于标危病例,总放疗剂量为54Gy,其中全脑及脊髓放疗剂量通常为23.4Gy,颅后窝加量30.6Gy。化疗指征:①肿瘤切除术后已经完成放疗;②年龄 < 3岁,无法耐受放疗。放疗期间,患儿接受长春新碱治疗,每周1次,放疗完成后,患儿行长春新碱+顺铂+环磷酰胺化疗方案化疗,治疗8个周期。术中肿瘤达肉眼全切除者35例,次全切除者5例。术后有严重梗阻性脑积水者,行脑室-腹腔分流术21例,进行放疗23例,化疗15例。
四、生存分析 (一) Kaplan-Meier法单因素生存分析40例儿童髓母细胞瘤中死亡27例,死亡原因为肿瘤进展或复发。随访时间6~76个月,中位随访时间50个月。所有病例中,总体生存时间最长76个月,最短3 d,Kaplan-Meier法估计平均生存时间20.8个月,中位生存时间14.0个月。分别以年龄、性别、肿瘤位置、临床症状个数、脑室-腹腔分流术、肿瘤切除程度、组织病理分型、M分期、T分期、术后放疗、术后化疗、肿瘤复发等因素进行分组,并进行单因素生存分析,结果发现性别、年龄、肿瘤位置、是否行脑室-腹腔分流术、肿瘤切除程度、病理分型、T分期等临床因素对于患儿总体生存时间的影响无统计学意义(P>0.05);而临床症状个数、M分期、术后放疗、化疗、肿瘤复发等对于总体生存时间的影响有统计学意义(P<0.05),见表 1。
|
|
表 1 髓母细胞瘤总体生存率影响因素的单因素分析 Table 1 Single-factor analysis of clinicopathological factors for overall survival |
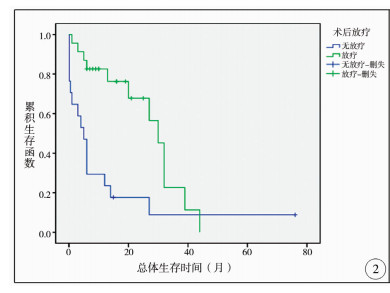
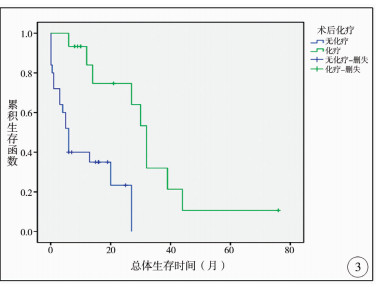
在单因素分析结果中,临床症状个数、M分期、术后放疗、术后化疗、肿瘤复发等因素对患儿总体生存时间有影响,均有显著性差异(P < 0.05)。进一步将上述因素纳入Cox模型中进行多因素分析,以消除各因素间的相互影响,结果发现肿瘤术后接受放疗、化疗是影响患儿总体生存时间的独立保护因素,见表 2、图 2、图 3。
|
|
表 2 多因素Cox回归分析各临床因素与髓母细胞瘤死亡风险的关系 Table 2 Multivariate Cox regression analysis of correlation between clinical factors and mortality risk |
|
Download:
|
| 图 2 髓母细胞瘤手术后放疗及无放疗患儿的生存曲线 Fig. 2 Survival curve of children with and without postoperative radiotherapy | |
|
Download:
|
| 图 3 髓母细胞瘤手术后化疗及无化疗患儿的生存曲线 Fig. 3 Survival curve of children with and without postoperative chemotherapy | |
儿童髓母细胞瘤发病具有一定的年龄和性别倾向[5]。本组病例的发病年龄存在两个高峰,分别为3岁以内和7~8岁之间,这与Quinlan等[6]的报道大致相符,一般认为儿童髓母细胞瘤的发病高峰出现在9岁以内。本研究通过单因素生存分析发现,年龄3岁及以上的儿童总体生存时间长于年龄3岁以下的儿童,虽然差异无统计学意义,但也反应了3岁以下儿童总体预后相对更差的趋势,如扩大样本量,趋势可能会更加明显。国际上大部分研究也将患儿年龄 < 3岁视为高危因素[7-10]。本组患儿性别的构成比与既往研究相似,以男童居多,但本研究未发现性别对于预后的影响具有统计学意义,Weil等[9]认为女性髓母细胞瘤病人的生存时间较男性稍长,具体原因仍不完全明确。儿童髓母细胞瘤以中央型多见,即多位于后颅窝中线的小脑蚓部或第四脑室,发病位置与成人有所不同,这与目前国际上的主流共识相吻合[7-10]。
本研究通过单因素分析发现相关临床症状阳性数>2个的患儿总体生存时间明显短于症状数≤2个的患儿,差异有统计学意义。由于儿童髓母细胞瘤好发于后颅窝中线位置,容易造成脑脊液循环障碍,通常表现为脑积水引起的颅高压及小脑组织破坏引起的功能障碍[11]。其中肿瘤占位引起的神经系统损伤以及颅高压引起的脑疝会直接威胁患儿生命,从发病到手术的时间间隔越长,临床症状也越严重,因此从发现临床症状到进行肿瘤切除手术的时间不能无限期拖延。
本组中,病理组织类型以经典型为主,其次是大细胞/间变型,促纤维增生/结节型所占比例较少,与国外的报道一致,且各类型所占的比例与以往的报道大致相当[6]。但本研究并未发现病理分型与预后存在统计学关联性,以往的相关报道中有学者认为,一般大细胞/间变型预后较差,经典型次之,而促纤维/增生型预后最好[12]。目前已经有充分的证据表明,即使病理分型相同的髓母细胞瘤患儿个体间也会有不同的分子遗传学背景,导致病理分型相同的个体间预后往往存在较大差异。依据病理分型对疾病进行危险分层,其结果的准确性及可靠性不足,这也促进了目前髓母细胞瘤分子分型研究的开展。
目前儿童髓母细胞瘤的肿瘤分期使用的是Chang氏分期系统,包括M分期及T分期,在过去的10年已经证实,M分期较T分期对患儿预后的评估更有效,更能反应疾病的危险程度。本研究通过统计分析发现,M1~M4期患儿预后要差于M0期,而T1~T2期与T3~T4期患儿的预后无统计学差异,再次证实了M分期较T分期对儿童髓母细胞瘤的预后评估可靠性更强,值得推广。
手术对于髓母细胞瘤治疗的重要性不言而喻,目前仍是最主要的治疗手段。手术治疗的优点是多方面的,主要包括:①可以明确病理诊断;②可有效去除肿瘤占位;③重新恢复脑脊液循环。过去的大部分研究认为肿瘤切除程度是影响预后的重要因素[13, 14],但从我们的研究结果来看,肉眼全切肿瘤的患儿预后与次全切除肿瘤的患儿大致相当,两者差异并无统计学意义。术中无法做到肿瘤全切的原因是多方面的,如一些肿瘤组织生长部位特殊,过于靠近脑干或与脑干粘连严重,给术中全切肿瘤带来了极大的困难。粘连严重者在肿瘤剥离过程中容易导致出血或损伤脑干,给患儿生命造成威胁,此时往往无法做到术中全切,因此我们认为肿瘤全切困难,并不建议一味追求全切,目前相关的研究也证实了少量术后残留的肿瘤组织完全可以被术后辅助放疗所杀灭[15]。随着显微手术技术的不断推广,术中操作越来越精细,肿瘤与脑干发生粘连患儿的全切率将越来越高,我院近年来引进了显微手术技术,可以在最大限度保证患儿生命安全及术后功能的前提下做到肿瘤全切,极大提高了手术的成功率。
儿童髓母细胞瘤好发于小脑蚓部及第四脑室,特殊的发病部位导致了绝大部分患儿发病时均存在不同程度脑脊液循环障碍,因此脑积水是儿童髓母细胞瘤发病的一大特点,严重者可发生脑疝,威胁患儿的生命安全。若脑积水严重,在肿瘤切除术前应行脑室-腹腔分流术缓解颅高压症状。然而脑室-腹腔分流术带来的术后并发症不容忽视,由于髓母细胞瘤极易通过脑脊液完成传播及转移,有报道肿瘤细胞可能会沿分流管传播至腹腔等神经系统以外部位,往往会使患儿病情进一步恶化[16, 17]。本研究统计了脑室-腹腔分流术组与单纯手术组的总体生存时间,发现两组间差异并无统计学意义,说明脑室腹腔-分流术虽然可以改善患儿的临床症状,但对于延长患儿总体生存时间并无帮助。
本组单因素分析结果认为,肿瘤复发患儿总体生存时间短于无复发患儿,提示肿瘤复发的病例预后较差,这与目前的共识吻合[18]。髓母细胞瘤传播及转移的途径主要是脑脊液,术后放疗、化疗可以一定程度延缓复发,但总体而言,儿童髓母细胞瘤复发及转移率仍然较高,有研究表明约33%髓母细胞瘤病例在术前即已发生颅内播散和转移,预后并不乐观[19]。
从单因素及多因素分析结果来看,肿瘤的放疗、化疗对于改善预后至关重要。目前国内外大量研究报道均证实了术后放疗、化疗对改善髓母细胞瘤预后的重要性[5]。由于儿童是一个神经发育较为活跃的特殊群体,尤其是婴幼儿,对于放疗及化疗的神经毒副作用耐受较差,放疗和化疗在抑制肿瘤生长的同时,也带来了影响患儿神经系统发育以及导致内分泌功能障碍等一系列问题[20]。随着对髓母细胞瘤治疗研究的进一步深入,部分学者开始提倡基于肿瘤危险分层的个体化的辅助治疗(如对于低危组患儿可以减少放疗及化疗的剂量),这样在不影响肿瘤治疗的前提下,可以最大限度降低因放疗、化疗带来的毒副作用。
| 1 |
Northcott PA, Robinson GW, Kratz CP, et al. Medulloblastoma[J]. Nat Rev Dis Primers, 2019, 5(1): 11. DOI:10.1038/s41572-019-0063-6. |
| 2 |
Ramaswamy V, Remke M, Bouffet E, et al. Risk stratification of childhood medulloblastoma in the molecular era:the current consensus[J]. Acta Neuropathologica, 2016, 131(6): 821-831. DOI:10.1007/s00401-016-1569-6. |
| 3 |
Gerber NU, Mynarek M, Von Hoff K, et al. Recent developments and current concepts in medulloblastoma[J]. Cancer Treatment Reviews, 2014, 40(3): 356-365. DOI:10.1016/j.ctrv.2013.11.010. |
| 4 |
Wen PY, Huse JT. 2016 World Health Organization Classification of Central Nervous System Tumors[J]. CONTINUUM Lifelong Learning in Neurology, 2017, 23(6): 1531-1547. DOI:10.1212/CON.0000000000000536. |
| 5 |
Juraschka K, Taylor MD. Medulloblastoma in the age of molecular subgrouPs:a review[J]. J Neurosurg Pediatr, 2019, 24(4): 353-363. DOI:10.3171/2019.5.PEDS18381. |
| 6 |
Quinlan, Alyssa, Rizzolo, et al. Understanding medulloblastoma[J]. Journal of the American Academy of Physician Assistants, 2017, 30(10): 30-36. DOI:10.1097/01.JAA.0000524717.71084.50. |
| 7 |
Nalita N, Ratanalert S, Kanjanapradit K, et al. Survival and Prognostic Factors in Pediatric Patients with Medulloblastoma in Southern Thailand[J]. J Pediatr Neurosci, 2018, 13(2): 150-157. |
| 8 |
Massimino M, Biassoni V, Gandola L, et al. Childhood me-dulloblastoma[J]. Crit Rev Oncol Hematol, 2016, 105: 35-51. DOI:10.1016/j.critrevonc.2016.05.012. |
| 9 |
Weil MD, Lamborn K, Edwards MS, et al. Influence of a chi-ld's sex on medulloblastoma outcome[J]. Jama the Journal of the American Medical Association, 1998, 279(18): 1474-1476. DOI:10.1001/jama.279.18.1474. |
| 10 |
Sarkar C, Pramanik P, Karak AK, et al. Are childhood and adult medulloblastomas different? A comParative study of clinicoPathological features, Proliferation index and aPoPtotic index[J]. J Neurooncol, 2002, 59(1): 49-61. DOI:10.1023/a:1016357731363. |
| 11 |
Schneider C, Ramaswamy V, Kulkarni AV, et al. Clinical implications of medulloblastoma subgroups:incidence of CSF diversion surgery[J]. J Neurosurg Pediatr, 2015, 15(3): 236-242. DOI:10.3171/2014.9.PEDS14280. |
| 12 |
Archer TC, Mahoney EL, Pomeroy SL. Medulloblastoma:Molecular Classification-Based Personal Therapeutics[J]. Neurotherapeutics, 2017, 14(2): 265-273. DOI:10.1007/s13311-017-0526-y. |
| 13 |
Bokun J, Grujicic D, Skender-Gazibara M, et al. Management and treatment of children with medulloblastoma in Serbia, a middle-income country[J]. J BUON, 2018, 23(4): 1156-1162. |
| 14 |
Khatua S, Song A, Sridhar DC, et al. Childhood Medulloblastoma:Current TheraPies, Emerging Molecular LandscaPe and Newer TheraPeutic Insights[J]. Curr NeuroPharmacol, 2017, 16(7): 1045-1058. DOI:10.2174/1570159X15666171129111324. |
| 15 |
Modha A, Vassilyadi M, George A, et al. Medulloblastoma in children-the Ottawa exPerience[J]. Childs Nerv Syst, 2000, 16(6): 341-350. DOI:10.1007/s003810050529. |
| 16 |
Rickert CH. Abdominal metastases of Pediatric brain tumors via ventriculo-Peritoneal shunts[J]. Childs Nerv Syst, 1998, 14(1-2): 10-14. DOI:10.1007/s003810050166. |
| 17 |
Teklemariam DG, Minyahil A, Yirga L, et al. Treatment of ventriculoperitoneal shunt infection and ventriculitis caused by Acinetobacter baumannii:a case report[J]. Journal of Medical Case Reports, 2018, 12(1): 141. DOI:10.1186/s13256-018-1680-5. |
| 18 |
Nygaard R, Kivivuori SM. Treatment for recurrent medulloblastoma with intrathecal liposomal cytarabine and systemic metronomic combination therapy[J]. Anti-Cancer Drugs, 2012, 23(3): 342-346. DOI:10.1097/cad.0b013e32834ee315. |
| 19 |
Garzia L, Kijima N, Morrissy AS, et al. A Hematogenous Route for Medulloblastoma LePtomeningeal Metastases[J]. Cell, 2018, 173(6): 1549. DOI:10.1016/j.cell.2018.01.038. |
| 20 |
Kiltie AE, Lashford LS, Gattamaneni HR. Survival and late effects in medulloblastoma patients treated with craniospinal irradiation under three years old[J]. Medical and pediatric oncology, 1997, 28(5): 348-354. DOI:10.1002/(sici)1096-911x(199705)28:5<348::aid-mpo4>3.0.co;2-h. |
 2020, Vol. 19
2020, Vol. 19


