2. 湖南省妇幼保健院产科(湖南省长沙市, 410007)
2. Department of Obstetrics and Gynecology, Hunan Maternal and Child Health Hospital, Changsha 410007, China
胎儿肾积水是常见的胎儿泌尿系异常疾病之一,其中肾盂输尿管连接部梗阻(ureteropelvic junction obstruction, UPJO)是胎儿肾积水最常见的病理性原因[1]。产前超声检查是对胎儿肾积水进行筛检的首选检查,通常在孕中期即可检出胎儿肾积水。目前国外大多数学者仍认为在横向平面上测量肾盂前后径(anteroposterior diameter of renal pelvis, APD)是诊断胎儿肾积水的重要指标,并将孕中期APD≥4 mm, 孕晚期APD≥7 mm定义为胎儿肾积水的判定标准[2]。很多研究报道了不同胎龄下区分生理性与病理性肾积水的APD阈值,但关于UPJO患儿出生后行肾盂成形术的APD临界值仍存在争议。本研究旨在分析孕中期、孕晚期及出生后1个月的APD值预测肾积水患儿行肾盂成形术的最佳临界值,并探讨出生前后APD的联合指标对预测患儿行肾盂成形术的价值。
材料与方法 一、一般资料回顾性分析2017年6月至2019年3月湖南省妇幼保健院通过产前超声检出孕中期APD≥4 mm或孕晚期≥7 mm且出生后在湖南省儿童医院门诊行至少1次超声检查的患儿,共435例。所有研究对象出生后1个月内行超声检查无输尿管扩张,出生后患儿均行肾盂成形术,且术后病理检查证实为肾盂输尿管连接部梗阻。排除合并其他泌尿系畸形(膀胱输尿管反流23例、膀胱输尿管囊肿8例、尿道瓣膜3例、先天性肾发育不良11例、巨输尿管4例、重复肾合并肾积水18例、合并肾结石35例、多囊肾1例、马蹄肾1例、异位肾2例、孤立肾积水2例)、检查结果丢失或失访(54例)、孕晚期及出生后首次复查肾积水消失(175例)的病例,最终纳入98例肾积水患儿。
二、研究方法1.影像学检查: ①超声检查:超声检查仪器为法国声科公司生产的Aixplorer Sxc 6 - 1,探头频率3.5 MHz和5.5 MHz,探头在前位及后位沿肾脏纵轴及横轴观察(图 1)。②利尿性肾动态显像:仪器为荷兰飞利浦公司的Skylight,造影剂为99 mTc-DTPA,检查前排空膀胱。经静脉快速注射造影剂,同时给予呋塞米注射(< 1岁1 mg/kg,>1岁0.5 mg/kg,最大剂量40 mg)。通过内置软件计算出肾小球滤过率(glomerular filtration rate, GFR)、分肾功能(differential renal function, DRF)并绘制双肾的肾图曲线。
|
Download:
|
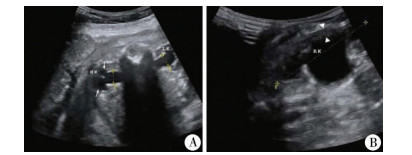
| 图 1 A:孕35周胎儿横切面APD测量声像图; B:出生后20天患儿横切面APD测量声像图 Fig. 1 A:Horizontal cross-section of acoustic image of APD for a fetus with a gestational age of 35 weeks; B:Horizontal cross-section of acoustic image of APD for a neonate with a postnatal age of 20 days | |
2.随访方案:孕中期APD≥4 mm,孕晚期APD≥7 mm可判定为胎儿肾积水。在孕中期发现的肾积水在孕晚期至少复查1次超声。在出生后48 h至1个月进行复查(严重双侧肾积水在出生后48 h内复查),< 1岁每3个月复查1次,1~2岁每半年复查1次,之后每年复查1次,直至连续2次复查结果均显示肾盂扩张消失。需接受手术的患儿术前至少进行1次肾核素扫描检查。手术指征:①临床诊断肾盂输尿管连接部梗阻且分肾功能 < 40%,或随访期间分肾功能下降>10%;②中度至重度肾积水并出现反复泌尿系感染;③多次超声检查均发现APD值呈进行性增加。
三、统计学方法采用SPSS25.0进行统计处理。手术组与非手术组间性别、单双侧、侧别等计数资料采用χ2检验或Fisher精确概率法比较,测量时间和APD等计量资料以(x±s)表示,采用独立样本t检验进行两组间比较。以性别、侧别、孕中期APD值、孕晚期APD值及出生后1个月APD值作为自变量,以是否行肾盂成形术作为因变量,进行多因素Logistic回归分析。采用受试者工作特征(receiver operating characteristic, ROC)曲线对孕中期、孕晚期及出生后1个月APD值预测患儿行肾盂成形术的价值进行评估。以α=0.05为检验水准,P<0.05为差异有统计学意义。
结 果 一、基本情况对98例患儿进行回顾性分析发现孕中期APD≥4 mm共81例(137肾),孕晚期APD≥7 mm共98例(161肾)。故孕中期纳入81例,孕晚期和出生后1个月均纳入98例。98例肾积水患儿中男78例,女20例,单侧积水35例,双侧积水63例。在161个肾单位中,左侧89个,右侧72个。
本研究的中位随访时间为23.7个月(13.4~34.0个月)。在随访期间有36例患儿(40肾)因至少满足一条手术指征而行肾盂成形术,手术干预的中位年龄为7.5个月(1.3~16.5个月)。在36例接受手术治疗的患儿中,双侧肾脏均行肾盂成形术的有4例(11.1%),单侧肾脏手术的有32例(88.9%)。98例胎儿肾积水患儿中,男性约为女性的4倍,但性别与是否手术之间没有关联性。基线资料如表 1所示,可见孕中期、孕晚期及出生后1个月手术组与非手术组间性别、单双侧、侧别和测量时间的差异没有统计学意义(P>0.05),而手术组的APD值比非手术组高,差异具有统计学意义(P < 0.05)。
|
|
表 1 孕中期、孕晚期及出生后1个月手术组与非手术组的基线资料比较 Table 1 Comparison of baseline data between groups in the second trimester, the third trimester and the first postnatal month |
将性别、侧别、孕中期APD值、孕晚期APD值及出生后1个月APD值作为自变量,以是否行肾盂成形术作为因变量行多因素Logistic回归分析,入选标准α入=0.10,剔除标准α出=0.15,选择backward法对自变量进行筛选。结果显示发病后孕中期APD值、孕晚期APD值及出生后1个月APD值均是肾积水患儿行肾盂成形术的危险因素。其中孕中期APD值的OR值为1.329 (95%置信区间:1.160~1.523),孕晚期APD值的OR值为1.233 (95%置信区间:1.141~1.333),出生后1个月APD值的OR值为1.253(95%置信区间:1.134~1.385),详见表 2。
|
|
表 2 胎儿肾积水行肾盂成形术的多因素Logistic回归分析 Table 2 Results of multivariate Logistic regression analysis for predicting pyeloplasty |
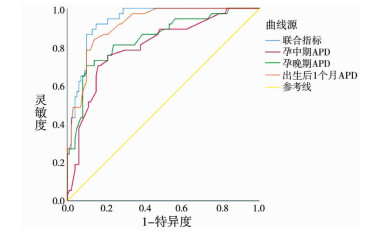
如表 3所示,当孕中期、孕晚期及出生后1个月APD临界值分别为7.5 mm,16.4 mm,15.5 mm时,其约登指数最大,因此认为孕中期APD为7.5 mm、孕晚期APD为16.4 mm或者出生后1个月APD为15.5 mm时为预测肾盂成形手术的最佳临界点。对于孕中期超声检查,最佳预测患儿需要手术的APD临界值为7.5 mm,灵敏度为75.7%,特异度为79.0%,阳性预测值为57.1%,阴性预测值为89.8%,ROC曲线下面积(area under curve,AUC)为0.801。孕晚期APD临界值为16.4 mm时,其灵敏度为70.3%,特异度为90.0%,阳性预测值为72.2%,阴性预测值为89.1%,AUC为0.842。出生后1个月APD临界值为15.5 mm时,其灵敏度为83.8%,特异度为87.0%,阳性预测值为70.5%,阴性预测值为93.5%,AUC为0.915(图 2,表 3)。
|
Download:
|
| 图 2 孕中期、孕晚期及出生后1个月APD值及联合指标预测行肾盂成形术的ROC曲线 Fig. 2 ROC curve for predicting pyeloplasty by APD and combined factors in the second trimester, the third trimester and the first postnatal month | |
|
|
表 3 孕中期、孕晚期、生后1个月及联合指标APD临界值 Table 3 Critical APD values of the second trimester, the third trimester, the first postnatal month and combined indices |
孕中期、孕晚期和出生后1个月APD三者联合得到曲线下面积(AUC=0.936)大于孕中期、孕晚期和出生后1个月单独的APD得到的曲线下面积(AUC分别为0.801、0.842、0.915),表明联合三者对患儿行肾盂成形术的预测价值更高(图 1)。表 3中联合指标的灵敏度均高于孕中期APD、孕晚期APD和出生后1个月APD,但特异度低于孕晚期APD和出生后1个月APD,高于孕中期APD。可将孕中期APD、孕晚期APD和出生后1个月APD视为并联指标,满足孕中期APD>7.5 mm、孕晚期APD>16.4 mm或产后1个月APD>15.5 mm任意一项即可判定为结果阳性。
讨 论随着产前超声检查的普及,在孕17~18周即可早期发现胎儿肾积水,其发病率可达1% ~5%[3, 4]。产前超声诊断为胎儿肾积水提供了早期预警,医生们可以在胎儿出生后的早期阶段对有风险的儿童进行随访,通过早期抗生素干预来预防尿路感染,并尽早发现可能需要手术的患儿,而胎儿肾积水患儿的父母也非常关心他们的孩子出生后是否需要手术干预。针对这些问题,我们系统研究了APD这一超声参数,并将其作为胎儿肾积水患儿出生后是否需要手术的预测因子。很多研究已经针对分辨胎儿肾积水出生后手术的APD临界值进行了报道,其结果也各不相同,但从孕中期开始观察APD值至出生后的研究却相对较少[5]。本研究从孕中期、孕晚期及出生后1个月这三个时期来探讨预测UPJO患儿出生后行肾盂成形术的APD临界值。
很多研究表明,肾盂前后径对胎儿肾积水出生后是否行肾盂成形术具有较好的预测作用[6]。Longpre等[6]认为产后初次超声检查得到的APD值是预测UPJO患儿出生后行肾盂成形术的独立影响因素。还有研究表明,超声检查中APD值的测量可作为早期筛检低复发性梗阻性肾积水儿童的可靠工具,也可作为肾盂成形术后肾功能改善的预测因子[7, 8]。本研究发现孕中期APD值、孕晚期APD值及出生后1个月APD值均是肾积水患儿行肾盂成形术的影响因素。
产前超声检查的胎龄可能会影响APD测量结果的可比性,因为已有证据表明胎龄会影响APD值,也有很多研究报道了不同胎龄下区分生理性与病理性肾积水的APD阈值(诊断阈值)[9-12]。2010年美国胎儿泌尿外科协会在共识中提出,可在产前应用APD值进行肾积水分级,孕中期与孕晚期诊断胎儿是否为先天性肾积水的阈值分别为4 mm和7 mm[2]。目前国内外学者对于不同时期预测胎儿肾积水产后行肾盂成形术的APD临界值尚存在争议。本研究发现孕中期分辨肾积水患儿产后行肾盂成形术的APD最佳临界值为7.5 mm(AUC=0.801,灵敏度为75.7%,特异度为79.0%,约登指数为54.7%)。孕晚期、产后1个月APD分辨肾积水患儿产后行肾盂成形术的最佳临界值分别为16.4 mm和15.5 mm(AUC分别为0.842和0.915,灵敏度分别为70.3%和83.8%,特异度分别为90.0%和87.0%,约登指数分别为60.3%和69.8%),这与Kiener[10]的观点基本一致,他们提出孕中期APD是预测产后手术风险的理想参数,妊娠中期预测胎儿肾积水产后手术的APD最佳临界值为8.3 mm,其灵敏度为78%,特异度为86%;妊娠晚期预测胎儿肾积水产后手术的APD最佳临界值为11.7 mm,其灵敏度为79%,特异度为66%。Dias[13]对312例UPJO患儿进行随访,发现胎儿期APD的临界值为18 mm,出生后APD的临界值为16 mm时对预测手术具有最佳的诊断比值比,这与本研究结果基本一致。对于任何孕中期产前诊断为肾积水的患者都应该进行密切的产后随访,即使在妊娠晚期肾盂分离消失,产后也要进行随访[14]。如果进行有计划的产前超声检查,则可以将本研究收集到的信息应用于UPJO患儿产后手术可能性的预测,并向患儿父母提供咨询。
本研究还结合了孕中期、孕晚期和出生后的APD值对肾盂成形术判断的准确性进行预测,结果表明,如果孕中期APD值为7.5 mm、孕晚期APD值为16.4 mm或产后1个月APD值为15.5 mm时,其对应的灵敏度为91.9%,特异度为85.0%,AUC为0.936。联合指标灵敏度高于孕中期、孕晚期和出生后1个月APD值,特异度低于孕晚期和产后1个月APD值,但高于孕中期APD值。李慧丽等[15]研究发现孕晚期及出生后1周预测行肾盂成形术的APD临界值分别为19 mm和19 mm,其联合指标的AUC、灵敏度、特异度分别为0.84、89%和34%,可见其联合指标的灵敏度及特异度均高于孕晚期及出生后1周的APD值。Dias等[13]提出如果胎儿期APD < 18 mm且出生后APD < 16 mm则诊断为阴性,灵敏度将提高至100%,特异度为56.8%。然而,考虑到严重UPJO的患病率很低,阴性预测值为100%(95%置信区间:97.8% ~100.0%),而阳性预测值仅17%(95%置信区间:11.2% ~23.8%)。而本研究考虑孕中期、孕晚期和产后1个月APD值为并联诊断,满足一个指标阳性即考虑患儿需要手术治疗。Fischer等[16]研究表明,当胎儿和出生后APD值低于临界值时行肾盂成形术没有很大的必要。本研究161个肾单位中,满足孕中期APD≥7.5 mm,孕晚期APD≥16.4 mm和出生后1个月≥15.5 mm的肾单位有25个,其中非手术组5个,手术组20个。因此,我们也不建议对所有孕中期、孕晚期和出生后1个月APD值>7.5 mm、16.4 mm和15.5 mm的患儿都进行手术,本研究结果更多是为临床医生基于APD值定制胎儿肾积水患者出生后随访和管理工作提供参考依据。
胎儿肾积水产后预后相关因素的研究是国内外小儿泌尿外科医师讨论的热点。自Ransley等[17]开展研究以来,UPJO的手术适应证一直存在争议。虽然采用APD值预测UPJO患儿是否手术简便易行,但决定患儿是否需要手术除考虑APD值外,还应考虑肾盏扩张程度、肾实质厚度、SFU分级、GFR、分肾功能等[18, 19]。如果将这些指标结合起来,则对胎儿肾积水预后的预测将更加敏感。此外,我们的研究人群均来自湖南省妇幼保健院,出生后部分轻度肾积水的患儿没有来我院就诊,因此观察到的胎儿肾积水可能包含更多中重度肾积水病例,这导致了本研究结果中较高的手术干预率。后续可以考虑对前瞻性设计的研究进行精确计划的产前超声扫描,并在较大的人群中进行产后随访研究和外部验证。
| 1 |
Sinha A, Bagga A, Krishna A, et al. Revised guidelines on management of antenatal hydronephrosis[J]. Indian Pediatrics, 2013, 50(2): 215-231. DOI:10.1007/s13312-013-0064-6. |
| 2 |
Nguyen HT, Herndon CD, Cooper C, et al. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis[J]. J Pediatr Urol, 2010, 6(3): 212-231. DOI:10.1016/j.jpurol.2010.02.205. |
| 3 |
谢谨谨, 袁继炎, 周学锋, 等. 新生儿重度肾积水的手术治疗及疗效观察[J]. 中华小儿外科杂志, 2010, 31(4): 241-244. DOI:10.3760/cma.j.issn.0253-3006.2010.04.001. Xie JJ, Yuan JY, Zhou XF, et al. Operative management and therapeutic efficacies of severe neonatal hydronephrosis[J]. Clin J Pediatr Surg, 2010, 31(4): 241-244. DOI:10.3760/cma.j.issn.0253-3006.2010.04.001. |
| 4 |
Nguyen HT, Herndon CDA, Cooper C, et al. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis[J]. J Pediatr Urol, 2010, 6(3): 0-231. DOI:10.1016/j.jpurol.2010.02.205. |
| 5 |
Zhang L, Li Y, Liu C, et al. Diagnostic value of anteroposterior diameter of renal pelvis for predicting postnatal surgery:a systematic review and meta-analysis[J]. J Urol, 2018, 200(6): 1346-1353. DOI:10.1016/j.juro.2018.06.064. |
| 6 |
Longpre M, Nguan A, Macneily AE, et al. Prediction of the outcome of antenatally diagnosed hydronephrosis:a multivariable analysis[J]. J Pediatr Urol, 2012, 8(2): 135-139. DOI:10.1016/j.jpurol.2011.05.013. |
| 7 |
Chipde SS, Lal H, Gambhir S, et al. Factors predicting improvement of renal function after pyeloplasty in pediatric patients:a prospective study[J]. J Urol, 2012, 188(1): 262-265. DOI:10.1016/j.juro.2012.03.023. |
| 8 |
Romao RLP, Farhat WA, Pippi Salle JL, et al. Early postoperative ultrasound after open pyeloplasty in children with prenatal hydronephrosis helps identify low risk of recurrent obstruction[J]. J Urol, 2012, 188(6): 2347-2353. DOI:10.1016/j.juro.2012.08.036. |
| 9 |
Odibo AO, Marchiano D, Quinones JN, et al. Mild pyelectasis:evaluating the relationship between gestational age and renal pelvic anterior-posterior diameter[J]. Prenat Diagn, 2003, 23(10): 824-827. DOI:10.1002/pd.709. |
| 10 |
Kiener TA, Wohlmuth C, Schimke C, et al. Ultrasound markers in fetal hydronephrosis to predict postnatal surgery[J]. Ultraschall Med, 2018. DOI:10.1055/a-0591-3303. |
| 11 |
Plevani C, Locatelli A, Paterlini G, et al. Fetal hydronephrosis:natural history and risk factors for postnatal surgery[J]. J Perinat Med, 2014, 42(3): 385-391. DOI:10.1515/jpm-2013-0146. |
| 12 |
Coplen DE, Austin PF, Yan Y, et al. The magnitude of fetal renal pelvic dilatation can identify obstructive postnatal hydronephrosis, and direct postnatal evaluation and management[J]. J Urol, 2006, 176(2): 724-727. DOI:10.1016/j.juro.2006.03.079. |
| 13 |
Dias CS, Silva JM, Pereira AK, et al. Diagnostic accuracy of renal pelvic dilatation for detecting surgically managed ureteropelvic junction obstruction[J]. J Urol, 2013, 190(2): 661-666. DOI:10.1016/j.juro.2013.02.014. |
| 14 |
Morin L, Cendron M, Crombleholme TM, et al. Minimal hydronephrosis in the fetus:clinical significance and implications for management[J]. J Urol, 1996, 155(6): 2047-2049. DOI:10.1016/S0022-5347(01)66102-0. |
| 15 |
刘慧丽, 刘鑫, 殷晓鸣, 等. 肾盂前后径与胎儿肾积水预后的相关性研究[J]. 临床小儿外科杂志, 2018, 17(6): 412-418. DOI:10.3969/j.issn.1671-6353.2018.06.004. Liu HL, Liu X, Yin XM, et al. Correlation between anteroposterior renal pelvic diameter and outcomes of fetal hydronephrosis[J]. J Clin Ped Sur, 2018, 17(6): 412-418. DOI:10.3969/j.issn.1671-6353.2018.06.004. |
| 16 |
Fischer JE, Bachmann LM, Jaeschke R. A readers" guide to the interpretation of diagnostic test properties:clinical example of sepsis[J]. Intensive Care Medicine, 2003, 29(7): 1043-1051. DOI:10.1007/s00134-003-1761-8. |
| 17 |
Ransley PG, Dhillon HK, Gordon I, et al. The postnatal management of hydronephrosis diagnosed by prenatal ultrasound[J]. J Urol, 1990, 144(2): 584-587. DOI:10.1016/s0022-5347(17)39528-9. |
| 18 |
Bassanese G, Travan L, D'Ottavio, et al. Prenatal anteroposterior pelvic diameter cutoffs for postnatal referral for isolated pyelectasis and hydronephrosis:more is not always better[J]. J Urol, 2013, 190(5): 1858-1863. DOI:10.1016/j.juro.2013.05.038. |
| 19 |
Hellstrom WJG, Kogan BA, Jeffrey RB, et al. The natural history of prenatal hydronephrosis with normal amounts of amniotic fluid[J]. J Urol, 1984, 132(5): 947-950. DOI:10.1111/j.1464-410X.1984.tb06161.x. |
 2020, Vol. 19
2020, Vol. 19


