2. 复旦大学附属儿科医院小儿泌尿外科(上海市, 201102);
3. 上海市儿童医院小儿泌尿外科(上海市, 200040);
4. 首都医科大学附属北京儿童医院小儿泌尿外科(北京市, 100045)
2. Department of Pediatric Urology, Children's Hospital of Fudan University, Shanghai 201102, China;
3. Department of Pediatric Urology, Children's Hospital of Shanghai, Shanghai 200040, China;
4. Department of Pediatric Urology, Affiliated Beijing Children's Hospital, Capital Medical University, Beijing 100045, China
先天性肾盂输尿管连接部梗阻(ureteropelvic junction obstruction,UPJO)是引起小儿肾积水常见的泌尿系畸形之一[1]。因尿液从肾盂到近端输尿管流出障碍会出现集合系统扩张,最终可能导致肾功能受损[2]。虽然部分肾盂输尿管交界处梗阻可自行缓解,但仍有部分UPJO患儿会出现肾功能恶化,需要手术治疗,且手术治疗并不能使所有肾脏功能恢复正常[3, 4]。Anderson-Hynes术式是治疗UPJO的标准术式,可有效解除梗阻并且改善肾脏功能。目前SFU Ⅳ度积水、患肾分肾功能(split renal function,SRF)<40%且符合梗阻曲线特征可作为公认的手术指征[5]。此外,SFU Ⅳ度积水,患肾SRF>40%且符合梗阻曲线特征,在观察过程中肾积水加重或出现泌尿系感染、结石、腰腹痛等临床症状时亦建议进行手术治疗[6]。目前,SFU Ⅳ度积水在上述不同手术指征下行手术治疗的预后情况仍不十分清楚,为比较SFU Ⅳ度UPJO术前不同SRF术后预后情况,更好地在术前给予患儿家长相关指导,我们进行了此项多中心回顾性队列研究。
材料与方法 一、研究对象回顾性分析2016年1月1日至2018年12月31日在中国四个儿童临床医学中心(中国医科大学附属盛京医院,复旦大学附属儿科医院,上海市儿童医院,首都医科大学附属北京儿童医院)接受Anderson-Hynes手术治疗的单侧SFU Ⅳ度UPJO患儿的临床资料。本研究通过伦理委员会审批(编号:2018PS486K)。纳入标准:①术前1个月内超声检查发现单侧SFU Ⅳ度UPJO所致肾积水并行Anderson-Hynes手术治疗;②术前1个月内及术后半年需要行泌尿系超声及利尿肾图检查;③术后随访时间>6个月;④年龄 < 14岁。排除标准:肾脏发育不良、输尿管扩张、孤立肾、重复肾等肾脏异常及术后缺少肾核素检查结果。
二、手术指征及手术方式手术指征:①SFU Ⅳ度UPJO,有梗阻肾表现;②SFU Ⅳ度积水随访过程中积水程度加重(肾盂前后径增加5 mm以上),或SRF下降超过10%;③出现腰痛、腹部包块、结石和发热性泌尿系感染等症状。手术治疗均采用Anderson-Hynes术式,选择开放或腹腔镜手术治疗由手术医生与患儿监护人共同决定。Anderson-Hynes手术成功的判定标准:术后肾积水程度减轻,没有再出现肾积水相关临床症状。如术后患儿积水不缓解或出现腰痛等肾积水相关症状则考虑再次行手术治疗,选择行双J管置入或再行Anderson-Hynes手术治疗由患儿家长和医生共同决定,如行双J管置入治疗失败则行Anderson-Hynes手术治疗。
三、倾向性得分匹配采用倾向性得分匹配的方法使术前SRF<40%和SRF≥40%两组术前基线资料均衡,对术前性别、侧别、手术年龄、术前肾盂分离前后径(anteroposterior diameter, APD)值及手术方式进行倾向性匹配。两组间1 : 1匹配,卡钳值为0.02。
四、术前检查、术后随访及数据收集所有患儿术前1个月内行超声及利尿核素检查。术后半年行超声检查,并建议患儿行利尿核素检查,但最终是否行利尿核素检查由患儿监护人决定。之后每半年随访超声1次,如超声提示积水加重则再次行利尿肾核素检查。肾脏核素显像检查所使用的显影剂为DTPA或EC。如果术后半年超声和利尿肾图信息共同缺失则定义为失访。
对患儿的人口学资料(性别、手术年龄),术前数据(侧别、术前肾盂前后径),手术方式(腹腔镜手术或开放手术),术后资料(术后SRF、术后SRF改变程度、术后SRF是否≥45%、术后APD值、术后APD值改变及是否需要再次行手术)进行统计分析。术后患肾SRF≥45%定义为术后患肾SRF正常[7, 8]。所有患儿按照术前患肾SRF分为两组(SRF≥40%组和SRF<40%组)。
五、统计学方法采用SPSS23.0进行统计分析。符合正态分布的连续变量用(x±s)表示,非正态分布的连续变量用M(P25, P75)表示,分类变量用频数、百分比表示。两组符合正态分布的连续变量的比较采用独立样本t检验,两组不符合正态分布的连续变量比较采用Mann-Whitney U检验。分类变量采用Pearson卡方检验或Fisher精确检验进行比较。P < 0.05认为差异具有统计学意义。
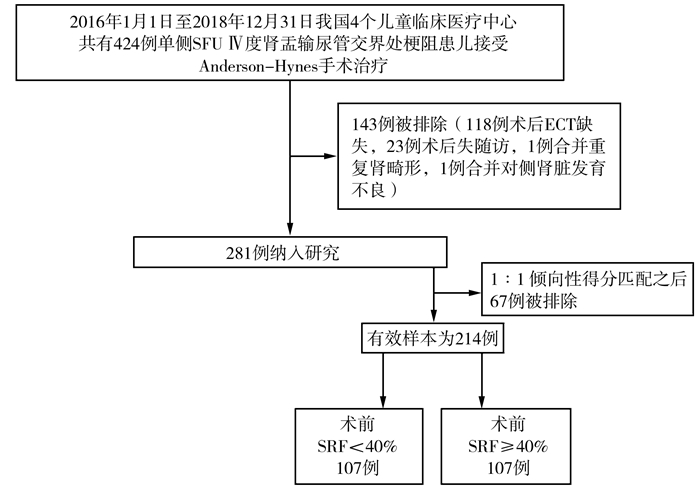
结 果如图 1所示,2016年1月1日至2018年12月31日在中国四个儿童临床中心行Anderson-Hynes手术治疗的单侧SFU Ⅳ度UPJO患儿共424例,其中中国医科大学附属盛京医院198例,复旦大学附属儿科医院137例,上海市儿童医院57例,首都医科大学附属北京儿童医院32例。424例中143例因不符合纳入标准被排除(118例患儿术后利尿肾图检查缺失,23例失访,1例合并重复肾畸形,1例合并对侧肾脏发育不良),故最终纳入281例进行分析。术前患肾SRF<40%组153例,SRF≥40%组128例。
|
Download:
|
| 图 1 研究流程图 Fig. 1 Flow chart | |
行倾向性得分匹配之前,两组术前情况及手术方式等变量中有3个存在统计学差异(表 1),分别为性别、手术年龄及术前APD值。为保证研究结果的可比性,在正式分组前通过倾向性得分匹配使两组间术前情况及手术方式等所有对观察终点可能产生潜在影响的变量无统计学差异,最终得到107对患儿,每组107例。
|
|
表 1 行倾向性得分匹配前后不同SRF组人口学、术前APD值及手术方式资料 Table 1 Demographic profiles, preoperative data and surgical approaches |
行倾向性得分匹配后,在术前SRF<40%组和SRF≥40%组中,男性、左侧UPJO和开放手术占多数(82.2% vs. 84.1%,P=0.715;79.4% vs. 74.8%,P=0.416;56.1% vs. 59.8%, P=0.580)。中位手术年龄分别为7个月和11个月,中位术前APD值分别为29.1 mm和31.0 mm,详见表 1。
术前SRF≥40%组与SRF<40%组相比,术后半年SRF更好(48.8% vs. 42.1%, P<0.001),术后SRF恢复正常的比例更高(75.7% vs. 35.5%,P<0.001), 但术后半年SRF恢复程度较低(1.6% vs. 9.0%,P<0.001)。而两组间APD值恢复程度(14.9 mm vs. 14.3 mm, P=0.564)、术后APD值(15.1 mm vs. 12.4 mm, P=0.153)及再手术率(2.8% vs. 6.5%, P=0.195)比较无统计学意义,详见表 2。
|
|
表 2 行倾向性得分匹配前后不同SRF组术后相关资料 Table 2 Data of different SRF groups before and after line propensity matching |
目前Anderson-Hynes手术是治疗UPJO的公认术式,对于术前患肾SRF下降的患儿,术后患肾SRF多有所恢复,但并非所有患儿术后患肾分肾功均能够恢复至正常水平。目前SFU Ⅳ度UPJO患儿在术前不同SRF下行手术治疗是可行的,但是哪种情况下预后更好目前仍存在争议,且目前的研究多为回顾性、小样本和单中心临床研究(尤其在中国人群中),所以我们在中国人群中开展了本次多中心临床研究。
对于肾积水患儿,肾脏功能的恢复是所有临床医生关注的重点。通过本次研究我们发现,术前SRF≥40%组与SRF<40%组相比术后半年中位SRF更高,术后SRF恢复正常患儿的比例更高,但术后半年SRF恢复较差。有学者发现,用SRF作为手术指征,肾脏功能损伤严重的情况下术后SRF仍无法恢复至正常[9]。此外还有学者发现,术前患肾SRF较低的患儿术后患肾SRF有更大的恢复空间,但术前患肾SRF较高的患儿术后患肾SRF更容易恢复至正常水平[6, 10-12]。这可能是因为术前患肾SRF较高患儿其肾脏病理改变较轻[13]。但也有部分学者的观点与我们不一致,如Ulman等[3]对104例单侧重度肾积水新生儿进行长达10年的随访,其中14例SRF<40%,未行手术治疗随访观察18个月,这些中位SRF值增加至47%。这可能是由于样本量较小,出现选择性偏倚所致。
行倾向性得分匹配之前,术前SRF<40%组患儿术后APD值的恢复更好,但术后APD值两组间无统计学差异。行倾向性得分匹配之后,两组间APD值恢复以及术后APD值无统计学差异。APD值是术前评估肾积水程度以及术后随访常用的超声指标[14]。Helmy等[15]研究发现APD可以预测术后患肾SRF恢复。但是也有学者认为APD并不能作为术后患肾SRF恢复的预测因素,并且认为APD值作为一个客观指标,只是反应肾积水的代偿情况,并不能反应积水对肾实质的压迫[11]。此外,APD同样不能反应肾实质的厚度和肾盏扩张情况,所以APD值并不能全面、客观评估肾积水的严重程度。本研究中我们发现术前SRF≥40%组术后SRF更好,但是术前SRF<40%组SRF恢复正常水平的比例更高,两组间术后APD值以及APD值恢复情况无统计学差异,这说明APD值并不能反映肾脏功能变化。
Anderson-Hynes手术治疗UPJO成功率可达90%以上[10, 16]。本研究中281例术后有11例需要再行手术治疗,再手术率仅3.9%。本研究发现术前SRF<40%组再手术率高于术前SRF≥40%组,但两组间无统计学差异(6.5% vs. 2.8%, P=0.195)。有研究发现Anderson-Hynes术后再手术率与手术年龄、手术方式以及手术指征均无关联[17]。Anderson-Hynes术后出现再梗阻的治疗方法包括支架管置入以及再行Anderson-Hynes术。输尿管支架管置入术可以支撑吻合口,保持梗阻段通畅,并可帮助患儿度过吻合口的瘢痕水肿期,使吻合口更好地愈合,但这种方法的治愈率目前仍不确定,疗效最确切的方案仍为Anderson-Hynes手术[18]。
本研究虽然基本达到了预期的研究目的,但仍存在一些局限。首先,本研究为回顾性研究,存在回顾性偏倚。其次,本研究为多中心研究,每个研究单位测量肾实质厚度的标准不同(有的单位测量最薄的厚度,有的单位测量肾实质平均厚度),故无法将肾皮质厚度纳入研究。再次,因为部分研究单位术后不常规随访肾核素扫描,仅当出现梗阻症状或超声提示肾积水加重时再行此项检查,导致本队列中有118例患儿无术后肾核素检查结果,损失了一定的样本。术后仅行超声随访也得到很多学者支持,这可以减少对患儿的放射性伤害[18, 19]。最后,因为我们的随访时间较短,仅用术后半年SRF作为分组标准,随着时间推移,有些患儿的SRF可能还会进一步恢复。但也有学者研究发现,术后半年SRF与术后1年SRF相比无明显差异,故术后半年SRF也可以一定程度代表患儿术后长期SRF恢复情况[12]。
综上,本次多中心回顾性队列研究发现,虽然术前SRF≥40%患儿术后半年SRF与术前相比恢复程度较低,但术后半年SRF更好,且术后半年SRF恢复正常的患儿比例更高,建议单侧SFU Ⅳ度肾盂输尿管交界处梗阻患儿SRF≥40%且出现临床症状或积水加重时即可行手术治疗,而不要待SRF降至40%以下后再行手术治疗。
| 1 |
Han SW, Lee SE, Kim JH, et al. Does delayed operation for pediatric ureteropelvic junction obstruction cause histopathological changes?[J]. J Urol, 1998, 160: 984-988. DOI:10.1097/00005392-199809020-00004. |
| 2 |
中华医学会小儿外科分会泌尿外科学组. 先天性肾盂输尿管交界处梗阻诊疗专家共识[J]. 中华小儿外科杂志, 2018, 39(11): 804-810. DOI:10.3760/cma.j.issn.0253-3006.2018.11.002. Group of Urological Surgery, Branch of Pediatric Surgery. Chinese Medical Association[J]. Chin J Pediatr Surg, 2018, 39(11): 804-810. DOI:10.3760/cma.j.issn.0253-3006.2018.11.002. |
| 3 |
Ulman I, Jayanthi VR, Koff SA. The long-term follow-up of newborns with severe unilateral hydronephrosis initially treated nonoperatively[J]. J Urol, 2000, 164: 1101-1105. DOI:10.1097/00005392-200009020-00046. |
| 4 |
Kim SO, Yu HS, Hwang IS, et al. Early pyeloplasty for recovery of parenchymal thickness in children with unilateral ureteropelvic junction obstruction[J]. Urol Int, 2014, 92(4): 473-476. DOI:10.1159/000357144. |
| 5 |
Sinha A, Bagga A, Krishna A, et al. Revised guidelines on management of antenatal hydronephrosis[J]. Indian Pediatr, 2013, 50(2): 215-231. DOI:10.1007/s13312-013-0064-6. |
| 6 |
殷晓鸣, 杨屹. 欧洲泌尿外科学会2017年版肾盂输尿管交界处梗阻诊疗指南解读[J]. 临床小儿外科杂志, 2018, 17(7): 486-488. DOI:10.3969/j.issn.1671-6353.2018.07.002. Yin XM, Yang Y. Interpretations of 2017 European Association of Urology's Guidelines of Diagnosing & Treating Ureteropelvic Junction Obstruction[J]. J Clin Ped Sur, 2018, 17(7): 486-488. DOI:10.3969/j.issn.1671-6353.2018.07.002. |
| 7 |
Prigent A, Cosgrif P, Gates GF, et al. Consensus report on quality control of quantitative measurements of renal function obtained from renogram:International Consensus Committee from the Scientific Committee of Radionuclides in Nephrourology[J]. Semin Nucl Med, 1999, 29(2): 146-159. DOI:10.1016/s0001-2998(99)80005-1. |
| 8 |
Eskild-Jensen A, Gordon I, Piepsz A, et al. Interpretation of the renogram:problems and pitfalls in hydronephrosis in children[J]. BJU Int, 2004, 94(6): 887-892. DOI:10.1111/j.1464-410X.2004.05052.x. |
| 9 |
Eskild-Jensen A, Munch Jørgensen T, Olsen LH, et al. Renal function may not be restored when using decreasing differential function as the criterion for surgery in unilateral hydronephrosis[J]. BJU Int, 2003, 92(7): 779-782. DOI:10.1046/j.1464-410x.2003.04476.x. |
| 10 |
Salem YH, Majd M, Rushton HG, et al. Outcome analysis of pediatric pyeloplasty as a function of patient age, presentation and differential renal function[J]. J Urol, 1995, 154(5): 1889-1893. DOI:10.1016/S0022-5347(01)66819-8. |
| 11 |
Harraz AM, Helmy T, Taha DE, et al. Changes in differential renal function after pyeloplasty in children[J]. J Urol, 2013, 190(4): 1468-1473. DOI:10.1016/j.juro.2013.01.004. |
| 12 |
Nishi M, Matsumoto K, Fujita T, et al. Improvement in renal function and symptoms of patients treated with laparoscopic pyeloplasty for ureteropelvic junction obstruction with less than 20% split renal function[J]. J Endourol, 2016, 30(11): 1214-1218. DOI:10.1089/end.2016.0553. |
| 13 |
Kumar K, Ahmad A, Kumar S, et al. Evaluation of renal histopathological changes, as a predictor of recoverability of renal function following pyeloplasty for ureteropelvic junction obstruction[J]. Nephro Urol Mon, 2015, 7(4): e28051. DOI:10.5812/numonthly.28051. |
| 14 |
Walker MR, Babikian S, Ernest AJ, et al. Sonographic evaluation of hydronephrosis in the pediatric population:is well-tempered sonography necessary?[J]. J Ultrasound Med, 2015, 34(4): 655-662. DOI:10.7863/ultra.34.4.655. |
| 15 |
Helmy TE, Harraz A, Sharaf DE, et al. Can renal ultrasonography predict early success after pyeloplasty in children? A prospective study[J]. Urol Int, 2014, 93(4): 406-410. DOI:10.1159/000362504. |
| 16 |
Seixas-Mikelus SA, Jenkins LC, Williot P, et al. Pediatric pyeloplasty:comparison of literature meta-analysis of laparoscopic and open techniques with open surgery at a single institution[J]. J Urol, 2009, 182: 2428-2432. DOI:10.1016/j.juro.2009.07.051. |
| 17 |
Romao RLP, Koyle MA, Pippi Salle JL, et al. Failed pyeloplasty in children:revisiting the unknown[J]. Urology, 2013, 82(5): 1145-1149. DOI:10.1016/j.urology.2013.06.049. |
| 18 |
Cost NG, Prieto JC, Wilcox DT. Screening ultrasound in follow-up after pediatric pyeloplasty[J]. Urology, 2010, 76(1): 175-179. DOI:10.1016/j.urology.2009.09.092. |
| 19 |
Rickard M, Braga LH, Oliveria JP, et al. Percent improvement in renal pelvis antero-posterior diameter (PIAPD):Prospective validation and further exploration of cut-off values that predict success after pyeloplasty in children supporting safe monitoring with ultrasound alone[J]. J Pediatr Urol, 2016, 12(4): 228. DOI:10.1016/j.jpurol.2016.04.003. |
 2020, Vol. 19
2020, Vol. 19


