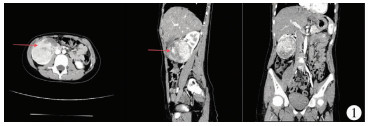
患儿,女,8岁,因间歇性全程血尿3 d入院。体检:T 36.8 ℃,P 90次/分,R 22次/分,BP 118/70 mmHg,WT 27 kg;生长发育正常,心肺无异常,腹部平软,双肾区无叩痛,双侧输尿管走行区无压痛,膀胱稍充盈,无压痛。既往无血尿史,否认家族遗传病史。实验室检查:血常规:Hb 118 g/L;尿常规:RBC(+++);血BUN及Cr正常。影像学检查:B超提示右肾中下级实性包块,大小约5 cm×7 cm×6 cm,左肾、膀胱未见明显异常,未见左肾静脉压迫;CT提示右肾中下极类椭圆形包块,密度欠均匀,边界欠清,大小约5.4 cm×7.2 cm×6.2 cm,增强扫描见包块明显不均匀强化,其内可见多发片状液化坏死区,提示为右侧肾脏恶性占位性病变(图 1至图 2)。完善相关检查后于全麻下行右肾根治性切除术。取右侧腹横切口,术中探查见右肾中下极处肾脏肿大变形,向上方膨出,质地呈囊实性,表面凹凸不平。予以分离暴露阻断肾蒂血管,完整取出肾脏,肿瘤大小约5 cm×7 cm×6 cm,探查肾静脉及下腔静脉未见瘤栓,分离后切除远端低位右侧输尿管,探查肾蒂、肾周围及输尿管,均无肿大淋巴结。免疫组化:CD10(+)、TFE-3(+)、WT-1(+)、CK(灶+)、Ki-67(+,3~5%)、EMA(-)、HMB45(-)、CD34(-)、Syn(-)、ALK(-)、DES(-)、MyoD1(-)。病理诊断为右肾Xp11.2易位/ TFE3基因融合相关性肾癌,肿瘤分期T3N0M0。手术顺利,患儿术后恢复良好,未行任何辅助性治疗。随访1年,B超及CT复查未见肿瘤复发和转移。
|
Download:
|
| 图 1 增强CT扫描图片 Fig. 1 Enhanced CT scan | |
|
Download:
|
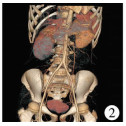
| 图 2 CT扫描三维重建图片 Fig. 2 3D reconstruction of CT scan | |
Xp11.2易位/ TFE3基因融合相关性肾癌是一种临床上罕见的肾癌,其特点是存在XP11.2染色体易位,导致转录因子E3(TFE3)基因与多种不同的基因融合[1]。该病好发于儿童及青少年,约占儿童及青少年肾癌的1/3,占成人肾癌的0.5% ~1.5%,女性多于男性[2]。
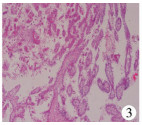
Xp11.2/ TFE3基因融合相关性肾癌的诊断需结合临床表现、影像学检查、组织形态学特征、免疫组化、细胞遗传学及分子生物学技术。该病临床表现和普通肾细胞癌相似,患儿可有血尿、腰部疼痛、腹部包块、泌尿系感染等表现[3]。部分患儿在体检时通过B超偶然发现。此外,有少部分患儿以转移灶症状为首发表现[4]。该病在超声及CT检查时主要表现为肾脏占位性肿块,术前单纯根据影像学表现诊断XP11.2/ TFE3基因融合相关性肾癌十分困难,但影像学检查可以为该肿瘤的诊断与鉴别诊断提供一定的指导。组织形态学方面:肿瘤界限相对清楚、假包膜常见,剖面多呈棕褐色至黄色,部分区域可见出血、坏死、钙化或囊性改变。Xp11.2易位/ TFE3基因融合相关性肾癌最典型的病理形态为透明细胞组成的乳头状结构伴钙化结节,少数还可见含嗜酸性颗粒胞浆的肿瘤细胞组成的巢状结构(图 3)。由于该肿瘤特征性高表达TFE3融合蛋白,Argani[5]对肾脏肿瘤及肾脏以外的各系统肿瘤研究后发现TFE3蛋白诊断该病的敏感性和特异性分别达到97.5%和99.6%。因此,免疫组织化学染色细胞核TFE3蛋白阳性被认为是Xp11.2/ TFE3基因融合相关性肾癌的特征性标记物[6]。最近,有研究发现荧光原位杂交技术(fluorescence in situ hybridization, FISH)可在基因水平检测出TFE3基因的易位,因此该方法诊断该病更加准确和客观[7]。本例患儿年龄、组织形态学、TFE3免疫组化均符合WHO及国外文献的诊断标准,未进行FISH检测,这也是本研究的不足之处。
|
Download:
|
| 图 3 肿瘤细胞组成乳头状结构 Fig. 3 Tumor cells were amanged as papillary-shaped with some clear-to-pale eosinophilic cytoplasm | |

|
Download:
|
| 图 4 肿瘤细胞核TFE3染色强阳性 Fig. 4 Strong positive expression of tumor cell nucleus of renal carcinoma by TFE3 immunostaining | |
Xp11.2/ TFE3基因融合相关性肾癌恶性潜能高,目前认为手术切除是最佳治疗方法。首选根治性肾切除术,若肿瘤较小或外生性生长,亦可采用肾部分切除术,对于伴有区域淋巴结转移的患儿仍主张一次性切除。有研究发现常规的术后免疫治疗及放化疗对该病无效[8]。靶向治疗在Xp11.2/ TFE3基因融合相关性肾癌中的应用报道较少,目前仍处在初步探索阶段。有研究显示该病使MET酪氨酸激酶受体上调,激活下游信号通路,导致细胞增殖从而诱发肿瘤的形成。因此,有学者推测MET酪氨酸激酶可能是该病的治疗靶点[9]。Xp11.2/ TFE3基因融合相关性肾癌预后与病理分型、肿瘤分级分期、是否有淋巴结转移、是否有远处转移、患者年龄、不同融合基因类型等因素有关[10]。目前关于该病预后的判断主要基于小样本及个案病例报道。基于以上,Xp11.2易位/ TFE3基因融合相关性肾癌由于罕见的发病率,对于其临床特点、影像学检查、实验室检测、病理形态学、预后等方面研究仍不全面,对于Xp11.2易位,TFE3基因融合的发生发展过程的机制尚不明确,有必要增加对本病的报道,建立大样本多中心的临床和基础研究,并长期随访[11]。
| 1 |
He J, Chen X, Gan W, et al. Renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusions:clinical experience and literature review[J]. Future Oncol, 2015, 11(24): 3243-3252. DOI:10.2217/fon.15.177. |
| 2 |
Liu C, Zhang W, Song H. Nephron-sparing surgery in the treatment of pediatric renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusions[J]. J Pediatr Surg, 2017, 52(9): 1492-1495. DOI:10.1016/j.jpedsurg.2017.03.052. |
| 3 |
He J, Zhou B, Zhu B, et al. Dynamic contrast-enhanced CT characterization of Xp11.2 translocation/TFE3 gene fusions versus papillary renal cell carcinomas[J]. Biomed Res Int, 2015, 2015: 298679. DOI:10.1155/2015/298679. |
| 4 |
AI-Maqhrabi JA, Khabaz MN. Uncommon localization of extrarenal Xp11.2 translocation-associated renal cell carcinoma (RCC):case report[J]. Applied immunohistochemistry & molecular morphology:AIMM, 2017. DOI:10.1097/PAI.0000000000000576. |
| 5 |
Choo MS, Jeonq CW, Song C, et al. Clinicopathologic characteristics and prognosis of Xp11.2 translocation renal cell carcinoma:multicenter, propensity score matching analysis[J]. Clin Genitourin Cancer, 2017, 15(5): e819-e825. DOI:10.1016/j.clgc.2017.04.015. |
| 6 |
Dey B, Badhe B, Govindarajan KK, et al. Xp11.2 translocation renal cell carcinoma diagnosed by immunohistochemistry and cytogenetics[J]. J Lab Physicians, 2016, 8(2): 123-125. DOI:10.4103/0974-2727.180796. |
| 7 |
Hirobe M, Masumori N, Tanaka T, et al. Clinicopathological characteristics of Xp11.2 translocation renal cell carcinoma in adolescents and adults:Diagnosis using immunostaining of transcription factor E3 and fluorescence in situ hybridization analysis[J]. Int J Urol, 2016, 23(2): 140-145. DOI:10.1111/iju.13007. |
| 8 |
Manucha V, Sessums MT, Lewin J, et al. Cyto-histological correlation of Xp11.2 translocation/TFE3 gene fusion associated renal cell carcinoma:Report of a case with review of literature[J]. Diagn Cytopathol, 2018, 46(3): 267-270. DOI:10.1002/dc.23839. |
| 9 |
Bambury RM, Battley JE, McCarthy A, et al. Translocation Renal Cell Carcinomas:An Evolving Entity and a Member of the Microphthalmia Transcription Factor-Associated Family of Tumors[J]. Clin Genitourin Cancer, 2013, 11(3): 357-361. DOI:10.1016/j.clgc.2012.12.006. |
| 10 |
Liu N, Gan W, Qu F, et al. Does the Fuhrman or World Health Organization/International Society of Urological Pathology Grading System apply to the Xp11.2 translocation renal cell carcinoma:a 10-year single-center study[J]. Am J Pathol, 2018, 188(4): 929-936. DOI:10.1016/j.ajpath.2017.12.018. |
| 11 |
井颖, 顾涛, 王建林, 等. 小儿Xp11.2易位/TFE3基因融合相关性肾癌1例[J]. 临床小儿外科杂志, 2015, 14(2): 157-160. DOI:10.3969/J.issn.1671-6353.2015.02.024. Jing Y, Gu T, Wang JL, et al. One case of renal carcinoma with Xp11.2 gene translocation/TFE3 gene fusion[J]. J Clin Ped Sur, 2015, 14(2): 157-160. DOI:10.3969/J.issn.1671-6353.2015.02.024. |
 2020, Vol. 19
2020, Vol. 19


