2. 四川大学华西医院重症医学科(四川省成都市, 610041)
2. Department of Critical Medicine, West China Hospital, Sichuan University, Chengdu 610041, China
婴幼儿肝血管瘤(infantile hepatic hemangioma, IHH)是婴幼儿时期肝脏最常见的良性肿瘤,是婴幼儿血管瘤(infantile hemangioma, IH)累及肝脏导致的一种良性病变[1-3]。临床上IHH可分为3类:局灶性、多发性和弥散性[4]。其中局灶性IHH并非真性IH,而是先天性快速消退型血管瘤。局灶性IHH在出生前就已形成,出生后不会继续增长,而是进入快速消退阶段[4, 5];其IH特异性标志物葡萄糖转运蛋白1(glucose transporter-1, GLUT-1)染色阴性[6]。多发性和弥散性IHH是真性IH,GLUT-1表达均为阳性,通常在出生时不会被发现,出生后与皮肤IH有着相似的生长特征[4, 5]。目前,普萘洛尔已经成为治疗皮肤IH的一线用药[7]。然而,应用普萘洛尔治疗IHH却鲜有报道。本研究回顾性分析2013—2018年在四川大学华西医院小儿外科接受口服普萘洛尔治疗的15例IHH患儿临床资料,现报道如下。
材料与方法 一、临床资料本研究回顾性收集2013—2018年在四川大学华西医院小儿外科诊断为多发性IHH和弥散性IHH的患儿作为研究对象,纳入标准:①多发性IHH;②弥散性IHH。排除标准:①局灶性IHH;②其他脉管源性肿瘤或实体肿瘤,如卡波西样血管内皮瘤、肝母细胞瘤等。IHH的诊断主要依靠影像学检查,超声下可见病灶内强回声,并伴有不规则低回声信号;MRI检查具有特异性,T1像多可见低信号或等信号,T2像呈高信号,边界清晰[2, 8]。本研究最终纳入15例IHH患儿。收集患儿的诊断年龄、性别、临床表现、实验室检查、影像学检查(B超、CT或MRI)、治疗方法和疗效等临床资料。15例中男童4例,女童11例,年龄1个月6天至2岁2个月,中位年龄4.2个月。多发性IHH 13例,其中包含2例“结合性”IHH;弥散性IHH 2例。1例因黄疸就诊发现;4例因B超检查偶然发现;4例因腹胀或肝脏肿大就诊发现;6例因皮肤多发血管瘤筛查发现。
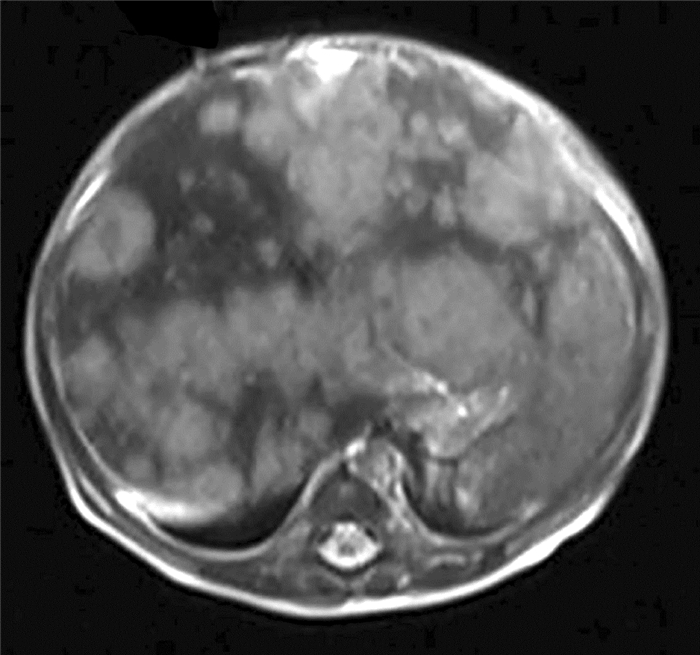
二、IHH分类及定义依据2007年波士顿儿童医院Christison-Lagay等[4]的分类标准,多发性IHH定义为肝脏中存在多个病灶,但各病灶之间并未融合,存在正常的肝组织以分隔病灶;弥散性IHH定义为大量的正常肝组织被无数个中心增强的病灶所替代,病灶之间发生融合。本研究中所有病例初筛时行腹部超声检查,发现肝脏有异常时再进一步行CT和(或)MRI检查以明确其为多发性IHH还是弥散性IHH。依据现有分类标准可知,多发性IHH与弥散性IHH的本质区别在于正常肝脏组织被瘤体所替代的程度。本研究发现,在多发性IHH中有2例影像学特征表现兼具多发性IHH与弥散性IHH的共同特点,即:病灶数量太多以致无法计算,同时部分病灶又出现了融合。故而在多发性IHH病例中,对于兼具多发性与弥散性IHH特征的病例,本研究称之为“结合性”IHH(图 1)。
|
Download:
|
| 图 1 “结合性”肝血管瘤MRI图 注 磁共振T2像水平位显示肝内无数个高信号血管瘤,部分瘤体发生融合,部分瘤体间存在正常肝组织 Fig. 1 Representative magnetic resonance imaging (MRI) of 'combined' infantile hepatic hemangioma.Innumerable lesions with high signal intensity were found in liver on T2 and some lesions had coalesced while others had parenchyma between them | |
所有患儿接受口服普萘洛尔片治疗。在治疗开始前,所有患儿常规行心电图、超声心动图、血压、心率和血糖的监测。治疗开始后,第1周的剂量为1 mg·kg-1·d-1,分3次服用,每次间隔6~8 h,在进食同时或进餐后15 min内服用,严禁空腹服用,以减少低血糖发生的可能。如在治疗第1周内未出现如严重腹泻、咳喘、低血压、低血糖等并发症,则从第2周开始,剂量调整为2 mg·kg-1·d-1,药物用法不变,以后按照患儿体重调整每日所需药物总剂量。
四、疗效评估与随访疗效主要从以下三方面进行评估:①每次门诊复查随访时,用相机拍照采集患儿皮肤IH信息,并记录皮肤瘤体面积大小(以最大直径×最大宽径为标准计算皮肤IH面积),用来对比治疗前后皮肤IH面积的消退情况[9];②IHH瘤体变化主要通过对比治疗起始时、治疗第6个月和第12个月时MRI的结果,其后再依据患儿病情确定复查时间。每次复查后,均记录当次MRI检查时最大瘤体体积大小,并以治疗前后最大瘤体体积的变化来评估瘤体消退情况;③患儿的临床症状和(或)疾病导致的并发症有无改善。
皮肤IH的疗效评价标准[10]:Ⅳ级:瘤体面积缩小>75%;Ⅲ级:50% < 瘤体面积缩小≤75%;Ⅱ级:25% < 瘤体面积缩小≤50%;Ⅰ级:瘤体面积缩小≤25%。IHH疗效评价标准:Ⅰ级,瘤体体积增大≥5%;Ⅱ级,瘤体体积缩小 < 5%或瘤体体积增大 < 5%;Ⅲ级,5%≤瘤体体积缩小 < 25%;Ⅳ级,25%≤瘤体体积缩小 < 50%;Ⅴ级,50%≤瘤体体积缩小 < 75%;Ⅵ级,75%≤瘤体体积缩小 < 100%或瘤体完全消退(100%)。
治疗开始后的第1周、第1个月、第3个月和第6个月分别到门诊复查,其中第1个月和第3个月需复查腹部彩超,第6个月需复查MRI;治疗6个月,每隔6个月门诊复查1次,同时还需复查MRI;治疗结束后,每隔1年门诊随访1次。平均随访时间23.9个月,随访时间2~46个月,无一例失访。
五、统计学处理应用SPSS 23.0软件包进行数据的整理与分析,采用配对样本t检验比较治疗前后瘤体体积大小。以P < 0.05为差异具有统计学意义。
结 果 一、临床特征肝脏肿大是IHH最常见的临床表现,占60%(9/15);其次是腹胀,占20%(3/15)。12例(80.0%)合并皮肤血管瘤;11例(73.3%)皮肤多发血管瘤>5个;5例伴发甲状腺功能减退者,其促甲状腺激素水平为14.02~73.79 mU/L(正常值:0.27~4.2 mU/L);1例伴有心功能不全。具体临床资料见表 1。
|
|
表 1 15例肝血管瘤患者的临床特征及治疗结果 Table 1 Clinical features, treatments and outcomes of 15 infantile hepatic hemangiomas |
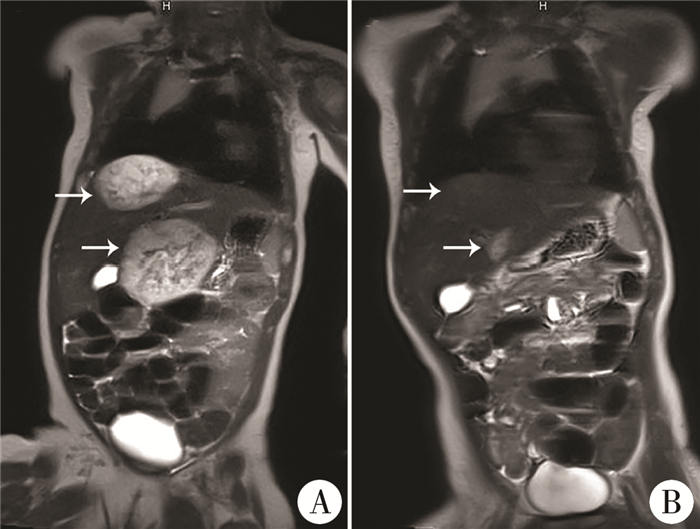
本研究中,初始诊断时有6例伴有并发症,其余9例虽然无明显并发症,但是短期内复查彩超,发现肝脏瘤体明显增长,为防止远期并发症的出现,这9例也一并纳入治疗。治疗前,最大瘤体平均体积为15.12 cm3(5.12~39.06 cm3)。治疗6个月后,平均最大瘤体体积为6.49 cm3,其中瘤体消退50%以上者8例(8/15,53.3%)(图 2);Ⅴ级以下疗效者7例(7/15,46.7%),包括1例治疗无效死亡患儿。治疗6个月与治疗起始时瘤体体积相比,疗效显著,差异具有统计学意义(t=3.317,P=0.006)。治疗12个月后,平均最大瘤体体积3.56 cm3,其中Ⅴ级或Ⅵ级疗效者10例(10/12,83.3%),与治疗起始时瘤体体积相比效果显著(t=3.450,P=0.005)。伴皮肤IH患儿中,Ⅳ级消退者12例。对于有甲状腺功能减退患儿,在普萘洛尔和甲状腺素联合治疗后,甲状腺功能都恢复正常,平均服用甲状腺素的时间为1.2个月。
|
Download:
|
| 图 2 口服普萘洛尔治疗3月龄多发性肝血管瘤患儿MRI结果 A:治疗前,MRI冠状位T2像显示肝内多发血管瘤;B:治疗6个月后,MRI冠状位T2像显示瘤体明显消退 Fig. 2 Magnetic resonance imaging (MRI) changes of multifocal infantile hepatic hemangioma before and after propranolol dosing in a 3-month-old girl | |
截止目前,治疗结束者有8例,平均治疗时间为23.8个月,治疗时长18~30个月;仍在继续治疗者6例,平均治疗时间20.5个月,治疗时长为6~41个月;死亡1例,该患儿死于心力衰竭和肝脏肿大引起的多器官功能障碍。14例存活患儿平均随访时间29.5个月,随访时长为2~48个月。在门诊随访过程中,无复发病例。在整个治疗过程中,无一例出现气道高反应性、低血糖、支气管痉挛等副作用。
讨 论IHH临床表现不一,轻者可无症状,严重者可危及生命。常见临床表现包括:肝脏增大、腹胀、黄疸、贫血等,严重者可导致呼吸困难、心力衰竭和甲状腺功能减退等并发症[2, 11]。由于IHH具有和皮肤IH一样的生长特点,未经治疗或者未能及时发现的多发性IHH将会持续生长,最终可能演化成弥散性病灶[11, 12]。相比于多发性IHH,弥散性IHH的临床症状更重,更易导致严重并发症,病死率更高[7, 11]。几乎所有弥散性IHH患儿后期都会发生甲状腺功能减退[3, 12]。此外,还可因肝脏肿大导致腹腔间隔室综合症的发生,最终出现心力衰竭或多器官系统衰竭而致患儿死亡。
目前,IHH主要以药物治疗为主。药物包括激素、干扰素、化疗药物及普萘洛尔等。激素在过去很长一段时间内被视为治疗皮肤IH或者IHH的一线药物,但其失败率可高达25%,且常常带来明显的副作用,如生长迟缓、库欣综合征及免疫抑制等[3]。
自2008年Léauté-Labrèze等[13]首次报道普萘洛尔治疗严重皮肤IH的显著疗效后,普萘洛尔逐渐成为治疗皮肤IH的一线用药[7]。临床随机试验也证实普萘洛尔的安全性与有效性均高于激素[14]。普萘洛尔促进血管瘤消退的机制复杂多样,包括促进血管瘤周细胞调控的血管收缩,抑制血管生成与血管发生和降低肾素-血管紧张素系统的活性等[15]。近期,有文献报道服用普萘洛尔治疗IHH取得良好效果[16, 17]。Varrasso等[16]研究发现,以2 mg·kg-1·d-1的剂量服用普萘洛尔治疗IHH,治疗第6周时瘤体体积便有轻度缩小,治疗12个月时,瘤体明显消退,治疗24个月时,瘤体达到完全消退。Tasseh等[17]研究发现,服用普萘洛尔(2 mg·kg-1·d-1)1个月后,IHH瘤体缩小20%,治疗8.5个月后,瘤体缩小48%,且整个治疗过程中均未出现普萘洛尔治疗相关并发症。在本研究中,除1例死亡外,其余14例在服用普萘洛尔治疗6个月及12个月后,其最大瘤体平均体积分别缩小57.1%(6.49 cm3)与76.5%(3.56 cm3),获得Ⅴ级及Ⅵ级疗效者比例分别达53.3%(8例)与83.3%(10例)。相比于治疗起始时的瘤体体积,治疗6个月与12个月后疗效明显;此外,在随访过程中并没有发现普萘洛尔相关并发症发生。1例死亡可能与患儿就诊时年龄较大,未能早期接受系统治疗,错过了普萘洛尔治疗最佳时机,导致瘤体没有得到很好控制有关;此外,就诊时患儿已并发心力衰竭与弥散性病灶等危险因素,最终导致患儿死亡[11]。
目前普萘洛尔治疗IHH的停药时机仍存在争议。临床上不同患儿可能存在不同的症状与并发症,通常难以形成统一的治疗标准。因此,常规的门诊复查随访尤为重要,可以及时有效地针对每位患儿的病情变化制定个体化诊治方案,从而更好地把握停药时机。本研究平均随访时间29.5个月。在整个随访期间,没有复发病例出现。部分仍继续接受普萘洛尔治疗的患儿,最主要的原因是瘤体并未达到最大消退程度。我们建议,当瘤体消退达到最大程度,且影像学复查显示瘤体不再明显缩小时,可缓慢停药。但停药后,仍需定期监测瘤体变化,直至瘤体完全消退[7]。
综上所述,口服普萘洛尔治疗IHH没有明显毒副作用,不良反应少,疗效明确,我们推荐普萘洛尔作为治疗IHH的一线药物。
| 1 |
Hsi Dickie B, Fishman SJ, Azizkhan RG. Hepatic vascular tumors[J]. Semin Pediatr Surg, 2014, 23(4): 168-172. DOI:10.1053/j.sempedsurg.2014.06.018. |
| 2 |
Iacobas I, Phung TL, Adams DM, et al. Guidance Document for Hepatic Hemangioma (Infantile and Congenital) Evaluation and Monitoring[J]. J Pediatr, 2018, 203: 294-300.e2. DOI:10.1016/j.jpeds.2018.08.012. |
| 3 |
Gnarra M, Behr G, Kitajewski A, et al. History of the infantile hepatic hemangioma:From imaging to generating a differential diagnosis[J]. World J Clin Pediatr, 2016, 5(3): 273-280. DOI:10.5409/wjcp.v5.i3.273. |
| 4 |
Christison-Lagay ER, Burrows PE, Alomari A, et al. Hepatic hemangiomas:subtype classification and development of a clinical practice algorithm and registry[J]. J Pediatr Surg, 2007, 42(1): 62-68. DOI:10.1016/j.jpedsurg.2006.09.041. |
| 5 |
Kulungowski AM, Alomari AI, Chawla A, et al. Lessons from a liver hemangioma registry:subtype classification[J]. J Pediatr Surg, 2012, 47(1): 165-170. DOI:10.1016/j.jpedsurg.2011.10.037. |
| 6 |
Roebuck D, Sebire N, Lehmann E, et al. Rapidly involuting congenital haemangioma (RICH) of the liver[J]. Pediatr Radiol, 2012, 42(3): 308-314. DOI:10.1007/s00247-011-2268-z. |
| 7 |
Krowchuk DP, Frieden IJ, Mancini AJ, et al. Clinical Practice Guideline for the Management of Infantile Hemangiomas[J]. Pediatrics, 2019, 143(1). DOI:10.1542/peds.2018-3475. |
| 8 |
曲志博, 刘连新. 小儿肝脏血管瘤的诊疗进展[J]. 临床小儿外科杂志, 2016, 15(4): 393-396. DOI:10.3969/j.issn.1671-6353.2016.04.024. Qu ZB, Liu LX. Advances in the diagnosis and treatment of infantile hepatic hemangioma[J]. J Clin Ped Sur, 2016, 15(4): 393-396. DOI:10.3969/j.issn.1671-6353.2016.04.024. |
| 9 |
Haggstrom AN, Drolet BA, Baselga E, et al. Prospective study of infantile hemangiomas:clinical characteristics predicting complications and treatment[J]. Pediatrics, 2006, 118(3): 882-887. DOI:10.1542/peds.2006-0413. |
| 10 |
Ji Y, Wang Q, Chen S, et al. Oral atenolol therapy for proliferating infantile hemangioma:A prospective study[J]. Medicine (Baltimore), 2016, 95(24): e3908. DOI:10.1097/MD.0000000000003908. |
| 11 |
Rialon KL, Murillo R, Fevurly RD, et al. Risk factors for mortality in patients with multifocal and diffuse hepatic hemangiomas[J]. J Pediatr Surg, 2015, 50(5): 837-841. DOI:10.1016/j.jpedsurg.2014.09.056. |
| 12 |
Rialon KL, Murillo R, Fevurly RD, et al. Impact of screening for hepatic hemangiomas in patients with multiple cutaneous infantile hemangiomas[J]. Pediatr Dermatol, 2015, 32(6): 808-812. DOI:10.1111/pde.12656. |
| 13 |
Leaute-Labreze C, Dumas de la Roque E, Hubiche T, et al. Propranolol for severe hemangiomas of infancy[J]. N Engl J Med, 2008, 358(24): 2649-2651. DOI:10.1056/NEJMc0708819. |
| 14 |
Kim KH, Choi TH, Choi Y, et al. Comparison of efficacy and safety between propranolol and steroid for infantile hemangioma:a randomized clinical trial[J]. JAMA Dermatol, 2017, 153(6): 529-536. DOI:10.1001/jamadermatol.2017.0250. |
| 15 |
Ji Y, Chen S, Xu C, et al. The use of propranolol in the treatment of infantile haemangiomas:an update on potential mechanisms of action[J]. Br J Dermatol, 2015, 172(1): 24-32. DOI:10.1111/bjd.13388. |
| 16 |
Varrasso G, Schiavetti A, Lanciotti S, et al. Propranolol as first-line treatment for life-threatening diffuse infantile hepatic hemangioma:A case report[J]. Hepatology, 2017, 66(1): 283-285. DOI:10.1002/hep.29028. |
| 17 |
Al Tasseh0 F, El-Khansa M, Abd O, et al. Diffuse hepatic hemangioma with single cutaneous hemangioma:an alerting occurrence[J]. Clin Case Rep, 2017, 5(6): 887-890. DOI:10.1002/ccr3.963. |
 2020, Vol. 19
2020, Vol. 19


