2. 中国医科大学附属盛京医院小儿外科功能检测室(辽宁省沈阳市, 110004);
3. 中国医科大学附属盛京医院卫生部先天畸形重点实验室(辽宁省沈阳市, 110004)
2. Test Room of Pediatric Surgery Function, Affiliated Shengjing Hospital, China Medical University, Shenyang 110004, China;
3. Key Laboratory of Congenital Malformations, Ministry of Health, Affiliated Shengjing Hospital, China Medical University, Shenyang 110004, China
先天性肛门直肠畸形(anorectal malformations, ARM)是常见的小儿消化道畸形之一,其发病率为1/5 000~1/3 500[1-3]。术后排便功能障碍是ARM的严重并发症,常引起患儿心理、生理发育和社会活动能力障碍[4-7]。ARM术后排便功能障碍主要表现为便失禁和便秘,而更多的研究都集中在术后便失禁的病理基础和治疗方法的改进方面[8-11]。近年来随着手术技术的不断改进,尤其是后矢状入路肛门直肠成形术(posterior sagittal anorectoplasty, PSARP)和腹腔镜辅助肛门成形术(laparoscopic-assisted ano-rectoplasty, LAARP)的广泛开展,术后便失禁的发生率有所降低,但术后便秘发生率却逐年升高,据不完全统计为22.2% ~86.7%,已经成为ARM术后的主要并发症,引起人们的重视[12-18]。严重便秘可引起污便和假性便失禁,易与术后肛门括约肌功能不良所致便失禁相混淆,而这两种便失禁病因不同,治疗方法也不同。研究术后便秘的病因和病理改变,针对病因进行治疗,对提高疗效和改善患儿生活质量有重要意义。本研究针对先天性肛门直肠畸形术后合并便秘的患儿进行排便功能的客观评定,同时针对病因进行探讨。
材料与方法 一、临床资料 (一) 病例组研究对象为中国医科大学附属盛京医院行肛门成形术后5~19年的患儿49例,男24例,女25例,年龄5~20岁,平均(11.33±5.1)岁。低位畸形11例,中位17例,高位21例。根据表 1提及的评分标准进行分级,计算评分时只选便失禁和便秘两项中评分等级较低的一项作为最终结果(评分结果:优11例,良21例,劣17例)[19]。根据便秘诊断标准[20, 21] (符合下述症状至少2项:①每周排便次数≤2次;②每周大便失禁≥1次;③具有粪便潴留姿势或过度的自主憋便;④疼痛或排便困难史;⑤直肠内存在大体积粪块;⑥排出可能堵塞厕所的大块粪便),49例中有17例诊断为便秘(34.69%),其中男9例,女8例,低位畸形3例(23.08%),中位畸形5例(31.25%),高位畸形9例(45%)。中低位畸形患儿主要表现排便次数减少,同时有排便困难;而高位畸形患儿主要表现为单纯排便困难。7例行后矢状入路肛门成形术患儿中有5例出现便秘(71.43%),13例行腹骶会阴肛门成形术患儿中有5例出现便秘(38.46%)。所有便秘患儿无肛门狭窄,其中有3例伴有严重的直肠乙状结肠扩张,为典型的“末端粪便潴留综合征”。49例ARM患儿根据畸形位置分为中低位组和高位组,每组再根据患儿是否发生便秘分出两个亚组。
|
|
表 1 同位素排便造影各项指标在ARM术后变化情况( |
研究对象为无肛肠及神经疾患小儿31例,男16例,女15例。年龄5~14岁,平均(10.64±2.7)岁。
二、客观检测方法 (一) 同位素排便造影患儿坐在特制便桶上,上身平直紧靠摄影台,屈膝曲髋各90°,将Foley氏管插入直肠,尖端距肛缘7 cm,将200MBq99mTcO4-造影剂匀速注入直肠内,以Foley氏管作为肛管轴线标志,然后拔出Foley氏管,让患儿放松肛门,便失禁患儿显影剂可自动漏出,待停止漏出后开始排便,同时进行动态采集,每3 s一幅,采集5 min,根据需要可继续延长采集时间,图像采集使用东芝7200-A/DI SPECT显像仪和LEHR准直器进行左侧位采集。检查后可获得如下客观指标:①直肠肛管保留率:拔出Foley氏管后患儿保持放松状态,直肠肛管所能控制钡糊的核素量占注入直肠内核素总量的百分比。②直肠肛管排空曲线及半排时间、排空率和残留率:选取整个显影的肠管(包括肛管、直肠及部分乙状结肠)作为感兴趣区,并对整个排便过程的所有图像进行放射性计数,可获得直肠肛管的排空曲线,反映排便开始至结束整个过程直肠肛管内核素量的变化。半排时间是指直肠肛管内核素量排空一半所需时间;排空率是指整个排便过程中排出核素量占排便开始时核素量的百分比;残留率是指排便结束后直肠肛管内残留核素量占注入直肠内核素总量的百分比。
(二) 直肠肛管测压检测前使用开塞露排空直肠,患儿取左侧卧位,屈膝曲髋各90°。测压采用高分辨多通道胃肠功能测定仪(POLYGRAM HR瑞典CTD-SYNECTICS公司)。
1.测定直肠感觉和直肠肛管反射:将8通道测压导管插入直肠内,并将最近端侧孔固定于肛管后方距肛缘0.5 cm处,气囊底位于距肛缘5 cm处。在气囊压力和直肠肛管不同平面压力同步监测的情况下,开始向气囊注气,让患儿描述直肠内的主观感受,并记录直肠感觉阈和最大耐受值,直肠肛管反射波形自动存入电脑内,重复检测3次,取平均值, 可获得如下检测指标:①直肠感觉阈:感觉到直肠内气囊膨胀所需最小注气量;②感觉收缩时间:从气囊膨胀开始至感觉膨胀后立即收缩肛门外括约肌所需的时间;③直肠肛管松弛反射:直肠气囊膨胀后肛管高压区压力降至静息压力1/4以上者判定为直肠肛管松弛反射阳性;④直肠肛管收缩反射:直肠气囊膨胀后肛门外括约肌出现超过5 mmHg的压力上升高峰则判定为收缩反射阳性。
2.直肠顺应性测定:将4通道(各侧孔均位于3 cm×6.5 cm的气囊内)测压导管插入直肠内,气囊底固定在距肛缘5 cm处直肠内,开始连续快速注气,首次注气量为10 mL,逐渐增加,每次增加10 mL,持续5 s,直至达到最大耐受量为止,记录气囊内压力变化曲线,重复3次。直肠顺应性为气囊注气量与该注气量在直肠内产生压力的比值。
3.向量测压:将测压管(8通道聚乙烯导管,侧孔位于同一平面,开口方向相隔45°)插入直肠内,待压力稳定后,分别在静息和用力收缩肛门时用拖拽仪将导管匀速(0.17 cm/s)拔出,同时记录各通道压力变化,反复3次。检测指标为静息和收缩状态下向量容积,向量容积是肛管高压区向量压力与肛管高压区长度的乘积,代表高压区向量压力的三维空间分布情况。
(三) 肌电图检查患儿取左侧卧位,将肛探电极插入肛门,开始记录静息、收缩和排便状态下的肛门外括约肌肌电波形。示波器扫描速度50 ms/cm,增益50 v/cm。检测收缩和排便状态下肌电信号的波动范围(肌电振幅)。根据上述指标计算痉挛指数(痉挛指数=排便动作时肌电振幅增加值/用力收缩时肌电振幅增加值)。
(四) 肛门括约肌神经电生理检查采用美国Cadwell Sierra Console肌电和神经诱发电位检测仪,由Cadwell双极表面刺激电极产生刺激信号,由双极表面不锈钢肛探电极记录肛门外括约肌肌电信号,采用直径1 cm圆盘皮肤表面电极记录马尾神经诱发电位。检测指标包括会阴-肛门反射潜伏期、脊髓-肛门反应潜伏期、马尾神经诱发电位潜伏期和中枢时间[22]。
三、统计学处理采用SPSS19.0进行统计学分析。由于排空率、残留率在本研究中进行了定量化处理,因此半排时间、排空率、残留率的统计学描述形式为(x ±s),组间比较采用Dunnett-t检验。
结 果 一、ARM术后便秘患儿的同位素排便造影检测结果同位素排便造影可以记录排便过程中直肠内核素的动态变化情况,获得直肠肛管排空曲线,通过直肠肛管排空曲线可计算出反映排便能力的半排时间、排空率和残留率。正常儿童排空曲线为平缓下降的弧形曲线,平均半排时间为1.97 min,平均排空率为78.3%,平均残留率为21.2%,而ARM便秘患儿则多数表现为曲线平直或缓慢下降,半排时间明显延长,排空率降低,残留率增多。ARM术后便秘阳性组与术后便秘阴性组比较,半排时间、排空率和残留率均存在统计学差异,尤其高位ARM便秘组的半排时间延长更加明显,与中低位ARM便秘组相比也具有统计学差异,见表 1。
二、ARM术后便秘患儿的直肠肛管测压结果直肠肛管测压检测结果显示,松弛反射在中低位ARM便秘组阳性率为87.5%(7/8),ARM无便秘组为45%(9/20),而收缩反射阳性率分别为50%(4/8)和50%(10/20)。松弛反射在高位ARM便秘组阳性率为11.1%(1/9),ARM无便秘组为25%(3/12),而收缩反射阳性率分别为33.3%(3/9)和25%(3/12)。
反映直肠感觉功能的直肠感觉阈在所有ARM组中均明显高于正常组,ARM便秘阳性组高于ARM便秘阴性组,差异具有统计学意义;反映肠壁弹性的直肠顺应性在ARM便秘阳性组明显差于ARM便秘阴性组;反映直肠感觉与括约肌神经传导综合能力的感觉收缩时间在ARM组均明显延长,ARM便秘阳性组明显高于ARM便秘阴性组;反映肛门内括约肌功能的静息向量容积和反映肛门外括约肌功能的收缩向量容积在ARM组均明显降低,但在ARM便秘阳性组和ARM便秘阴性组之间没有明显差异。见表 2。
|
|
表 2 直肠肛管测压各项指标在ARM术后变化情况( |
收缩状态下肌电振幅主要反映收缩状态下肛门外括约肌力量,肌电图检测结果显示ARM高位组的肌电振幅明显降低(图 1),肌电振幅的改变与是否合并便秘无关。而肌电图检测的痉挛指数是反映排便动作时肛门外括约肌松弛程度的指标。正常排便过程中,当腹内压和直肠内压增加时,肛周肌肉松弛,痉挛指数为负值。如果肌肉不松弛而出现反常收缩,使直肠肛管角变锐,肛管压上升,导致排便困难,痉挛指数将升高,代表排便困难程度增加。本研究中ARM术后患儿的痉挛指数均为正值,而且术后便秘阳性组ARM值均明显高于未合并便秘组,见表 3。
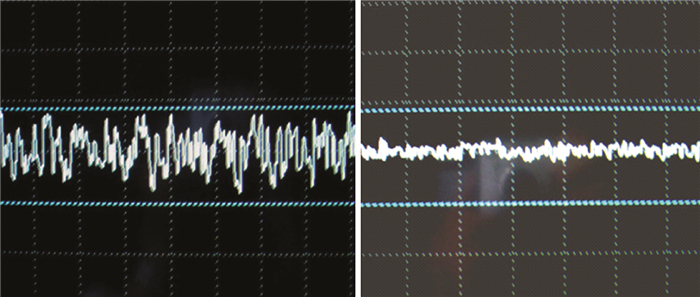
|
Download:
|
| 图 1 肛探表面电极检测的肌电波形图A:正常儿童的肛门肌电波形图; B:ARM术后便秘患儿的肛门肌电波形图 Fig. 1 Electromyography(EMG)waveform detected by anal probe surface electrode A:Anal EMG of normal children; B:Anal EMG waveform of constipated children after ARM operation | |
|
|
表 3 肌电图各项指标在ARM术后变化情况( |
反映支配肛门外括约肌神经传导功能的会阴-肛门反射潜伏期、脊髓-肛门反应潜伏期和反射弧中枢传导时间在ARM患儿组均明显延长,尤其ARM便秘阳性组延长更加明显,与ARM便秘阴性组相比具有统计学差异,见表 4。
|
|
表 4 术后便秘患儿肛门括约肌神经电生理检测结果( |
ARM术后排便功能障碍主要包括便失禁和便秘,随着手术技术的不断改进,术后便失禁的发生率有所降低,人们逐渐把关注的焦点转移到术后便秘上。便秘在正常儿童中的发生率为0.7% ~ 29.6%[23],但ARM术后便秘的发生率却高达22.2% ~86.7%,明显高于正常人群的发生率,表明术后便秘的发生与ARM本身复杂的病理改变有关,但有关这类患儿肛门直肠功能客观评定方面的文献报道较少。排便控制是一个复杂的生理反射和调控过程,是由内外括约肌力量和反射机制、直肠感觉和顺应性调节、盆底肌肉协调运动等许多因素相互作用的结果,其中任何一个环节出现异常都会导致便秘的发生。为探讨ARM术后便秘的发生原因,本研究利用同位素排便造影、直肠肛管测压、肌电图和肛门括约肌神经电生理等方法对17例ARM术后便秘患儿和32例未合并便秘的ARM患儿的排便控制机制进行全面、系统和动态的评价,并对排便功能障碍的病因进行探讨。
同位素排便造影可以对排便过程中直肠、乙状结肠内的核素进行定量检测,将整个排便过程的特征记录为直肠肛管排空曲线,通过排空曲线可计算出半排时间、排空率和残留率,这是反映排便能力的客观指标[24]。本研究结果显示,正常儿童半排时间、排空率和残留率分别为1.97 min、78.3%和21.2%,而ARM术后便秘患儿半排时间明显延长,排空率明显降低,残留率明显增加,表明患儿存在严重的排便困难,直肠排空能力很差,符合便秘患儿的特征性改变。直肠肛管测压的直肠感觉阈和直肠顺应性是评价便秘患儿直肠功能的重要指标[25]。本研究发现ARM术后便秘患儿的直肠感觉阈值明显增加,表明患儿的直肠感觉迟钝,这也是便秘患儿存在便潴留的原因。感觉时间延迟是评价直肠感觉的另一重要指标,感觉收缩时间是指从直肠开始膨胀至感觉传入大脑、再经大脑传出指令至肛门外括约肌产生收缩所需时间,是评价直肠感觉与括约肌神经传导功能的综合指标。本研究结果证实ARM术后便秘患儿感觉收缩时间明显延长。感觉收缩时间与感觉阈是反映直肠感觉不同方面的指标,其中感觉阈代表直肠敏感性,而感觉收缩时间在达到感觉阈情况下更侧重于评价神经传导能力。直肠顺应性是容量与压力二者的比值,是反应直肠壁弹性的指标。长期便秘所致的便潴留会导致直肠顺应性异常,本研究结果也证实了这一点。
静息向量容积主要代表肛门内括约肌功能,而收缩向量容积则代表肛门外括约肌功能。本研究结果表明ARM术后患儿的静息向量容积和收缩向量容积均明显低于正常儿童水平,但ARM术后便秘患儿与ARM术后未合并便秘患儿相比没有显著性差异,表明患儿的内、外括约肌功能降低与ARM有关,但与术后便秘无关。肌电图检测指标中,收缩状态下肌电振幅主要反映收缩状态下肛门外括约肌力量,本研究肌电图检测结果与直肠肛管测压的结果一致,也从另一个角度证明ARM患儿的内、外括约肌功能降低与ARM病理改变有关,但与术后便秘无关。肌电图痉挛指数是反映排便动作时肛门括约肌松弛程度的指标,正常排便过程中,当腹内压和直肠内压增加时,肛周肌肉松弛,使粪便排出,痉挛指数为负值。如果肌肉不松弛而出现反常收缩,使直肠肛管角变锐,肛管压上升,导致排便困难,则痉挛指数为正值。本研究结果证实ARM术后便秘患儿的痉挛指数较未合并便秘患儿明显增加,这种排便动力异常可能是ARM术后发生便秘的主要机制。这种肛门外括约肌反常收缩所致的排便动力异常也是正常人群出现便秘的主要原因。有研究者利用直肠内气囊排出试验对29例ARM术后合并便秘的患儿进行检测,结果显示患儿均出现肛门外括约肌的反常收缩,这表明排便动力异常可能是ARM术后合并便秘的主要原因[13]。
支配肛门直肠和盆底肌肉的神经功能异常可导致直肠感觉阈增高、感觉收缩时间延长和排便动力异常,为了探究ARM术后便秘患儿是否存在神经功能异常,本研究进行了神经电生理检测,结果显示反映支配肛门外括约肌神经传导功能的会阴-肛门反射潜伏期、脊髓-肛门反应潜伏期和反射弧中枢传导时间在ARM便秘阳性组明显延长,表明患儿的神经功能损伤更加明显。多年来,ARM患儿腰骶神经异常已经引起了人们的重视,Li等[26]进行ARM盆底肌肉组织学检查时发现,患儿的感觉和运动神经末梢均存在明显异常。本课题组利用乙烯硫脲致畸的ARM大鼠模型进行胚胎期神经示踪研究,发现支配盆底肌的脊髓运动和感觉神经元以及支配直肠的脊髓副交感神经元均存在明显发育异常[8, 9, 23]。Tunell[28]采用X线检查发现35%的无肛儿伴有腰骶椎骨质异常,53%存在脊髓或椎管异常,并随年龄增加而逐渐加重。Capitanucci[29]发现脊髓异常者在年幼时极少出现症状,而年长儿则明显增加,该研究者认为在出现症状之前,早期诊断并治疗脊髓病变非常重要。Samuk[30]对790例ARM患儿进行MRI检查,发现36%的患儿可诊断为脊髓拴系综合征。Kyrklund K[31]对89例脊柱外观正常的ARM患儿进行MRI检查,发现34%的患儿存在脊髓异常。这些研究结果均提示ARM患儿存在严重的神经支配功能异常,为了提高术后治疗效果,应考虑在进行肛门成形术的同时进行神经功能的修复重建治疗(如经肛或经皮神经电刺激治疗,植入式骶神经电刺激治疗和脊髓拴系松解术等)[32, 33]。
综上所述,小儿外科医生对于ARM术后便秘患儿应给予足够重视,这些患儿存在复杂的肛门直肠和神经功能改变,治疗前应进行肛门括约肌神经电生理、X线片排便造影、同位素排便造影、直肠肛管测压和肌电图等检查,对肛门直肠和神经功能进行全面、系统和动态的评价,明确排便功能障碍的具体病因和病理改变,这对于治疗方案的制定及疗效的预测有重要意义。
| 1 |
Rigueros Springford L, Connor MJ, Jones K, et al. Prevalence of active long-term problems in patients with anorectal malformations:a systematic review[J]. Dis Colon Rectum, 2016, 59(6): 570-580. DOI:10.1097/DCR.0000000000000576. |
| 2 |
Han Y, Xia Z, Guo S, et al. Laparoscopically assisted anorectal pull-through versus posterior sagittal anorectoplasty for high and intermediate anorectal malformations:a systematic review and meta-analysis[J]. PLoS One, 2017, 12(1): e0170421. DOI:10.1371/journal.pone.0170421. |
| 3 |
袁正伟. 先天性肛门直肠畸形病因学研究新进展[J]. 发育医学电子杂志, 2016, 4(1): 8-12. Yuan ZW. Recent advances in etiologies of congenital anorectal malformations[J]. Journal of Developmental Medicine, 2016, 4(1): 8-12. |
| 4 |
白玉作. 小儿肛门直肠畸形术后排便功能障碍的防治[J]. 临床小儿外科杂志, 2004, 3(3): 200-201. DOI:10.3969/j.issn.1671-6353.2004.03.012. Bai YZ. Preventions and treatments of dysporia for young children after anorectal orthopedic procedure[J]. J Clin Ped Sur, 2004, 3(3): 200-201. DOI:10.3969/j.issn.1671-6353.2004.03.012. |
| 5 |
Kyrklund K, Pakarinen MP, Koivusalo A, et al. Long-term bowel functional outcomes in rectourethral fistula treated with PSARP:controlled results after 4-29 years of follow-up:a single-institution, cross-sectional study[J]. J Pediatr Surg, 2014, 49(11): 1635-1642. DOI:10.1016/j.jpedsurg.2014.04.017. |
| 6 |
Fabbro MA, Chiarenza F, D'Agostino S, et al. Anorectal malformations (ARM):quality of life assessed in the functional, urologic and neurologic short and long term follow-up[J]. Pediatr Med Chir, 2011, 33(4): 182-192. |
| 7 |
Kyrklund K, Pakarinen MP, Rintala RJ. Long-term bowel function, quality of life and sexual function in patients with anorectal malformations treated during the PSARP era[J]. Semin Pediatr Surg, 2017, 26(5): 336-342. DOI:10.1053/j.sempedsurg.2017.09.010. |
| 8 |
Yuan ZW, Lui VC, Tam PK. Deficient motor innervation to the sphincter mechanism in fetal rats with anorectal malformation:a quantitative study by Fluorogold retrograde tracing[J]. J Paediatr Surg, 2003, 38(9): 1383-1388. DOI:10.1016/s0022-3468(03)00401-9. |
| 9 |
Jia H, Zhang K, Zhang S, et al. Quantitative analysis of sacral parasympathetic nucleus innervating the rectum in rats with anorectal malformation[J]. J Pediatr Surg, 2007, 42(9): 1544-1548. DOI:10.1016/j.jpedsurg.2007.04.034. |
| 10 |
Yang Z, Geng Y, Yao Z, et al. Spatiotemporal expression of Bcl-2/Bax and neural cell apoptosis in the developing lumbosacral spinal cord of rat fetuses with anorectal malformations[J]. Neurochem Res, 2017, 42(11): 3160-3169. DOI:10.1007/s11064-017-2354-1. |
| 11 |
Lagares-Tena L, Millán-Paredes L, Lázaro-García L, et al. Sacral neuromodulation in patients with congenital faecal incontinence Special issues and review of the literature[J]. Tech Coloproctol, 2018, 22(2): 89-95. DOI:10.1007/s10151-017-1742-5. |
| 12 |
Santos-Jasso KA, Arredondo-García JL, Maza-Vallejos J, et al. Effectiveness of senna vs polyethylene glycol as laxative therapy in children with constipation related to anorectal malformation[J]. J Pediatr Surg, 2017, 52(1): 84-88. DOI:10.1016/j.jpedsurg.2016.10.021. |
| 13 |
van Meegdenburg MM, Heineman E, Broens PM. Dyssynergic defecation may aggravate constipation:results of mostly pediatric cases with congenital anorectal malformation[J]. Am J Surg, 2015, 210(2): 357-364. DOI:10.1016/j.amjsurg.2014.09.038. |
| 14 |
Kyrklund K, Pakarinen MP, Koivusalo A, et al. Long-term bowel functional outcomes in rectourethral fistula treated with PSARP:controlled results after 4-29 years of follow-up:a single-institution, cross-sectional study[J]. J Pediatr Surg, 2014, 49(11): 1635-1642. DOI:10.1016/j.jpedsurg.2014.04.017. |
| 15 |
Stenström P, Kockum CC, Emblem R, et al. Bowel symptoms in children with anorectal malformation-a follow-up with a gender and age perspective[J]. J Pediatr Surg, 2014, 49(7): 1122-1130. DOI:10.1016/j.jpedsurg.2013.10.022. |
| 16 |
Huang CF, Lee HC, Yeung CY, et al. Constipation is a major complication after posterior sagittal anorectoplasty for anorectal malformations in children[J]. Pediatr Neonatol, 2012, 53(4): 252-256. DOI:10.1016/j.pedneo.2012.06.007. |
| 17 |
Levitt MA, Kant A, Peña A. The morbidity of constipation in patients with anorectal malformations[J]. J Pediatr Surg, 2010, 45(6): 1228-1233. DOI:10.1016/j.jpedsurg.2010.02.096. |
| 18 |
Rintala R, Lindahl H, Marttinen E, et al. Constipation is a major functional complication after internal sphicter-saving posterior sagittal anorectoplasty for high and intermediate anorectal malformations[J]. J Pediatr Surg, 1993, 28(8): 1054-1058. DOI:10.1016/0022-3468(93)90518-p. |
| 19 |
王慧贞, 李正. 肛门成形术后肛门功能评定标准的初步意见[J]. 中华小儿外科杂志, 1985, 6(2): 116-117. Wang HZ, Li Z. Preliminary comments on criteria for evaluating anal functions after anoplasty[J]. Chin J Pediatr Surg, 1985, 6(2): 116-117. |
| 20 |
焦春雷, 李丹丹, 余东海, 等. 小儿功能性便秘罗马Ⅳ标准的外科学解读[J]. 中华小儿外科杂志, 2017, 38(6): 403-405. DOI:10.3760/cma.j.issn.0253-3006.2017.06.002. Jiao CL, Li DD, Yu DH, et al. Surgical interpretation of Rome Ⅳ criteria for pediatric functional constipation[J]. Chin J Pediatr Surg, 2017, 38(6): 403-405. DOI:10.3760/cma.j.issn.0253-3006.2017.06.002. |
| 21 |
Hyams JS, Di Lorenzo C, Saps M, et al. Functional disorders:children and adolescents[J]. Gastroenterology, 2016, 150(60): 1456-1468. DOI:10.1053/j.gastro.2016.02.015. |
| 22 |
袁正伟, 王维林, 吉士俊, 等. 先天性无肛畸形患儿肛门外括约肌神经电生理研究[J]. 中华医学杂志, 2000, 80(1): 34-37. DOI:10.3760/j:issn:0376-2491.2000.01.010. Yuan ZW, Wang WL, Ji SJ, et al. Electrophysiological study of sphincter nerve in children with congenital ananus malformations[J]. Natl Med J China, 2000, 80(1): 34-37. DOI:10.3760/j:issn:0376-2491.2000.01.010. |
| 23 |
Mugie SM, Benninga MA, Di Lorenzo C. Epidemiology of constipation in children and adults:a systematic review.Best Pract Res Clin Gastroenterol[J]. Best Pract Res Clin Gastroenterol, 2011, 25(1): 3-18. DOI:10.1016/j.bpg.2010.12.010. |
| 24 |
Papachrysostomou M, Griffin TM, Ferrington C, et al. A method of computerised isotope dynamic proctography[J]. Eur J Nucl Med, 1992, 19(6): 431-435. DOI:10.1007/bf00177370. |
| 25 |
Zhao Y, Ren X, Qiao W, et al. High-resolution anorectal manometry in the diagnosis of functional defecation disorder in patients with functional constipation:a retrospective cohort study[J]. J Neurogastroenterol Motil, 2019, 25(2): 250-257. DOI:10.5056/jnm18032. |
| 26 |
Li L, Li Z, Hou HS, et al. Sensory nerve endings in puborectalis and anal region:normal findings in the newborn and changes in anorectal anomalis[J]. J Pediatr Surg, 1990, 25(6): 658-664. DOI:10.1016/0022-3468(90)90357-f. |
| 27 |
Guan K, Li H, Fan Y, et al. Development of sensory neurons innervating the levator ani muscle in fetal rats with anorectal malformation[J]. Birth Defects Res A Clin Mol Teratol, 2009, 85(7): 583-587. DOI:10.1002/bdra.20576. |
| 28 |
Tunell WP, Austin JC, Barnes PD, et al. Neuroradiologic evaluation of sacral abnormalities in imperforate anus complex[J]. J Pediatr Surg, 1987, 22(1): 58-61. DOI:10.1016/s0022-3468(87)80016-7. |
| 29 |
Capitanucci ML, Rivosecchi M, Silveri M, et al. Neurovesical dysfunction due to spinal dysraphia in anorectal anomalies[J]. Eur J Pediatr Surg, 1996, 6(3): 159-162. DOI:10.1055/s-2008-1066496. |
| 30 |
Samuk I, Bischoff A, Freud E, et al. Tethered cord in children with anorectal malformations with emphasis on rectobladder neck fistula[J]. Pediatr Surg Int, 2019, 35(2): 221-226. DOI:10.1007/s00383-018-4399-x. |
| 31 |
Kyrklund K, Pakarinen MP, Taskinen S, et al. Spinal cord anomalies in patients with anorectal malformations without severe sacral abnormalities or meningomyelocele:outcomes after expectant, conservative management[J]. J Neurosurg Spine, 2016, 25(6): 782-789. DOI:10.3171/2016.4.SPINE1641. |
| 32 |
Zhengwei Y, Weilin W, Yuzuo B, et al. Long-term outcomes of individualized biofeedback training based on the underlying dysfunction for patients with imperforate anus[J]. J Pediatr Surg, 2005, 40(3): 555-561. DOI:10.1016/j.jpedsurg.2004.11.034. |
| 33 |
Sulkowski JP, Nacion KM, Deans KJ, et al. Sacral nerve stimulation:a promising therapy for fecal and urinary incontinence and constipation in children[J]. J Pediatr Surg, 2015, 50(10): 1644-1647. DOI:10.1016/j.jpedsurg.2015.03.043. |
 2020, Vol. 19
2020, Vol. 19


