胸膜肺母细胞瘤(pleuropulmonary blastoma, PPB)是儿童较罕见的恶性胸部肿瘤,因临床与影像学表现无特异性,常易误诊为先天性肺气管发育畸形、纵膈肿瘤等[1-4]。该病的误诊率高,诊治困难,预后不良。2014年8月至2018年1月西北妇女儿童医院收治4例PPB患儿,本文旨在总结其临床表现及诊治经验,以提高医生对该病的认识和诊治能力。
4例患儿均为男童,年龄最小者1岁9个月,最大者4岁7个月。临床表现主要有发热、咳嗽、气促、多汗等呼吸道感染症状,有转移者出现纳差、胸痛、关节痛、体重减轻等症状。4例患儿临床资料见表 1。
|
|
表 1 4例胸膜肺母细胞瘤患儿的临床资料 Table 1 Clinical profiles of four PPB children |
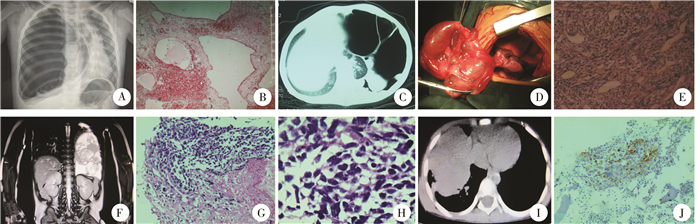
病例1:胸部X线片提示单一巨大囊性病变(图 1A)。术中见右下肺巨大囊性肿块,行右下肺囊肿切除术。病理标本大体见单个囊腔,病理检查镜下见囊内衬单层立方上皮,形态无特殊,囊壁间质内可见多量小圆形蓝染幼稚细胞,免疫组化VIM(+)(图 1B)。病理诊断为Ⅰ型PPB。手术完整切除肿瘤,术后3个月随访无复发。
|
Download:
|
| 图 1 4例患儿的影像学和病理检查结果A:胸片示右肺巨大囊肿、纵膈移位;B:囊壁间质内可见多量小圆形蓝染幼稚细胞;C:胸部CT平扫示多发囊腔,大小不一;D:术中见肿瘤呈多囊状,壁薄,与正常肺组织少许粘连;E:病理检查见囊腔样病变,囊壁间质内可见多量小圆形或梭形幼稚细胞,部分呈横纹肌分化; F:胸部MRI示肿瘤巨大,有边界,囊实性,分叶状;G:病理检查示小圆形、梭形细胞密集分布,呈巢状(HE×100); H:病理检查示小圆形、梭形细胞,胞浆少,核深染,异形明显(HE×400); I:胸部CT示肿瘤巨大,实性,密度不均,CT值20~50 Hu; J:病理检查骨髓穿刺涂片见成簇小圆蓝性肿瘤细胞,呈圆形及短梭子形,异型明显,Vim染色+(HE×100) Fig. 1 Imaging and pathological examinations of four PPB children | |
病例2:胸部CT肺窗显示肺呈多囊性改变(图 1C)。术中见病变肺组织为壁薄的多囊性肿块(图 1D),孤立生长,与正常肺组织边界清楚,少许纤维索带与正常肺组织相连, 完整切除病变。病理检查见囊腔样病变,囊壁间质内可见多量小圆形或梭形幼稚细胞,部分呈横纹肌分化(图 1E)。免疫组化:DES(+);ACT(+)。病理诊断为Ⅰ型PPB。手术完整切除肿瘤,术后随访1年无复发。
病例3:MRI检查显示病变为囊实性包块,有边界,包块大量分割,密度不均匀,挤压包块使周围组织移位(图 1F)。术中见肿瘤局部有包膜,无包膜部分与胸壁、肺组织粘连。病理标本大体见肿物局部似有包膜,灰白,见明显黏液样变性的结节。镜下见成片短梭形密小的细胞构成,排列成血管外皮瘤样结构,核分裂像易见,内见结节状成片的坏死及黏液样变性(图 1G)。免疫组化:VIM(+);DES(+);CD34(+);SMA(-);CK(-)(图 1H)。病理诊断为Ⅱ型PPB。完整切除肿瘤后,转肿瘤血液科化疗,目前仍在后续治疗中。
病例4:胸部CT纵隔窗显示有边界的实性肿块,椭圆形,周围骨质破坏影,伴胸腔积液。包块内部密度不均匀,CT值为20~50 Hu(图 1I)。该患儿头颅CT及四肢长骨X线检查见颅骨、下肢骨破坏影。骨髓穿刺涂片见成簇小圆蓝性肿瘤细胞,呈圆形及短梭子形,异型明显(图 1J)。免疫组化:VIM(+);SMA(-);CK(-)。病理诊断为Ⅲ型PPB。考虑该患儿已有远处转移,行包块穿刺及骨髓穿刺病理检查明确诊断后,家属要求转至陕西省肿瘤医院继续治疗,后失访。
讨 论PPB是儿童罕见的胸部恶性肿瘤,早期被认为是肺母细胞瘤(Pulmonary blastoma,PB)的一个亚型。1988年Manievl和Priest等[5]提出不同于成人PB,PPB有其自身的组织学特征及免疫组化表型。PPB于1989年被确定为临床上一个独立的病种。1995年,Dehner等[6]根据生物学特性将PPB分为3型:Ⅰ型囊性;Ⅱ型囊实性;Ⅲ型实性。2006年开始提出第四型Ⅰr型, Ⅰr型肿瘤囊壁内含有少量梭形细胞及少量营养不良性钙化灶,上皮下无原始恶性细胞聚集,有自然消退的趋势,无恶性进展[1]。
PPB患儿主要表现为气促、咳嗽、发热等呼吸道感染症状,以及纳差、胸痛、骨关节痛等恶性肿瘤转移及周围组织侵蚀的表现。大宗病例分析PPB没有性别和左右侧胸部发病的差异[7, 8]。本组4例患儿从Ⅰ~Ⅲ型年龄呈现逐渐增加,似乎表明年龄与疾病类型存在相关性,但因病例数少,其统计学意义尚不明确。PPB好发于肺周边或胸膜及纵隔,起源于间叶组织,具有母细胞及肉瘤的成分,无胎儿性腺癌及桑葚样结构,无肿瘤性上皮成分,瘤细胞为梭形、小圆形幼稚细胞,核分裂多见。免疫组化:VIM(+);DES(+);CD34(+);SMA(-);CK(-)。从Ⅰ~Ⅲ型肿瘤细胞越密集,瘤体从囊性变为实性,恶性程度越高。本组4例患儿,从临床表现、影像学改变、病理所见均符合诊断。
先天性肺气管发育畸形与PPB之间存在的演变关系已被大量报道[9-12]。肺囊性腺瘤样畸形可演变为Ⅰ型,继而经过2~4年可进展成Ⅱ型,然后进一步恶化为Ⅲ型,而复发和转移的PPB更多表现出Ⅱ型及Ⅲ型的生物学特性。Ⅰ型与先天性肺囊性腺瘤样畸形极难鉴别,有意义的特征是Ⅰ型好发于肺外周,更容易形成气胸,常见于婴幼儿[11-14]。本组2例Ⅰ型患儿,病变均位于肺外周。Ⅱ型及Ⅲ型需要与畸胎瘤、神经母细胞瘤、淋巴瘤等纵膈肿瘤相鉴别。本组3例患儿术前考虑畸胎瘤,术后病理检查证实为Ⅱ型PPB,故予以化疗。PPB可起源于肺内,有边界,少见钙化,肿瘤巨大,纵膈移位多见,局部淋巴结转移少,临近骨破坏及远处骨转移发生较多也是其鉴别要点[6-8, 15]。本组1例Ⅲ型PPB发现时即远处转移,以下肢骨骼为主,并有颅骨破坏。文献报道转移部位依次为大脑、骨骼、淋巴结、肝脏、胰腺、肾脏及肾上腺。此外,25% ~40%的PPB患儿表现出家族性肿瘤病史,其亲属可发生横纹肌肉瘤、软骨结节瘤、肾囊肿、甲状腺肿瘤、生殖细胞瘤和先天性肺发育不良等多种肿瘤,这可作为鉴别诊断的线索之一[1, 4, 13, 16, 17]。
PPB临床误诊率极高,早期诊断与综合治疗是此病获得良好预后的关键。治疗原则是彻底切除原发肿块,辅以化疗或放疗的综合治疗方案[1, 4, 13, 16, 18]。如肿瘤来源于肺脏,行肺叶切除或全肺切除术。如来源于纵膈或横膈、胸壁,则尽量完整切除肿瘤。考虑到肺囊性腺瘤样畸形与PPB及各亚型之间的关联性,对于婴幼儿肺囊性腺瘤样畸形,建议尽早手术切除。Ⅰr型如能完整切除,可不予化疗,其它类型均需化疗。化疗药物及方案多样,世界PPB登记中心(www.ppbregistry.org)推荐的化疗方案是:长春新碱(1.5 mg/m2),每周1次,共7周。异环磷酰胺(2 g/m2)第1、4、7周的前5天每天1次,阿霉素D(1.5 mg/m2)第1周和第7周的第1天。放射治疗用于化疗效果不佳或复发的病例。清髓性化疗后采用自体造血干细胞移植,以克服剂量限制性毒性作用,并有利于增加化疗药物的剂量。预后主要与肿瘤分型、是否完整切除、是否远处转移有关;与肿瘤大小、是否合并胸腔积液无关。Ⅰr型预后最好,Ⅰ型好于Ⅱ型,Ⅲ型预后最差。本组2例Ⅰ型术后未化疗,目前考虑Ⅰr型;1例Ⅱ型化疗。例1和例2分别随访3个月和1年,无复发症状。例3患儿在血液肿瘤科化疗中,目前仍处后续治疗中。例4Ⅲ型患儿失访,故不能准确判断预后。
综上所述,PPB是小儿较罕见的胸部恶性肿瘤,随着病理诊断准确性的提高,其发病率较前增加,对其认识也在不断地加深。临床上需要与先天性肺气管发育畸形、畸胎瘤、神经母细胞瘤等相鉴别。PPB不同分型、影像学表现与预后有很大关系,早期综合性治疗是获得良好预后的关键。
| 1 |
Messinger YH, Stewart DR, Priest JR, et al. Pleuropulmonary blastoma:a report on 350 central pathology-confirmed pleuropulmonary blastoma cases by the International Pleuropulmonary Blastoma Registry[J]. Cancer, 2015, 121(2): 276-285. DOI:10.1002/cncr.29032. |
| 2 |
牛会林, 王凤华, 刘威, 等. 儿童肺部病变215例临床病理学分析[J]. 中华病理学杂志, 2015, 44(9): 648-650. DOI:10.3760/cma.j.issn.0529-5807.2015.09.008. Niu HL, Wang FH, Liu W, et al. Pediatric lung lesions:a clinicopathological study of 215 cases[J]. Chin J Pathol, 2015, 44(9): 648-650. DOI:10.3760/cma.j.issn.0529-5807.2015.09.008. |
| 3 |
Chadli-Debbiche A, Brahim EB, Jouini R, et al. Pleuropulmonary blastoma:Cystic tumour misdiagnosed as an emphysematous bulla[J]. Respiratory Medicine CME, 2010, 3(2): 120-122. DOI:10.1016/j.rmedc.2009.02.007. |
| 4 |
Venkatramani R, Malogolowkin MH, Wang L, et al. Pleuropulmonary blastoma:a single-institution experience[J]. J Pediatr Hematol Oncol, 2012, 34(5): e182-e185. DOI:10.1097/MPH.0b013e3182546adf. |
| 5 |
Manivel JC, Priest JR, Watterson J, et al. Pleuropulmonary blastoma:the so-called pulmonary blastoma of childhood[J]. Cancer, 1988, 62(8): 1516-1526. DOI:10.1002/1097-0142(19881015)62:8<1516::AID-CNCR2820620812>3.0.CO;2-3. |
| 6 |
Priest JR, McDermott MB, Bhatia S, et al. Pleuropulmonary blastoma:a clinicopathologic study of 50 cases[J]. Cancer, 1997, 80(1): 147-161. DOI:10.1002/(SICI)1097-0142(19970701)80:1<147::AID-CNCR20>3.0.CO;2-X. |
| 7 |
张楠, 伏利兵, 周春菊, 等. 儿童胸膜肺母细胞瘤临床病理学观察[J]. 中华病理学杂志, 0144, 3(11): 747-749. DOI:10.3760/cma.j.issn.0529-5807.2014.11.007. Zhang N, Fu LB, Zhou CJ, et al. Clinicopathological observations of pleuropulmonary blastoma in children[J]. Chin J Patholo, 0144, 3(1): 747-749. DOI:10.3760/cma.j.issn.0529-5807.2014.11.007. |
| 8 |
Yu L, Cheng H, Yang SJ. Clinicopathological and extensive immunohistochemical study of a type Ⅱ pleuropulmonary blastoma[J]. Fetal Pediatr Pathol, 2014, 33(1): 1-8. DOI:10.3109/15513815.2013.839011. |
| 9 |
Shivastava R, Saha A, Mehera B, et al. Pleuropulmonary blastoma:transition from type Ⅰ(cystic)to type Ⅲ (solid)[J]. Singapore Med J, 2007, 48(7): 190-192. |
| 10 |
Nagre SW, Bhosle KN, Shaikh A, et al. Pleuropulmonary blastoma:a case report and review of literature[J]. Indian J of Tho and Cardio Surg, 2018, 34: 72-75. DOI:10.1155/2014/509086. |
| 11 |
Priest JR, Williams GM, Hill AD, et al. Pulmonary cysts in early childhood and the risk of malignancy[J]. Pediatr Pulmonol, 2009, 44(1): 14-30. DOI:10.1002/ppul.20917. |
| 12 |
Coleman A, Kline-Fath B, Stanek J, et al. Pleuropulmonary blastoma in a neonate diagnosed prenatally as congenital pulmonary airway malformation[J]. Fetal Diagn Ther, 2016, 39(3): 243-247. DOI:10.1159/000365352. |
| 13 |
Christova IR, Avramova BE, Arebov RS, et al. Diagnosis and treatment of pleuropulmonary blastoma:single center experience[J]. Pediatr Pulmonol, 2015, 50(7): 698-703. DOI:10.1002/ppul.23047. |
| 14 |
Mammas I, Koutsaftiki C, Tapaki-Papadopoulou G, et al. Pneumothorax in a Child with Pulmonary Blastoma[J]. J Pediatr, 2011, 159(1): 162. DOI:10.1016/j.jpeds.2010.12.056. |
| 15 |
李小会, 唐文伟, 管红, 等. 儿童胸膜肺母细胞瘤五例的CT表现[J]. 中华放射学杂志, 2013, 47(10): 945-946. DOI:10.3760/cma.j.issn.1005-1201.2013.10.018. Li XH, Tang WW, Guan H, et al. Computed tomographic manifestations of pleuropulmonary blastoma in children[J]. Chin J Radiolo, 2013, 47(10): 945-946. DOI:10.3760/cma.j.issn.1005-1201.2013.10.018. |
| 16 |
Bisogno G, Brennan B, Orbach D, et al. Treatment and prognostic factors in pleuropulmonary blastoma:An EXPeRT report[J]. Eur J Cancer, 2014, 50(1): 178-184. DOI:10.1016/j.ejca.2013.08.015. |
| 17 |
唐建, 范凯, 王建军, 等. 小儿纵隔肿瘤的临床特征与外科治疗[J]. 临床小儿外科杂志, 2010, 9(2): 104-106. DOI:10.3969/j.issn.1671-6353.2010.02.09. Tang J, Fan K, Wang JJ, et al. Clinical features and surgical treatments of pediatric mediastinal tumors[J]. J Clin Ped Sur, 2010, 9(2): 104-106. DOI:10.3969/j.issn.1671-6353.2010.02.09. |
| 18 |
Lorena FM, Villegas JA, Santamaría I, et al. Identification of somatic and germ-line DICER1 mutations in pleuropulmonary blastoma, cystic nephroma and rhabdomyosarcoma tumors within a DICER1 syndrome pedigree[J]. BMC Cancer, 2017, 17(1): 146. DOI:10.1186/s12885-017-3136-5. |
 2019, Vol. 18
2019, Vol. 18


