儿童门静脉高压症临床表现与成人相似,也是以脾脏肿大、脾功能亢进、食管胃底静脉曲张破裂出血为主要症状。根据其肝外或肝内梗阻因素需要制定相应诊疗方案。小儿非肝硬化性门静脉高压症多系肝外门静脉阻塞所致,Rex手术在肠系膜上静脉和门静脉系统之间架桥形成分流,由于分流后内脏的血液流入肝脏且重建门静脉的生理灌注,被认为是治疗儿童肝前型门静脉高压的标准治疗方法[1];但是,对于肝炎后肝硬化和先天性肝纤维化等肝脏病变所造成的肝内型门静脉高压症,由于门体静脉分流术可产生难以预测的血栓形成或失去肝脏灌注作用,被认为是不符合生理规律的。目前,针对静脉曲张的内镜套扎或注射硬化剂治疗已成为预防和治疗食管静脉曲张破裂出血的首选方法。然而,随着患儿年龄增长,门静脉高压症的持续作用会逐渐加重脾脏肿大,表现为伴有全血细胞减少的脾功能亢进,严重贫血会阻碍生长发育,这就需要采用更为复杂的外科手术干预取代保守治疗,脾切除术是一种可迅速产生效果的成熟技术,但术后同时也存在着较高的门静脉系统血栓发生率和暴发脓毒血症的风险[2]。随着腹腔镜技术的进步,脾部分切除术已较成熟,该手术既可减少门静脉血栓形成和暴发感染的风险,又可缓解脾功能亢进症状[3, 4]。基于此,本研究通过回顾腹腔镜脾大部分切除联合选择性贲门周围血管断流术治疗的7例肝内型门静脉高压症伴发脾功能亢进和食管静脉曲张出血患儿的临床资料,总结治疗经验,现报告如下。
材料与方法 一、临床资料收集2010年5月至2018年10月由河北医科大学第二医院收治的7例肝内型门静脉高压症患儿作为研究对象,所有患儿因顽固性静脉曲张出血和继发性脾功能亢进症而实施腹腔镜脾大部分切除联合选择性贲门周围血管离断术。7例患儿中,男童4例,女童3例;年龄9~16岁。经超声和CT检查诊断为肝硬化,最终通过腹腔镜下切取肝组织活检来明确。7例肝内型门静脉高压症患儿的临床资料见表 1。
|
|
表 1 肝内型门静脉高压症患儿临床资料 Table 1 Cilinial data of intrahepatic portal hypertension |
脾大部分切除术的适应证是巨脾引起腹部不适、脾功能亢进发展为顽固性血小板和白细胞减少。术前行多排螺旋CT检查,评估脾脏大小及脾血管解剖。
二、评估方法1.采用Child-Pugh分级评估肝脏储备功能[5]。
2.采用9.2 mm胃镜(GIF-H170, Olympus, Tokyo, Japan)评估食管胃底静脉曲张分级并进行套扎[6]。
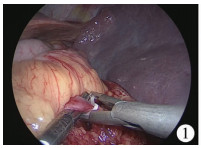
三、手术方法患儿静脉复合全麻气管内插管后取仰卧位,先经脐部切开3 cm切口入腹,直视下放置5~6 cm可塑切口保护套,然后安装带有中间12 mm、两侧5 mm 3个操作通道和2个进出气体通道的封盖,连接气腹机,建立CO2气腹,压力设定为10~12 mmHg。放入5 mm 30°加长腹腔镜(长度50 cm),以避免操作器械手柄与摄像头手柄在同一平面碰撞。调整手术台向右侧倾斜并呈头高足低便于显露脾脏。腹腔镜监视下于左腋前线脾下缘穿置5 mm套管作为主操作孔。对于脾脏巨大、上下径超过20 cm难于显露脾门者,则将脐部切口扩大至8~10 cm,放置10~12 cm可塑切口保护套用于手辅助腹腔镜手术。首先超声刀切开脾结肠韧带进入小网膜囊,在胰腺上缘分离解剖脾动脉主干近脾门处予以夹闭或结扎(图 1),然后离断脾肾韧带,剥离胰尾,使用吸引器钝性游离脾蒂血管,靠近脾门分离出脾上、下极分支血管,然后使用1-0丝线分别结扎,不切断脾胃韧带之胃短血管和脾膈韧带以保留胃底经脾上极组织向膈肌方向的分流,观察脾上极的活力,确定血供分界线,经左季肋部腋前线缝置悬吊线绕过脾上极由锁骨中线穿出体外,体外牵拉以增加显露并可控制脾脏断面出血,保留10% ~20%剩余脾组织,完成脾大部分切除,对断面较大血管予以夹闭或缝扎,渗血断面用1-0可吸收缝线贯穿缝扎,并与后外侧膈肌或腹膜缝合固定(图 2)。向右侧牵开胃大弯显露胃后壁及胃胰皱襞,继续采用超声刀离断胃后壁血管,切开胃胰皱襞沿胃后壁胃小弯分离紧贴胃壁离断穿支血管。然后,调整手术台向左侧倾斜显露肝胃韧带,沿胃小弯紧贴胃壁向食管裂孔裸化,切断胃左血管向贲门胃体的分支,随后切开膈食管膜裸化食管下端和贲门4~6 cm(图 3),目的是紧贴肌层离断贲门周围静脉丛和穿支静脉,保留胃冠状静脉的食管旁侧支静脉向奇静脉分流。当侧支血管或穿支静脉直径 < 5 mm时,可直接使用超声刀凝切功能离断,若血管明显扩张超过5 mm,则予以结扎后断离。最后,将切除脾组织放于标本袋中,经脐部切口牵出袋口,伸入手指或海绵钳破碎脾脏取出。经左侧戳孔导入引流管至脾床固定腹壁(图 4),缝合脐部切口结束手术。
|
Download:
|
| 图 1 胰腺上缘游离脾动脉夹闭 Fig. 1 Liberating and ligation of splenic artery at upper pancreatic margin | |

|
Download:
|
| 图 2 残余脾脏断面与季肋部缝合固定 Fig. 2 Suturing fixation of residual splenic surface to costal region | |

|
Download:
|
| 图 3 游离裸化贲门和食管下段 Fig. 3 Liberating cardia and lower esophagus | |

|
Download:
|
| 图 4 残脾创面放置引流管 Fig. 4 Implanting an irrigation tube over splenic wound | |
7例患儿均顺利完成腹腔镜脾大部分切除联合选择性贲门周围血管离断手术,4例完全腹腔镜下实施(210~260 min)、3例手辅助腹腔镜完成(155~180 min)。平均手术时间(204±46)min;术中失血量估计为50~330 mL,4例患儿因贫血严重需要输注2个单位洗涤红细胞。所有患儿术后恢复顺利,无围手术期并发症出现,术后住院7~9 d出院。术前白细胞、血小板和脾长径分别为(2.51±0.52)×109/L、(29.85±7.75)×109/L和(19.81±3.02)cm,术后白细胞、血小板和脾长径分别为(8.96±1.95)×109/L、(249.28±110.31)×109/L和(5.7±1.12)cm,差异有统计学意义(P < 0.05),见表 1。随访1~7年,其营养状态明显改善并健康成长。4例患儿复查电子胃镜发现食管静脉不同程度曲张而预防性套扎治疗1~3次,没有发生静脉曲张破裂出血、胃食管反流、食管裂孔疝及脓毒血症等并发症。定期超声检查证实脾残余组织血液供应良好,虽有不同程度体积变大,但没有脾功能亢进表现,且未见门静脉血栓形成。
讨 论儿童肝内型门静脉高压症早期治疗主要针对食管静脉曲张的处理,内镜下套扎或注射硬化剂已成为防治静脉曲张破裂出血的首选方法,这项技术易于操作且有效,既可在紧急情况下实施,也可择期使用。然而,随着病程的延长,静脉曲张仍反复发作,难以再予以套扎或注射硬化剂,再加上肝纤维化加重及脾功能亢进引起全血细胞减少,甚至影响生长发育时,外科手术干预被认为是可替代的治疗方法[7]。理想手术方法应有效控制再出血,维持肝功能,并可纠正严重脾功能亢进。随着微创外科技术的发展与进步,腹腔镜脾切除术和食管胃底周围血管断流术已成功开展。笔者团队曾报道门静脉高压症患儿行完全性脾切除加食管胃底静脉周围断流术的初级经验,脾切除术虽可迅速改善全血减少症的脾功能亢进,但完全脾切除术后会出现异常反跳,血小板异常增高并呈高凝状态,容易发生门静脉血栓形成,需要较长时间抗凝处理及口服抗血小板聚集药物[8];同时也失去脾脏免疫功能,增加术后远期感染脓毒血症的风险[9]。因此,应尽最大努力保留部分脾脏组织。这样促使我们改进腹腔镜脾大部分切除术来改善此类患儿预后。本组开展7例腹腔镜脾大部分切除术取得良好效果。
腹腔镜脾大部分切除术是一项具有挑战性的手术,特别是门静脉高压症患儿,术中经常发现脾脏巨大以及周围韧带侧支循环形成、静脉曲张,这些侧支血管会造成术中解剖和止血困难,严重的血小板减少也易导致解剖创面弥漫性出血[10]。为尽可能控制出血及便于游离脾脏,首先结扎脾动脉显得尤为重要,根据术前螺旋CT扫描脾血管成像及腹腔镜下脾蒂血管走形,在胰腺上缘或剥离胰尾后游离结扎或夹闭脾动脉、允许脾脏储存血液排空使巨脾缩小便于操作,并且可预防脾切除中可能出现的大出血。该类患儿脾大部分切除后,可减小脾脏对血细胞的破坏从而缓解脾功能亢进,同时保留脾膈韧带分流及残脾固定于侧后腹部利于建立脾向腹膜后分流,有助于降低门静脉压力,减少食管胃底静脉曲张。随访期间,所有患儿恢复良好,全血细胞减少被纠正,无感染情况发生,脾大小正常。
入路途径选择经脐单切口附加左侧腹一个主操作孔的杂交腹腔镜术式,经脐单切口放置腹腔镜通路装置便于切脾后取出,切口隐蔽于脐窝,瘢痕不明显,左侧腹附加一个操作孔更利于脾门显露,大大减少脾周围韧带解剖及贲门周围血管离断难度,并且增加了手术操作的安全性,手术完毕后还可以经此孔放置引流管作为观测窗口。另外,针对巨脾难以完全腹腔镜下操作,脐部扩大切口手助腹腔镜手术也是介于开腹手术与传统腹腔镜手术之间的一种杂交技术,既兼顾传统腹腔镜的微创效果又具有开腹手术直观易控的优点[11]。由于将手伸入腹腔,不仅恢复外科医生手的精细触觉,方便准确定位脾动脉走形及对贲门周围血管选择性离断的准确判断,而且对于巨脾也提供了更优的牵拉暴露效果,通过手助与腹腔镜下超声刀止血设备的良好配合,在意外出血的控制处理上更加容易、快捷,还可有效避免血管及邻近器官损伤,同时能最大限度地避免因出血导致的中转开腹手术[12]。本组病例中,手助与完全腹腔镜手术相比操作时间可减少1 h左右,体现了巨脾大部分切除术手助操作的优越性。
在完成腹腔镜脾大部分切除术的同时,根据门静脉高压症中侧支静脉分布的位置,可沿贲门和食管下段裸化、选择性离断周围侧支静脉和穿支静脉。食管周围侧支静脉靠近食管壁,而食管旁静脉远离食管壁,穿支静脉则穿过食管壁连接食管周围侧支静脉和食管旁静脉。为保留食管旁静脉的自然分流作用,通过裸化胃小弯、贲门及食管下段,选择性离断食管周围侧支静脉和穿支静脉,从而减少静脉曲张再出血[13]。与脾大部分切除同时完成更降低了手术的创伤,而且并未改变门静脉的流向,没有减少对肝脏的血流灌注。所有患儿术后都随访1~7年,没有出现肝衰竭、再出血及肝性脑病。与术前相比较,术后复查胃镜可见食管静脉曲张在1~3次套扎治疗后逐渐消失,多普勒超声检查可见门静脉的血流流向肝内和食管旁静脉。
总之,腹腔镜脾大部分切除术联合选择性贲门周围血管离断术是一项技术可行、疗效确切而且安全的外科手术,对于患有顽固性静脉曲张出血及继发于肝内型门静脉高压症严重脾功能亢进的患儿,值得实施这一微创手术来保留脾组织的重要免疫功能。
| 1 |
Guérin F, Bidault V, Gonzales E, et al. Meso-Rex bypass for extrahepatic portal vein obstruction in children[J]. Br J Surg, 2013, 100(12): 1606-1613. DOI:10.1002/bjs.9287. |
| 2 |
Bai DS, Qian JJ, Chen P, et al. Laparoscopic azygoportal disconnection with and without splenectomy for portal hypertension[J]. Int J Surg, 2016, 34: 116-121. DOI:10.1016/j.ijsu.2016.08.519. |
| 3 |
Seims AD, Breckler FD, Hardacker KD, et al. Partial versus total splenectomy in children with hereditary spherocytosis[J]. Surgery, 2013, 154(4): 849-853. DOI:10.1016/j.surg.2013.07.019. |
| 4 |
Costi R, Castro Ruiz C, Romboli A, et al. Partial splenectomy:Who, when and how.A systematic review of the [2130] publishedcases[J]. J Pediatr Surg, 2019, 54(8): 1527-1538. DOI:10.1016/j.jpedsurg.2018.11.010. |
| 5 |
苏有盛, 吴封. 内镜下食管静脉曲张套扎术后早期再出血的危险因素分析[J]. 中国医学工程, 2018, 26(1): 27-29. DOI:10.19338/j.issn.1672-2019.2018.01.008. Su YS, Wu F. Risk factors of early rebleeding after endoscopic variceal ligation[J]. China Medical Engineering, 2018, 26(1): 27-29. DOI:10.19338/j.issn.1672-2019.2018.01.008. |
| 6 |
中华医学会外科学分会门静脉高压症学组. 肝硬化门静脉高压症食管、胃底静脉曲张破裂出血诊治专家共识[J]. 中国实用外科杂志, 2015, 35(10): 1086-1090. DOI:10.7504/CJPS.ISSN1005-2208.2015.10.16. Group of Portal Hypertension Syndromes of CMA's Surgery Branch. Expert Consensus on Diagnosing & Treating Rupturing Hemorrhage due to Cirrhosis, Portal Hypertension & Gastroesophageal Varices[J]. Chinese Journal of Practical Surgery, 2015, 35(10): 1086-1090. DOI:10.7504/CJPS.ISSN1005-2208.2015.10.16. |
| 7 |
de Ville de Goyet J, D'Ambrosio G, Grimaldi C. Surgical management of portal hypertension in children[J]. Semin Pediatr Surg, 2012, 21(3): 219-232. DOI:10.1053/j.sempedsurg.2012.05.005. |
| 8 |
于增文, 李索林, 李英超, 等. 腹腔镜脾切除联合胃食管周围血管离断术治疗小儿门静脉高压症[J]. 临床小儿外科杂志, 2011, 10(4): 267-269. DOI:10.3969/j.issn.1671-6353.2011.04.009. Yu ZW, Li SL, Li YC, et al. Laparoscopic splenectomy and periesophagogastric devascularization with endoligature for portal hypertension in children[J]. J Clin Ped Surg, 2011, 10(4): 267-269. DOI:10.3969/j.issn.1671-6353.2011.04.009. |
| 9 |
Wang L, Xu J, Li F, et al. Partial splenectomy is superior to total splenectomy for selected patients withhemangiomas or cysts[J]. World J Surg, 2017, 41(5): 1281-1286. DOI:10.1007/s00268-016-3794-5. |
| 10 |
la Villeon B, Zarzavadjian Le Bian A, Vuarnesson H, et al. Laparoscopic partial splenectomy:a technical tip[J]. Surg Endosc, 2015, 29(1): 94-99. DOI:10.1007/s00464-014-3638-z. |
| 11 |
Kakinoki K, Okano K, Suto H, et al. Hand-assisted laparoscopic splenectomy for thrombocytopenia in patients with cirrhosis[J]. Surg Today, 2013, 43(8): 883-888. DOI:10.1007/s00595-012-0413-4. |
| 12 |
李永彬, 蔡云强, 孟令威, 等. 手辅助与全腹腔镜选择性贲门周围血管离断术的安全性评价[J]. 腹部外科, 2019, 32(2): 89-93. DOI:10.3969/j.issn.1003-5591.2019.02.004. Li YB, Cai YQ, Meng LW, et al. Safety evaluation of hand-assisted versus totallaparopic splenectomy combined with selective pericardial devascularization[J]. Abdomin Surgery, 2019, 32(2): 89-93. DOI:10.3969/j.issn.1003-5591.2019.02.004. |
| 13 |
Chen H, Yang F, Li TT, et al. Comparison of Efficacy of Laparoscopic and Open Splenectomy Combined With Selective and Nonselective Pericardial Devascularization in Portal Hypertension Patients[J]. Surg Laparosc Endosc Percutan Tech, 2018, 28(6): 401-403. DOI:10.1097/SLE.0000000000000581. |
 2019, Vol. 18
2019, Vol. 18


