门静脉高压是一组由门静脉压力病理性增高引起的症候群,根据门静脉血流梗阻的部位可将门静脉高压分为肝前性、肝性和肝后性。肝前性门静脉高压是指门静脉梗阻导致的门静脉高压,因梗阻位置绝大多数位于肝门静脉主干,因此,有时将其称为肝外门静脉梗阻(extrahepaticportal vein obstruction, EHPVO)。1869年, Gaetano等[1]首先对该病进行了描述,当门静脉主干或其分支出现部分或完全性梗阻后,门静脉压力增高,为缓解门静脉高压,在肝门周围形成大量向肝内分流的侧支循环,形态类似于海绵状血管瘤或血管畸形,这种形态学改变被称为门静脉海绵样变性(cavernous transformation of portal vein, CTPV)。EHPVO和CTPV是分别从病因学和形态学角度对肝前性门静脉高压进行描述。除了形成向肝性的侧支分流,为了减轻门静脉高压,在门静脉系统和体循环系统也会形成多支分流通路,最常见的是形成食管胃底静脉曲张,向奇静脉分流进入体循环系统,这些分流血管形成的静脉曲张是临床上消化道出血的解剖学基础。
一、概述EHPVO的病因尚不明确,目前多数学者认为与先天性门静脉发育畸形或后天性门静脉血栓形成等因素有关[2]。肝外门静脉梗阻的范围大多位于门静脉主干,有的仅仅局限在门静脉主干的末端,有的可以向远端波及到肝内门静脉系统,向近端波及到肠系膜上静脉和脾静脉,甚至形成广泛的门静脉系统栓塞。有幸的是,大多数肝外门静脉梗阻病变仅位于门静脉主干,因此,对大部分EHPVO的病人来说,可以进行Rex手术,并能取得良好的治疗效果。CTPV的病因可以是先天性或后天性因素导致的门静脉梗阻,是儿童最常见的门静脉高压类型。一般认为,CTPV占儿童全部门静脉高压的40% ~60%, 根据广州市妇女儿童医疗中心近5年的统计发现CTPV占全部门静脉高压的82%[3]。
肝前性门静脉高压的临床表现为消化道出血、脾大、脾功能亢进,由于门静脉血流瘀滞,还会引起门静脉高压性胃病和肠病,表现为营养障碍,进而可能造成生长发育迟滞;由于自发性或手术后引起的门腔静脉之间分流,可以引起血氨升高、学习能力下降、注意力不集中等肝性脑病的表现。除此以外,还可以出现肝肺综合征和肺动脉高压等。肝前性和肝内型门静脉高压的临床表现相似,但由于肝前性门静脉高压患儿肝脏本身无病变,肝功能良好,所以对消化道出血的耐受能力较好,肝性脑病的发生率更低,但由于长期的肝脏供血减少,肝功能也会逐步受到损害,晚期会出现门静脉高压性胆病(portal hypertensive biliopathy, PHB)、肝功能不良等。
二、肝前性门静脉高压手术方式的演变过去人们对于肝前性门静脉高压的治疗观点相对保守,曾经有学者提出,肝前性门静脉高压患儿会随着年龄的增长,门静脉系统高压和门腔自然分流可能会达到新的平衡,病人症状可能会逐渐减轻,不必采取过于积极的手术治疗。另外,肝前性门静脉高压患儿的肝脏本身没有病变,肝功能良好,对消化道出血的耐受性较强,出血病死率不高且明显低于肝内型门静脉高压,再加上传统手术治疗效果并不理想,这些都让人们的治疗观点更趋向于保守,在条件允许的情况下可以尽量采用非手术的保守治疗。
肝前性门静脉高压的传统手术方式与肝内型门静脉高压相同,主要包括断流术、分流术及两者相结合的联合术式。这些术式都是针对门静脉高压引起的消化道出血,脾大、脾功能亢进等症状的对症治疗,而不是针对病因的根治性治疗。由于门静脉海绵样变性病因的特殊性,其病变仅仅局限于梗阻的门静脉,有人曾经提出肝脾吻合等方法,设想可以使门静脉血流重新进入肝脏,但并没有成功[4]。由于传统手术方法治标不治本,且手术治疗效果并不令人满意,手术后消化道出血复发率较高,门静脉高压引起的肝性脑病、生长发育迟缓以及肝肺综合征、门脉性胆病等问题也不能很好解决[5]。因此,与正常儿童相比,肝前性门静脉高压患儿生活质量是下降的,病情严重的患儿还会常常受到消化道出血等严重并发症的威胁。
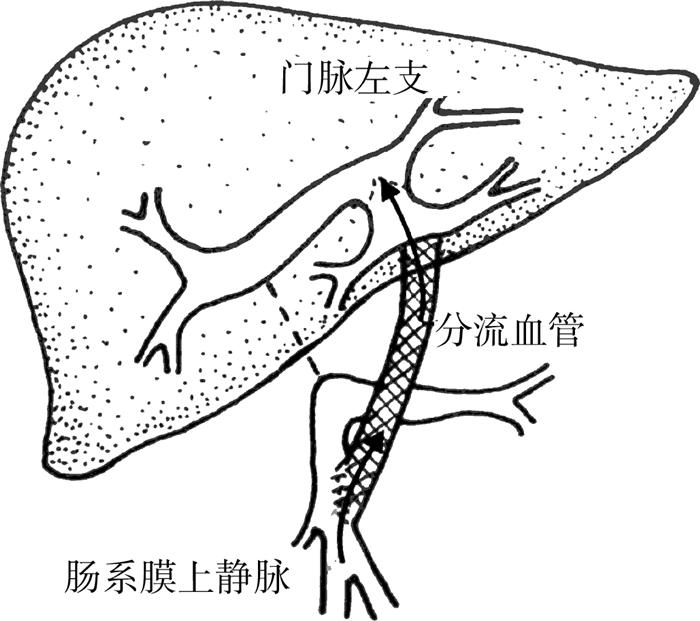
1992年比利时肝移植医生Jean de ville de goyt在处理1例肝移植术后门静脉血栓的患儿时,巧妙地设计了新的手术方法,将患儿的左侧颈内静脉自体移植到肝内门静脉左支Rex窝与肠系膜上静脉之间,从而使门静脉血流避开了梗阻的门静脉主干,重新进入肝脏,完美地解决了门静脉梗阻的问题,患儿术后恢复良好。该手术方式称为Meso-rex bypass(Rex手术),理论上来讲,Rex手术生理性恢复了门静脉血流,降低了门静脉压力,解除了门静脉高压状态,是根治性的手术方法(图 1)。后来,Rex手术进一步被应用到门静脉海绵样变性的肝前性门静脉高压患儿,并取得了相似的良好效果。1998年,De Ville De Goyet发表了7例Rex手术的相关报道,标志着肝前性门静脉高压的治疗进入了一个新的时代[6]。
|
Download:
|
| 图 1 Rex手术示意图 注 虚线示门静脉海绵样变性,箭头示血流经肠系膜上静脉与门静脉左主支之间的架桥血管进入肝脏 Fig. 1 Diagram of Mesorex bypass:dotted line indicated blocked portal vein and arrow showed portal venous flow into liver via bypass graft | |
Rex手术提出后很快得到了广泛应用,并且取得了良好的手术效果。Superina[7]报道34例Rex手术,手术成功率91%,搭桥血管通畅的病人均未发生消化道出血,脾脏缩小、脾功能亢进明显缓解,肝脏体积增大,凝血酶原时间恢复至正常。Bill[1]于2006年报道Rex手术后成功矫治由于近端脾肾分流造成的肝性脑病。Lautz[8]于2009年报道Rex手术后身高体重呈追赶式生长,生长发育迟缓得到纠正。Mack[9]于2006年报道Rex手术的患儿术后神经认知能力得到提高。Sharif[10]报道5年以上的长期随访结果,显示所有病人脾脏缩小,30%的患儿术后脾脏完全恢复正常,未见门静脉高压征象。由于Rex手术的效果显著,使肝前性门静脉高压的治疗发生了彻底的改变,在2015年意大利举行的门静脉高压Baveno Ⅵ共识研讨会上,有专家明确指出Rex手术可以作为门静脉高压并发出血的初级和次级预防手术方法。所谓初级预防就是在病人未出血时进行干预治疗,而次级预防是已经发生出血后的进一步预防措施。
三、手术前评估所有肝前性门静脉高压都应该评估是否可以接受Rex手术。但并不是所有肝前性门静脉高压患儿都可以完成该手术,Rex手术需要满足以下条件:明确诊断为门静脉海绵样变性;除肝脏病变以及血液的高凝状态以外,Rex窝通畅并且肝内门静脉系统发育良好,有可供吻合的通畅的肠系膜上静脉或脾静脉,有合适的搭桥血管等。约10%的CTPV患儿存在Rex发育不良或闭锁而不能完成Rex手术[7]。所有计划实施手术的患儿都要进行术前评估,包括凝血功能状态评估、血管评估和肝实质评估等。
EHPVO的诊断明确,并且排除了肝脏本身病变引起的肝内型门静脉高压是Rex手术的基本条件,对于诊断CTPV,但由于同时合并肝硬化或原发性门静脉高压(idiopathic PHT, IPH)的患儿, 不能作为Rex手术的适应证。简单的肝功能检查及影像学检查可以粗略地评估肝脏的状态,必要时需要行肝穿刺活检。虽然高凝状态在小儿并不常见,但术前有必要进行排查,包括:凝血酶原时间(PT)、部分凝血活酶时间(APTT)、国际标准化比值(INR)、抗凝血酶Ⅲ(AT Ⅲ)、凝血因子Ⅱ、Ⅴ、Ⅶ、和Ⅹ、蛋白C、蛋白S、凝血因子Ⅴ莱顿突变、凝血酶原片段Ⅱ、亚甲基四氯叶酸还原酶等[11]。需要说明的是,这些凝血因子缺乏往往是CTPV状态下肝脏缺血肝功能受损引起的,而不是造成门静脉血栓的原发因素,在Rex手术后,这些因子的缺乏往往可以得到纠正[12]。
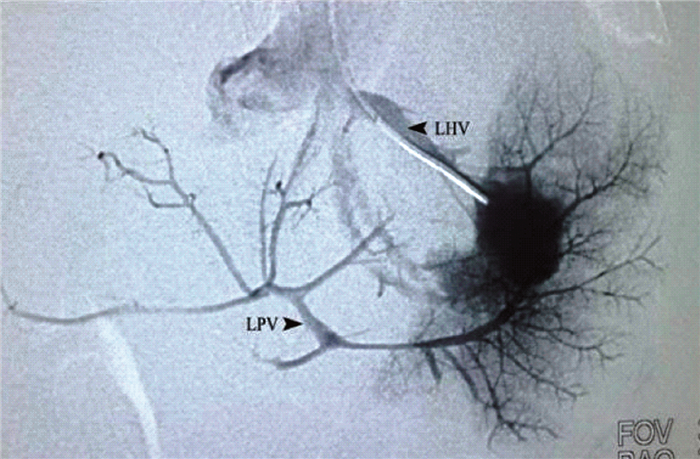
影像学检查是评估血管情况和制定手术方案的重要依据,包括腹部超声、颈部超声、CTA血管造影(CT angiography)、MRA磁共振血管造影(magnetic resonance angiography)及经肝静脉楔入逆行门静脉造影等。超声检查是CTPV最常用的诊断方法,具有无创、经济、便捷的优点。超声下显示门静脉主干消失,其周围可见呈血管团状结构的侧支循环形成,也可形成向肝的粗大侧支血管,形态迂曲。门静脉梗阻的部位多位于门静脉主干或门静脉入肝门处,较少累及脾静脉、肠系膜上静脉及肝内门静脉系统。需要用颈内静脉作为备选搭桥血管时,颈部超声可以了解双侧颈内静脉情况,血管畸形除外。CTA及MRA可以进一步明确门静脉系统的解剖形态学特点以及侧支循环形成情况。由于门静脉梗阻,肝内门静脉血流减少,血管不充盈,超声及CT、MR对肝内门静脉系统的显像较差,术前对Rex窝通畅性及肝内门静脉系统发育情况判断的准确性较低。术中经脐静脉再通后造影,可以将造影剂直接注入肝内门静脉系统并使之显影,但该方法是术中操作,不能做出术前的评估判断。肝静脉楔入造影(图 2)是用介入的方法,将导管置入肝静脉分支末端,高压注入造影剂使肝窦充盈,并逆行进入低压的肝内门静脉系统,该方法在术前进行,可以作为术前评估Rex窝是否通畅及评估肝内门静脉系统情况的方法[13]。但该检查是有创的,需要严格把握检查指征。
|
Download:
|
| 图 2 经肝静脉楔入逆行门静脉造影 Fig. 2 Transjugular wedged hepatic venous portography | |
手术前要根据术前评估和影像学检查设计手术方案,对肝前性门静脉高压需要考虑Rex手术的可行性[14]。对于肝前性门静脉高压并发消化道出血或严重脾功能亢进(血小板 < 10×109/L)的患儿,具有绝对的手术指征,对Rex手术可行性的判断可以在手术当中做出,手术探查作为判断Rex窝是否通畅的金标准,当不能行Rex手术时,可以行远端脾肾分流(Warren术式)。Warren手术为选择性分流手术,可以有效降低脾胃区的门静脉压力,预防食管胃底静脉曲张出血,同时保证肠系膜区的血流入肝,保证肝脏的门静脉血供,其手术效果优于非选择性分流。如果没有Warren手术的条件时,可以考虑非选择性分流,如近端脾肾分流、肠腔分流等术式。肠腔分流属于中心型分流,分流量较大,即使限制吻合口直径也难以准确控制分流量,容易诱发肝性脑病,在儿童门静脉高压中应用不多。在分流手术不能实施时,可以选择断流术,如贲门胃底周围血管离断手术。单纯脾切除手术不适合儿童肝前性门静脉高压的治疗,只能暂时缓解症状,但病人会存在暴发性败血症的风险[14]。
对于没有出血病史的患儿,可以进行预防性Meso-rex bypass手术,但术前需要进行更加详细的评估,尤其对Rex窝的通畅性进行评估。经肝静脉逆行门静脉造影是有效的评估方法,当造影显示Rex窝存在,且肝内门静脉系统显示良好时,可以进行预防性手术[14]。对于曾经有门静脉高压手术史的患儿,手术方案的设计需要更加缜密。这种情况下,Rex手术仍然是首选术式,术前判断Rex手术的可行性显得更有实际意义。如果曾行脾切除断流手术,当脾静脉仍然通畅没有血栓时,可以利用脾静脉作为Rex手术的搭桥血管。不能行Rex手术时,需要考虑其他分流手术或断流术。门静脉高压合并肝肺综合征、肺动脉高压是Rex手术的适应证,但不适合做Warren手术,当患儿不能行Rex手术时,需要考虑肝移植手术。对经过多次手术后难以再实施手术治疗的患儿,可以考虑采用药物或内镜保守治疗。在成人,内镜下套扎及普洛萘尔等非选择性β受体阻滞剂药物治疗已经作为初级和次级预防出血的首选措施[14]。但小儿门静脉高压,由于病因与成人不同,且目前尚缺乏充分的循证医学证据,这些方法在Baveno Ⅵ共识中并未被作为推荐的治疗方案[14]。对其他方法治疗无效的患儿,肝移植可以作为最终的治疗方式。
五、Rex手术搭桥血管的选择Rex手术在提出之初,是应用颈内静脉作为搭桥血管,这是Rex手术的经典方式。但由于手术需要舍弃一条颈内静脉,并且增加了腹部之外的手术切口,这成为该手术方式的弊端。除此以外,如果合并颈内静脉畸形,仅有单侧颈内静脉时就不能选择该血管。基于以上原因,人们尝试了多种改良术式,搭桥血管包括:胃冠状静脉、肠系膜下静脉、胃网膜静脉、脾静脉、大隐静脉、再通的脐静脉、人工血管等。目前,国际上最常应用的搭桥血管仍然为颈内静脉,部分学者认为颈内静脉的效果优于其他搭桥血管,有文献报道选择颈内静脉作为搭桥血管,手术后通畅率为84% ~96%,大隐静脉为71%,其他血管为67% ~70%[10, 15-18]。张金山等[19]研究发现冠状静脉成功率77.1%(37/48), 系膜血管间置(肠系膜下静脉、空肠静脉等)成功率88.5%(23/26),脾静脉成功率80%(4/5)。近年来组织工程发展迅速,人工血管作为搭桥血管的研究越来越多,此方法避免了额外的手术创伤,为搭桥血管的选择提供了一种新思路,但目前还有待进一步完善和成熟。本院共完成Rex手术61例,8例因Rex窝闭锁而改行Warren手术,搭桥血管通畅率达到93.4%(57/61)。我们的经验认为,应用改良方法的搭桥血管时,在血管条件符合应用标准的情况下,可以达到和颈内静脉相似的手术效果,如果胃冠状静脉条件良好,效果可以和颈内静脉等同。
六、手术相关并发症搭桥血管血栓形成是最严重的术后并发症,也是造成手术失败的主要原因。血栓形成最常发生于术后3~4个月,少数也可发生于术后1年之后。Luoto曾报道应用大隐静脉搭桥术后52个月发生移植血管栓塞[10, 16]。术后血栓形成与手术操作、血管选择、搭桥血管角度、张力、多次腹腔内手术严重粘连、瘢痕等多种因素有关[18, 19]。术后常规抗凝治疗是预防血栓形成的有效措施之一,但目前国际上并没有统一的抗凝方案。超声和CT检查是监测血管情况的可靠方法,术后常规监测搭桥血管的直径、血流速度等,及时发现异常情况,及早处理可能对预防血栓形成有一定帮助。
Rex手术后血管狭窄也是常见的并发症。Lautz等[20]报道86例Rex手术患儿,术后发生血管狭窄15例(17.4%),吻合口的肝端和肠系膜端均可发生狭窄。由于门静脉矢状部吻合处的血管细小,在肝端的吻合口更容易发生狭窄。目前对吻合口狭窄尚无统一的诊断标准,一般来说,吻合口直径 < 3 mm,临床上在门静脉高压症状缓解之后又出现脾脏增大、血小板下降、静脉曲张复现等情况时需要考虑吻合口狭窄。对于吻合口狭窄,血管介入扩张是首选的微创治疗方法,介入扩张失败时可以进行手术重新吻合。Lautz[20]报道15例吻合口狭窄患儿均进行了介入血管扩张治疗,其中9例(60%)一次性扩张成功,但3例(20%)需要再次扩张,20%扩张失败。本院61例Rex手术患儿,术后有5例出现吻合口狭窄,均发生于Rex手术左矢状部吻合口,经过扩张后均好转。介入血管扩张是治疗Rex术后并发吻合口狭窄的有效方法,可以避免再次手术。
Rex手术的应用,使门静脉高压的治疗发生了彻底变化,使肝前性门静脉高压成为可治愈性疾病,但目前对手术中搭桥血管的选择,术后血管栓塞、吻合口狭窄的处理,对Rex窝闭锁情况下能否有更好的替代方案等方面仍存在争议,需要进一步的探讨和研究。Rex手术的提出仅20年的历史,对于Meso-rex bypass手术后5年以上患儿的远期疗效已有少量文献报道,还需要进一步大样本和长期随访研究。
| 1 |
Chiu B, Superina RA. Encephalopathy caused by a splenorenal shunt can be reversed by performing a mesenteric-to-left portal vein bypass[J]. J Pediatr Surg, 2006, 41(6): 1177-1179. DOI:10.1016/j.jpedsurg.2006.01.075. |
| 2 |
Khanna R, Sarin SK. Idiopathic portal hypertension and extrahepatic portal venous obstruction[J]. Hepatol Int, 2018, 12(1): 148-167. DOI:10.1007/s12072-018-9844-3. |
| 3 |
Mascarenhas MI, Carneirod MM, Sande LP. Cavernous transformation of portal vein[J]. Acta Médica Portuguesa, 2012, 25(5): 340. DOI:10.3810/pgm.2012.09.2601. |
| 4 |
Vara-Thorbeck R, Maza-Inza J. Simultaneous treatment of portal hypertension and hepatic cirrhosis by splenohepatoplasty[J]. Surg Gynecol Obstet, 1978, 147(3): 391-396. |
| 5 |
Chiu B, Superina R. Extrahepatic portal vein thrombosis is associated with an increased incidence of cholelithiasis[J]. J Pediatr Surg, 2004, 39(7): 1059-1061. DOI:10.1016/j.jpedsurg.2004.03.051. |
| 6 |
de Ville De Goyet J, Alberti D, Clapuyt P, et al. Direct bypassing of extrahepatic portal venous obstruction in children:A new technique for combined hepatic portal revascularization and treatment of extrahepatic portal hypertension[J]. J Pediatr Surg, 1998, 33(4): 597-601. DOI:10.1016/s0022-3468(98)90324-4. |
| 7 |
Superina R, Bambini DA, Lokar J, et al. Correction of Extrahepatic Portal Vein Thrombosis by the Mesenteric to Left Portal Vein Bypass[J]. Ann Surg, 243(4): 515-521. DOI:10.1097/01.sla.0000205827.73706.97. |
| 8 |
Lautz TB, Sundaram SS, Whitington PF, et al. Growth impairment in children with extrahepatic portal vein obstruction is improved by mesenterico-left portal vein bypass[J]. J Pediatr Surg, 2009, 44(11): 2070. DOI:10.1016/j.jpedsurg.2009.05.016. |
| 9 |
Mack CL, Zelko FA, Lokar J, et al. Surgically Restoring Portal Blood Flow to the Liver in Children With Primary Extrahepatic Portal Vein Thrombosis Improves Fluid Neurocognitive Ability[J]. Pediatrics, 2006, 117(3): e405-e412. DOI:10.1542/peds.2005-1177. |
| 10 |
Sharif K, Mckiernan P, de Ville De Goyet J. Mesoportal bypass for extrahepatic portal vein obstruction in children:close to a cure for most![J]. J Pediatr Surg, 2010, 45(1): 276. DOI:10.1016/j.jpedsurg.2009.08.019. |
| 11 |
di Francesco F, Grimaldi C, de Ville de Goyet J. Meso-Rex Bypass-A Procedure to Cure Prehepatic Portal Hypertension:The Insight and the Inside[J]. J Am Coll Surg, 2014, 218(2): e23-e36. DOI:10.1016/j.jamcollsurg.2013.10.024. |
| 12 |
Superina R, Shneider B, Emre S, et al. Surgical guidelines for the management of extra-hepatic portal vein obstruction[J]. Pediatr Transplant, 2006, 10(8): 908-913. DOI:10.1111/j.1399-3046.2006.00598.x. |
| 13 |
Bertocchini A, Falappa P, Grimaldi C, et al. Intrahepatic portal venous systems in children with noncirrhotic prehepatic portal hypertension:Anatomy and clinical relevance[J]. J Pediatr Surg, 2014, 49(8): 1268-1275. DOI:10.1016/j.jpedsurg.2013.10.029. |
| 14 |
Shneider BL, de Ville de Goyet J, Leung DH, et al. Primary prophylaxis of variceal bleeding in children and the role of MesoRex Bypass:Summary of the Baveno Ⅵ Pediatric Satellite Symposium[J]. Hepatology, 2016, 63(4): 1368-1380. DOI:10.1002/hep.28153. |
| 15 |
Gehrke I, John P, Blundell J, et al. Meso-portal bypass in children with portal vein thrombosis:rapid increase of the intrahepatic portal venous flow after direct portal hepatic reperfusion[J]. J Pediatr Surg, 2003, 38(8): 1137-1140. DOI:10.1016/s0022-3468(03)00257-4. |
| 16 |
Luoto T, Pakarinen M, Mattila I, et al. Mesoportal bypass using a constructed saphenous vein graft for extrahepatic portal vein obstruction-technique, feasibility, and outcomes[J]. J Pediatr Surg, 2012, 47(4): 688-693. DOI:10.1016/j.jpedsurg.2011.10.065. |
| 17 |
Bhat R, Lautz TB, Superina RA. Perioperative strategies and thrombophilia in children with extrahepatic portal vein obstruction undergoing the meso-Rex bypass[J]. J Gastrointest Surg, 2013, 17(5): 949-955. DOI:10.1007/s11605-013-2155-z. |
| 18 |
Gibelli NE, Tannuri AC, Pinho-Apezzato ML, et al. Extrahepatic portal vein thrombosis after umbilical catheterization:is it a good choice for Rex shunt?[J]. J Pediatr Surg, 2011, 46(1): 214-216. DOI:10.1016/j.jpedsurg.2010.09.091. |
| 19 |
Zhang J, Li L, Cheng W. The optimal procedure of modified Rex shunt for the treatment of extrahepatic portal hypertension in children[J]. J Vasc Surg Venous Lymphat Disord, 2017, 5(6): 805-809. DOI:10.1016/j.jvsv.2017.02.011. |
| 20 |
Lautz TB, Kim ST, Donaldson JS, et al. Outcomes of Percutaneous Interventions for Managing Stenosis after Meso-Rex Bypass for Extrahepatic Portal Vein Obstruction[J]. J Vasc Interv Radiol, 2012, 23(3): 377-383. DOI:10.1016/j.jvir.2011.11.030. |
 2019, Vol. 18
2019, Vol. 18
