椎管内肿瘤是指原发于椎管内的肿瘤,其中原发性脊柱内肿瘤占全身肿瘤的4.6% ~8.8%[1, 2]。相比于其他部位肿瘤,椎管内肿瘤由于组织解剖结构复杂,手术难度大,风险较高。大多数患儿早期临床表现不明显,多以肢体疼痛、麻木及乏力为主。患儿因年龄小表述不清,常以尿床、粪污、不愿意爬行或站立为初始症状,但家长往往未能及时留意到患儿的此类表现,常选择进一步观察而延误治疗时机。随着脊髓受压的加重,患儿可能出现肢体感觉、运动以及大小便功能障碍等严重并发症,甚至造成部分截瘫或全身性截瘫,这将严重影响患儿的生活质量[3]。尽早明确诊断、积极改善脊髓压迫症状、降低患儿术后并发症发生率和病死率是临床上迫切需要解决的难题[4]。近年来,随着影像学和显微外科技术及神经电生理监测技术的快速发展,小儿椎管内肿瘤显微手术得以开展,显微手术在尽可能全部切除肿瘤的同时更大限度地保护了正常神经、血管组织,可有效改善患儿临床症状,提高其生活质量[5]。传统手术方式具有创面大、出血量多、容易损伤正常神经及血管组织等缺点,精细的显微外科操作技术对于椎管内肿瘤患儿的治疗显得尤为重要[6]。2018年2月至2019年1月湖南省儿童医院神经外科采用显微切除术治疗3例椎管内肿瘤患儿,现对其临床资料进行分析,旨在评价椎管内肿瘤显微手术的临床疗效,进一步为其在临床上的推广应用提供客观的理论依据。
材料与方法 一、临床资料选取2018年2月至2019年1月在湖南省儿童医院采用显微手术切除治疗的3例椎管内肿瘤患儿作为研究对象。3例均为男性,年龄分别为11个月、1岁8个月、11岁2个月。
3例患儿均以下肢运动障碍为首要表现,病例1因家长发现不喜站立2个月就诊,病例2因左下肢活动障碍2个月、加重5 d就诊;病例3自诉右下肢乏力伴麻木1个月就诊。3例患儿既往均无外伤史、手术史和中枢神经系统感染病史,入院前均未接受其他治疗。病例1术前双侧皮层电位(P40)未引出,其余患儿术前体感诱发电位及双下肢肌电图均正常。所有患儿术前膀胱残余尿量正常。肛门直肠测压检查均提示肛门直肠抑制性反射正常,患儿术后随访12个月。3例患儿的临床资料见表 1及表 2。
|
|
表 1 3例经显微切除术治疗的椎管内肿瘤患儿临床资料 Table 1 Clinical profiles of three cases of microsurgically resected intraspinal tumors |
|
|
表 2 3例患儿免疫组化结果 Table 2 Immunohistochemical results of 3 children |
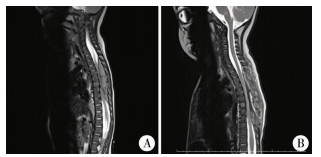
1.影像学检查:患儿术前、术后采用3.0MRI行肿瘤部位脊髓MRI检查(图 1)。患儿取仰卧位,均行横轴位、冠状位及矢状位扫描。3岁以下患儿无法主动配合检查,则在麻醉医师的指导下口服10%水合氯醛(0.5 mL/kg)镇静。MRI图像的阅片和报告均由放射科副高级及以上职称医师最终审核。
|
Download:
|
| 图 1 椎管内肿瘤患儿术前、术后MRI检查图 注 A:病例1术前MRI检查图;B:病例1术后MRI检查图 Fig. 1 Preoperative and postoperative MRI images | |
2.其他相关检查:患儿术前行双下肢体感诱发电位,双下肢肌电图、膀胱残余尿量和肛门直肠测压检查。
3.手术方法:患儿手术均由同一组医师完成。患儿取俯卧位,全身麻醉成功后,根据术前MRI检查显示的肿瘤椎体水平取正中入路,咬除相应水平棘突及椎板后,在显微镜及神经电生理监测下行椎管内肿瘤切除术。手术切除方式依据患儿术中情况(肿瘤是否有边界、位于硬膜外还是硬膜下、位于脊髓内还是脊髓外、与脊髓有无粘连)进行肿瘤完全的切除或部分切除与分离[7, 8]。仔细止血后反复冲洗创面至清亮,确认无出血后紧密缝合,逐层关闭切口。
三、观察指标对比分析患儿术前与术后3个月、6个月和1年的肢体疼痛麻木、乏力、粪污等脊髓压迫症状的改善情况。
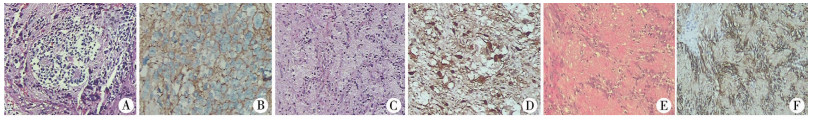
结 果 一、病理检查结果上述患儿组织病理报告分析显示神经鞘瘤1例,神经母细胞瘤2例,见图 2。
|
Download:
|
| 图 2 3例椎管内肿瘤患儿病理检查及免疫组化结果 A:病例1病理结果提示神经母细胞瘤(HE,×100);B:病例1免疫组化结果(×200); C:病例2病理结果提示神经母细胞瘤(HE,×100);D:病例2免疫组化结果(×200);E:病例3病理结果提示胸椎神经鞘瘤(HE,×100);F:病例3免疫组化结果(×200) Fig. 2 Results of pathological examination and immunohistochemistry | |
3例患儿术后肢体疼痛麻木、乏力等脊髓压迫症状均好转。所有患儿术后未出现排尿、排便功能障碍。
三、随访结果3例患儿均术后恢复良好,无一例死亡病例,有1例神经母细胞瘤患儿,术后1年复查脊椎MRI可见肿瘤复发,再次行手术治疗,其余2例患儿均未见复发,仍随访中。具体随访结果见表 3。
|
|
表 3 3例经显微切除术的椎管内肿瘤患儿的术后随访情况 Table 3 Postoperative follow-ups of three cases of microsurgically resected intraspinal tumors |
椎管内肿瘤由于解剖结构极为复杂,且压迫脊髓,易引发神经功能障碍,早期症状并不明显。多数患儿伴脊背部不适、大小便功能障碍、肢体疼痛、麻木或轻微疼痛感等临床表现,但因患儿年龄小往往表述不清而常被漏诊或误诊。随着病情进一步加重可导致患儿脊髓压迫而出现半身或全身性高位截瘫,甚至死亡[9, 10]。近年来,显微手术和影像学技术得到广泛应用,在显微镜和神经电生理监测的辅助下,手术医生可以仔细辨别判断神经组织和结缔组织,避免神经组织的误伤,减小术中血管损伤和出血,能够显著提升手术效果。采用显微切除术治疗椎管内肿瘤,对患儿神经功能的改善有着极其重要的意义[11]。
本研究对3例椎管内肿瘤患儿采用显微切除术进行治疗,对比分析患儿术前和术后3个月、6个月和1年肢体疼痛麻木、乏力、粪污等脊髓压迫症状的改善情况。结果表明,3例患儿临床症状和脊髓压迫症状均得到显著改善,患儿总体预后良好。有研究表明当患儿的临床症状较为明显时,椎管内肿瘤往往已经得到充分生长,肿瘤甚至可沿椎间孔从椎管内向椎管外生长。由于肿瘤周围解剖关系复杂,位置深,压迫周围血管、神经等组织的时间长,手术中难以完全切除肿瘤,是治疗的难点[11]。
结合本次的研究结果,采用显微切除术治疗椎管内肿瘤的经验如下:①术前充分了解肿瘤的大小和位置,确定手术入路方式。MRI检查能够清晰显示肿瘤与神经或血管之间的解剖结构,这不仅可以为手术切口的设计、肿瘤定位、手术方法的选择等提供重要、精确的信息,而且可以提高手术成功率,减少手术并发症[12]。②术中尽量不要破坏两侧上下关节突,以最大限度地维持脊柱稳定性。手术前应先根据MRI显示的肿瘤部位,以病变节段为中心做后正中直切口,切口范围最好包括可以咬除椎管内肿瘤上下级椎板,宽度不宜太宽。③术中应避免术中出血,避免血液进入蛛网膜下腔,以防止无菌性脑膜炎和蛛网膜粘连。建议在显微镜下纵行剪开硬脊膜及蛛网膜,剪开硬脊膜后可用线悬吊于两侧,并可在两侧覆盖脑棉片。④术中应尽量避免损伤神经根,当遇到肿瘤通过椎间孔进入椎管外侧时,可先做肿瘤的囊内分块切除,待瘤体缩小后再将肿瘤全部切除,因为如果沿肿瘤外包膜完整切除肿瘤可能会损伤神经根。⑤减少术后肿瘤复发的关键是处理好肿瘤与硬脊膜相连接的根部,建议切除硬脊膜内层,保留硬脊膜外层,这不仅可以降低术后脑脊液漏的发生概率,还可以降低肿瘤复发的概率。如肿瘤为椎管内外“哑铃型”时,应先切除肿瘤峡部,再切除位于硬膜下的肿瘤,最后切除位于椎管外肿瘤。在切除椎管外肿瘤时建议先在肿瘤体内分块切除,然后沿瘤周分离,最后完整切除肿瘤包膜。在椎管内外切除肿瘤的过程中,应在显微镜及神经电生理监测下进行,避免损伤神经根,预防术后并发症的发生。⑥显微镜下可以清晰地显露肿瘤与周围血管及神经组织之间的关系,有助于避免正常血管和神经的损伤,减少术后并发症的发生。此外在肿瘤切除过程中应尽量减少双极电凝对硬脊膜的烧灼,可避免烧灼后硬脊膜挛缩,从而降低术后脑脊液漏和硬膜下腔狭窄的发生率。
综上所述,临床上针对椎管内肿瘤患儿的显微全切术治疗方法已具备成熟的解剖学基础和临床技术,其安全性已得到广泛证实,能够有效减轻患儿的下肢疼痛麻木、乏力、粪污等脊髓压迫症状,可降低患儿术后复发和转移的发生率,减轻患儿心理压力,大大提高了患儿的生存和生活质量,值得临床推广应用。
| 1 |
Kawahara N, Tomita K, Murakami H, et al.Total en bloc spondylectomy for spinal tumors:surgical techniques and related basic background[J].Orthop Clin North Am, 2009, 40(1):47-63.DOI:10.10160.ocl.2008.09.004. http://www.sciencedirect.com/science/article/pii/S0030589808000709
|
| 2 |
李建民, 李振峰.中国脊柱肿瘤外科治疗存在问题及面临的挑战[J].中华骨科杂志, 2018, 38(10):577-579.DOI:10.3760/cma.j.issn.0253-2352.2018.10.001. Li JM, Li ZF.Issues and challenges in surgical treatments of spinal tumors in China[J].Chin J Orthop, 2018, 38(10):577-579.DOI:10.3760/cma.j.issn.0253-2352.2018.10.001. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhgkzz98201810001 |
| 3 |
鲁亚杰, 李明辉, 龙作尧, 等.国人脊柱原发肿瘤流行病学特征的Meta分析[J].中国脊柱脊髓杂志, 2018, 28(1):62-72.DOI:10.39690.issn.004·406X.2018.01.10. Lu YJ, Li MH, Long ZY, et al.Epidemiological characteristics of primary spinal tumors in China:a Meta-analysis[J].Chin J Spine Spinal Cord, 2018, 28(1):62-72.DOI:10.39690.issn.004·406X.2018.01.10.X.2018.01.10. |
| 4 |
Tomita K, Kawahara N, Murakami H, et al.Total en blo-cspondy-lectomy for spinal tumors:improvement of the technique and its associated basic background[J].J Orthop Sci, 2006, 11(1):3-12.DOI:10.10071s00776-005-0964-y.
|
| 5 |
沈慧勇, 黄霖, 杨睿, 等. 改良一期后路全脊椎整块切除术治疗胸脊椎肿瘤[J]. 中华骨科杂志, 2011, 3(1): 7-12. DOI:10.3760/cma.j.issn.0253-2352.2011.01.002. Shen HY, Huang L, Yang R, et al. Modified surgical techniques in total en bloc spondylectomy for thoracic and lumbar tumors with a single posterior approach[J]. Chin J Orthop, 2011, 3(1): 7-12. DOI:10.3760/cma.j.issn.0253-2352.2011.01.002. |
| 6 |
徐华梓, 池永龙, 水小龙.经后路全脊椎整块切除术治疗胸脊椎肿瘤[J].中国脊柱脊髓杂志, 2009, 19(4):268-272.DOI:10.39696.issn.1004·406X.2009.04.07. Xu HZ, Chi YL, Shui XL.Spondylectomny en bloc for thoracic and lumbartumors via Posterior approach[J].Chinese Journal of Spine & Spinal Cord, 2009, 19(4):268-272.DOI:10.39696.issn.1004-406X.2009.04.07. http://d.wanfangdata.com.cn/Periodical/zgjzjszz200904007 |
| 7 |
Tokuhashi Y, Matsuzaki H, Oda H, et al. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis[J]. Spine(Phila Pa 1976), 2005, 30(19): 2186-2191. DOI:10.1097/01.brs.0000180401.06919.a5. |
| 8 |
郭常安, 阎作勤, 张键, 等. 改良全脊椎切除技术后路一期切除胸椎肿瘤[J]. 中华骨科杂志, 2010, 30(5): 449-453. DOI:10.3760/cma.j.issn.0253-2352.2010.05.002. Guo CA, Yan ZQ, Zhang J, et al. Modified total en bloc spondylectomy for thoracic vertebra tumor through single posterior approach[J]. Chin J Orthop, 2010, 30(5): 449-453. DOI:10.3760/cma.j.issn.0253-2352.2010.05.002. |
| 9 |
Jimbo H, Kamata S, Miura K, et al. En bloc temporal bone resection using a diamond threadwire saw for malignant tumors[J]. J Neurosurg, 2011, 114(5): 1386-1389. DOI:10.3171/2010.8.JNSl0294. |
| 10 |
Chang SH, Park YG, Kim DH, et al. Monitoring of motor and somatosensory evoked potentials during spine surgery:intraoperative changes and postoperative outcomes[J]. Ann Rehabil Med, 2016, 40(3): 470-480. DOI:10.5535/arm.2016.40.3.470. |
| 11 |
Cheng JS, Ivan ME, Stapleton CJ, et al. Intraoperative changes in transcranial motor evoked potentials and somatosensory evoked potentials predicting outcome in children with intramedullary spinal cord tumors[J]. J Neurosurg Pediatr, 2014, 13(6): 591-599. DOI:10.3171/2014.2.PEDS1392. |
| 12 |
skinner SA, Vodusek DB. Intraoperative recording of the bulbocavemosus reflex[J]. J Clin Neurophysiol, 2014, 31(4): 313-322. DOI:10.1097/WNP.0000000000000054. |
| 13 |
宋启民, 费昶, 陈春美. 运动诱发电位对兔腹主动脉阻断脊髓损伤的预警[J]. 中华实验外科杂志, 2015, 32(6): 1386. DOI:10.3760/cma.j.issn.1001-90302015.06.062. Song QM, Fei C, Chen CM. Early warning of motor evoked potential for spinal cord injury induced by abdominal aorta occlusion in rabbits[J]. Chin J Exp Surg, 2015, 32(6): 1386. DOI:10.3760/cma.j.issn.1001-90302015.06.062. |
 2019, Vol. 18
2019, Vol. 18


