婴幼儿血管瘤(infantile hemangioma)是儿童最常见的血管源性良性肿瘤,发病率为4% ~5%,女性更为常见,主要发生在头颈部,也可发生在躯干和四肢[1]。该病患儿出生时可不表现出任何症状,但具有一定的发展规律。最初为增殖阶段,在30% ~50%的病例中可出现毛细血管扩张或红斑[2],8~12月龄后为缓慢消退阶段,消退过程可持续至患儿5~10岁[3]。根据血管瘤解剖学上的位置,可将其分为浅表型(约65%)、混合型(约15%)和深部型(约20%)。其中浅表型位于真皮上层,以红色丘疹、结节或斑块为主要表现形式[4]。虽然血管瘤属于良性病变,有一定自限性,但其有可能导致并发症,尤其是处于增生期时,需要早期干预[5]。
有研究表明595 nm脉冲染料激光(Pulsed Dye Laser,PDL)治疗血管源性疾病疗效显著,原理是通过血红蛋白优先吸收激光能量,然后将吸收的激光能量转换为热能,导致血管凝固,同时尽量减少周围正常表皮和真皮组织的损伤。目前PDL在临床工作中已经被广泛应用[6]。马来酸噻吗洛尔滴眼液作为非选择性β-肾上腺素受体阻滞剂,治疗婴幼儿血管瘤具有很好的应用前景,可以在提高疗效的同时减少全身性不良反应[7]。我们的研究旨在对比单独应用595 nm脉冲染料激光、单独应用0.5%噻吗洛尔滴眼液及两者联合应用3种不同方案治疗浅表性婴幼儿血管瘤的疗效。
材料与方法 一、临床资料 (一) 研究对象以2018年6月至2019年6月山东大学齐鲁儿童医院血管瘤科以及介入医学科收治的156例血管瘤患儿为研究对象,其中男48例,女108例,月龄(3.45±2.51)个月。根据不同治疗方案将患儿分为3组:①激光治疗组,采用595 nm脉冲染料激光治疗,共64例;②外敷治疗组,采用外敷0.5%噻吗洛尔滴眼液治疗,共60例;③联合治疗组,采用595 nm脉冲染料激光与0.5%噻吗洛尔滴眼液联合治疗,共32例。治疗前向患儿的父母或监护人详细说明治疗方案(包括每种治疗方案的优势及可能导致的并发症),治疗方案在服从治疗原则的基础上由父母或监护人选择。以上研究内容均符合医院伦理委员会要求。
(二) 纳入、排除标准纳入标准: ①参照《2016版血管瘤和脉管畸形诊断和治疗指南》诊断标准,结合病史、临床表现以及彩色多普勒超声结果最终确诊为血管瘤者[8];②浅表性血管瘤位于乳突状真皮层和(或)网状真皮层的血管瘤[9];③未经其他任何治疗;④瘤体处于低、中度风险的婴儿血管瘤;⑤浅表性血管瘤;⑥年龄 < 1岁、血管瘤厚度 < 3 mm者。
排除标准: ①瘤体位于特殊部位、存在严重毁容风险等高风险血管瘤;②深部、混合型或可能存在深部血管瘤;③接受过其他治疗(如口服普萘洛尔、激光、外敷噻吗洛尔、介入栓塞、冷冻、同位素等)者;④有β-肾上腺素受体阻断剂药物过敏史者;⑤窦性心动过缓、P-R间期延长以及房室传导阻滞病史及支气管哮喘病史者;⑥其他严重器质性病变(如先天性心脏病)者;⑦瘢痕体质者。
(三) 治疗结局与随访患儿治疗后均随访1个月。所有患儿每月进行门诊复查,拍摄照片留档并进行超声检查,评估瘤体颜色、大小,血流情况,治疗终点为疗效评级达到4级,治疗结果由两名经验丰富的临床医师根据照片记录及超声结果共同评估。
二、方法 (一) 治疗方式激光治疗组:使用美国Candela公司生产的Vbeam 595 nm脉冲染料激光系统,波长595 nm,光斑大小10 mm,能量密度6~8 J/cm2,脉冲持续时间1.5~40 ms,动态冷却系统固定喷雾时间为40 ms。治疗前常规清洁皮肤,将护目眼罩覆盖在患儿的眼眶上,防止患儿发生激光后损伤,待医生佩戴好护目镜后开始治疗,依据病变部位、类型、颜色、厚度以及患儿年龄、皮肤类型、皮肤对激光的反应选择合适的光斑大小、能量、脉宽及治疗间隔。采用垂直照射的方式,直至照射后皮损处呈现轻度紫癜。全疗程需要治疗1~5次,每4周1次,治疗结束后局部立即给予冰袋冷敷15~30 min,后给予贝复新或者物理抗菌敷料,如有水疱给予卤米松外用,保持治疗区清洁,持续5~7 d,在每次治疗后至少1周内避免阳光照射,以防止炎症后色素沉着,同时避免搔抓、摩擦。
外敷治疗组:清洁皮肤表面后,采取0.5%马来酸噻吗洛尔滴眼液治疗(商品名:博士伦;规格:5 mL、25 mg)。浸湿纱布敷于血管瘤部位,纱布全部湿透且不滴水,持续15~30 min,平均每日4次,治疗时间间隔为4周,必要时可用保鲜膜固定纱布,防止药液蒸发过快,同时避免药液接触周围正常皮肤。
联合治疗组: 595 nm染料激光使用方法同激光治疗组,并在激光治疗后1周联合0.5%马来酸噻吗洛尔滴眼液进行治疗(方法同外敷治疗组)。
(二) 评价标准治疗结果由两名专业的经验丰富的临床医师随访时根据照片记录及超声结果共同评估。根据视觉模拟量表得分从-10分到+10分评估外观,0分代表没有变化,正数(+)代表颜色变浅,负数(-)代表颜色变深。瘤体大小评估按照面积(瘤体的最大直径)减少率计算:减少率0% ~10%计1分,每多减少10%加1分,至减少率>90%计10分,瘤体增大计相应负分。超声测定血流情况:血流丰富计0分,血流较丰富计2分,斑片状血流计4分,斑点状血流计6分,稀疏点状血流计8分,未探及血流计10分。总计分为三项得分之和,等级按总得分进行评估,分为4级:< 10分判定为1级,10~18分判定为2级,19~27分判定为3级,>27分判定为4级。治疗前对所有病变部位进行测量并拍照,随后评估患处破溃、水疱、湿疹、干性皮炎、病变大小及颜色变化情况[10]。
三、统计学分析运用SPSS 23.0进行统计学分析。不同组别治疗有效率、并发症发生率的比较采用χ2检验,治疗时间的比较采用F检验。P<0.05为差异有统计学意义。
结 果 一、3组血管瘤患儿临床疗效对比共156例浅表性血管瘤患儿均遵医嘱完成治疗,其中激光治疗组64例,外敷治疗组60例,联合治疗组32例,各组年龄、性别,瘤体部位均不存在统计学差异(见表 1)。疗效评价为2、3、4级患儿瘤体的颜色、大小、血流情况均有不同程度的好转,达到本研究治疗终点时,已明显好转(图 1)。3组均有较高的有效率,其中激光治疗组95.3%(61/64),外敷治疗组95%(57/60),联合治疗组96.9%(31/32),3组间有效率差异没有统计学意义(P>0.05)。3组各级分数如图 2所示,最终疗效评价到达4级时,治疗更倾向完全去除病变,其中联合治疗组有一半以上(56.3%)患儿最终疗效评价达到4级,而外敷治疗组疗效4级者18.3%,激光治疗组为29.7%,因此3组疗效存在统计学差异(P < 0.05),联合治疗组中有更多患儿表现为病变完全去除,见表 2。对不同分组中疗效评价为4级的患儿进行治疗时间对比,发现3组治疗时间存在统计学差异(P < 0.05),见表 3。
|
|
表 1 3组患儿的基本临床资料 Table 1 Basic clinical profiles for three groups |
|
Download:
|
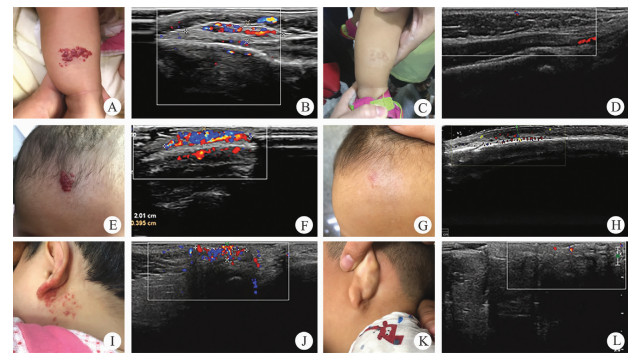
| 图 1 3组治疗前后照片和超声对比 A、B:激光治疗组治疗前照片及对应超声结果;C、D:激光治疗组治疗后照片及对应超声结果;E、F:外敷治疗组治疗前照片及对应超声结果;G、H:外敷治疗组治疗后照片及对应超声结果;I、J:联合治疗组治疗前照片及对应超声结果;K、L:联合治疗组治疗后照片及对应超声结果 Fig. 1 Comparisons of photos and ultrasound in three groups before and after treatments | |
|
|
表 2 3组疗效对比[n(%)] Table 2 Comparison of efficacy for three groups[n(%)] |
|
|
表 3 3组达到疗效等级为4级所需的治疗时间对比(x+s) Table 3 Comparison of treatment time for three groups(x+s) |
共28例患儿出现并发症,其中激光治疗组11例(17.2%),外敷治疗组12例(20%),联合治疗组5例(15.6%),但3组并发症发生率并没有显著性差异(P>0.05),见表 4。此外,3组均无一例出现心率过低、低血糖、哮喘、腹泻、睡眠改变、粒细胞减少等不良反应及其他严重并发症。
|
|
表 4 3组并发症对比 Table 4 Comparison of complications for three groups |
婴幼儿血管瘤是儿童常见的良性肿瘤,因血管内皮细胞异常增殖所致,其中女性、早产儿、低体重为其独立危险因素[6]。虽然婴幼儿血管瘤有自行消退趋势,但如果不及时接受治疗将有可能导致破溃、出血、感染,甚至造成永久性毁容、视力损害和气道阻塞等并发症[11]。传统治疗血管瘤的方法包括放射核素敷贴、手术切除、冷冻、局部封闭、硬化剂注射等,但多存在不良反应严重、副作用大等缺点,故临床应用受到限制。
自2008年Christine Léauté-Labrèze发现肾上腺素受体阻滞剂普萘洛尔可用于治疗婴幼儿血管瘤以来,口服普萘洛尔已逐渐成为婴幼儿血管瘤的一线治疗方案[12],同样作为β-肾上腺素受体阻滞剂的噻吗洛尔也被证明可用于临床婴幼儿血管瘤治疗。噻吗洛尔是一种FDA已批准用于治疗儿童青光眼的眼内用药,儿童眼科医师使用它治疗青光眼的历史已超过30年[13]。Guo S等于2010年首次报道使用马来酸噻吗洛尔滴眼液治疗4月龄婴儿眼睑血管瘤的成功案例[14]。口服普萘洛尔的不良反应主要包括嗜睡、低血压、心动过缓、低血压和呼吸暂停等[11],但极少有报道外用噻吗洛尔可导致严重并发症。本次研究发现浅表性婴幼儿血管瘤经外敷马来酸噻吗洛尔治疗后有效率达95%,并发症发生率为20%,主要包括干性皮炎、破溃、湿疹、色素沉着或减退,并没有出现严重并发症,与先前研究结果基本相符。
近年来PDL的临床使用越来越多,并逐渐成为浅表血管瘤公认的治疗方式[15, 16]。PDL应用于治疗葡萄酒色斑、毛细血管扩张症、婴儿血管瘤已经超过25年。一些研究证实了PDL治疗血管瘤的有效性,由于血管损伤的深度有限,PDL在浅表血管瘤的治疗中比深部病变效果更好,早期治疗可以减缓或抑制血管瘤的增殖生长阶段[17]。595 nm PDL还配有动态冷却装置系统,既可降低皮肤表面温度、避免激光热能对皮肤的损害,又能对皮肤进行冷却麻醉,达到减轻疼痛的目的。PDL治疗后并发症可表现为红斑、水肿、水泡形成,通常7~10 d后大部分会自发消退[18],大量研究证实PDL对皮肤血管性疾病疗效确切,且具有操作安全、不良反应少等优点[19]。595 nm PDL通过血红蛋白优先吸收激光能量,然后将吸收的激光能量转换为热能,导致血管凝固,但对病灶厚度有一定要求,对增厚型的病灶效果稍差,可能与595 nmPDL穿透深度有限、血管较深、血管数量多及管壁厚、影响激光对血管的穿透及凝固作用有关[19]。本研究仅仅纳入了血管瘤厚度 < 3 mm的患儿,排除瘤体本身厚度对研究结果的干扰,并发现PDL治疗浅表性婴幼儿血管瘤有效率为95.3%,并发症发生率为17.2%,主要表现为色素沉着、减退、脱失以及水泡产生,并未出现严重并发症(如疤痕、破溃等)。
Tawfik等[20]也在先前的研究中发现,与595/1 064 nm双波长PDL相比,噻吗洛尔溶液是治疗浅表性婴幼儿血管瘤相对安全、有效的替代方案。我们对每种方案的治疗结果进行进一步分级,发现联合治疗组疗效等级到达4级者占比56.3%,明显高于外敷治疗组的18.3%及激光治疗组的29.7%,这说明两者联合治疗效果更加理想。Kyung等[21]报道PDL与噻吗洛尔联用可增强治疗效果,PDL可能与扩散的噻吗洛尔在疗效上产生累加作用,进一步巩固疗效。继续对不同治疗组中疗效评级达到4级的患儿进行治疗时间的对比分析,发现两者联合的治疗时间明显缩短,这表示联合治疗能更快、更好地治疗浅表性婴幼儿血管瘤,同时不造成明显并发症。考虑原因为两者联合使用的情况下,0.5%噻吗洛尔滴眼液在持续作用于瘤体的同时,在PDL的作用下进一步使血管瘤萎缩、变薄、颜色变浅,治疗过程更加快速、有效;同时PDL还可以清除血管瘤伴发的毛细血管扩张,两者具有相互补充、增强疗效的作用。Kyung等[21]还预测PDL与噻吗洛尔联用有可能增加并发症发生率,这与本研究得到的结果不同,可能与联合治疗组治疗时间被缩短,减少了噻吗洛尔治疗持续时间和PDL的治疗次数有关。
综上所述,595 nm脉冲染料激光与0.5%噻吗洛尔滴眼液联合应用治疗浅表性婴幼儿血管瘤安全、有效,且两者联合治疗的疗效优于单独治疗。
| 1 |
Grzesik P, Wu JK. Current perspectives on the optimal management of infantile hemangioma[J]. Pediatric Health Med Ther, 2017, 8: 107-116. DOI:10.2147/PHMT.S115528. |
| 2 |
Dickison P, Christou E, Wargon O. A prospective study of infantile hemangiomas with a focus on incidence and risk factors[J]. Pediatric dermatology, 2011, 28(6): 663-669. DOI:10.1111/j.1525-1470.2011.01568.x. |
| 3 |
Rotter A, de Oliveira ZNP. Infantile hemangioma:pathogenesis and mechanisms of action of propranolol[J]. J Dtsch Dermatol Ges, 2017, 15(12): 1185-1190. DOI:10.1111/ddg.13365. |
| 4 |
Mendiratta V, Jabeen M. Infantile hemangioma:an update[J]. Indian J Dermatol Venereol Leprol, 2010, 76(5): 469-475. DOI:10.4103/0378-6323.69048. |
| 5 |
Luu M, Frieden IJ. Hemangioma:clinical course, complications and management[J]. Br J Dermatol, 2013, 169(1): 20-30. DOI:10.1111/bjd.12436. |
| 6 |
Zeng M, Shen S, Chen W, et al. Superficial hemangioma is better treated by topical 5-aminolevulinic followed by 595-nm pulsed dye laser therapy rather than 595-nm laser therapy alone[J]. Lasers Med Sci, 2017, 32(8): 1889-1893. DOI:10.1007/s10103-017-2304-9. |
| 7 |
Danarti R, Ariwibowo L, Radiono S, et al. Topical timolol maleate 0.5% for infantile hemangioma:its effectiveness compared to ultrapotent topical corticosteroids-a single-center experience of 278 cases[J]. Dermatology, 2016, 232(5): 566-571. DOI:10.1159/000448396. |
| 8 |
中华医学会整形外科分会血管瘤和脉管畸形学组. 血管瘤和脉管畸形诊断和治疗指南(2016版)[J]. 组织工程与重建外科杂志, 2016, 12(2): 63-97. DOI:10.3969/j.issn.1673-0364.2016.02.001. Department of Angiogenesis and Vascular Malformation, Chinese, Medical Association, Department of Plastic Surgery. Guidelines for Diagnosis and Treatment of Hemangioma and Vascular Malformation (2016 Edition)[J]. Journal of Tissue Engineering and Reconstructive Surgery, 2016, 12(2): 63-97. DOI:10.3969/j.issn.1673-0364.2016.02.001. |
| 9 |
Waner M, Suen JY. Management of congenital vascular lesions of the head and neck[J]. Oncology, 1995, 9(10): 989-994. |
| 10 |
Malik MA, Menon P, Rao KLN, et al. Effect of propranolol vs prednisolone vs propranolol with prednisolone in the management of infantile hemangioma:a randomized controlled study[J]. Journal of pediatric surgery, 2013, 48(12): 2453-2459. DOI:10.1016/j.jpedsurg.2013.08.020. |
| 11 |
Chen TS, Eichenfield LF, Friedlander SF. Infantile hemangiomas:an update on pathogenesis and therapy[J]. Pediatrics, 2013, 131(1): 99-108. DOI:10.1590/S0325-00752013000600014. |
| 12 |
Léauté-Labrèze C, Dumas de la Roque E, Hubiche T, et al. Propranolol for severe hemangiomas of infancy[J]. N Engl J Med, 2008, 358(24): 2649-2651. DOI:10.1056/NEJMc0708819. |
| 13 |
Frommelt P, Juern A, Siegel D, et al. Adverse events in young and preterm infants receiving topical timolol for infantile hemangioma[J]. Pediatric dermatology, 2016, 33(4): 405-414. DOI:10.1111/pde.12869. |
| 14 |
Guo S, Ni N. Topical treatment for capillary hemangioma of the eyelid using beta-blocker solution[J]. Arch Ophthalmol, 2010, 128(2): 255-256. DOI:10.1001/archophthalmol.2009.370. |
| 15 |
Gummi R, Stahl ED, Marsh JD. Topical timolol for an iris hemangioma[J]. J AAPOS, 2018, 22(2): 156-158. DOI:10.1016/j.jaapos.2017.10.015. |
| 16 |
Tay YK, Tan SK. Treatment of infantile hemangiomas with the 595-nm pulsed dye laser using different pulse widths in an Asian population[J]. Lasers Surg Med, 2012, 44(2): 93-96. DOI:10.1002/lsm.21159. |
| 17 |
Hunzeker CM, Geronemus RG. Treatment of superficial infantile hemangiomas of the eyelid using the 595-nm pulsed dye laser[J]. Dermatol Surg, 2010, 36(5): 590-597. DOI:10.1111/j.1524-4725.2010.01511.x. |
| 18 |
Chen W, Liu S, Yang C, et al. Clinical efficacy of the 595 nm pulsed dye laser in the treatment of childhood superficial hemangioma-analysis of 10-year application in Chinese patients[J]. J Dermatolog Treat, 2015, 26(1): 54-58. DOI:10.3109/09546634.2013.806979. |
| 19 |
陈日新, 陈婧弘, 刘成印, 等. 2%盐酸卡替洛尔滴眼液联合595 nm脉冲染料激光治疗婴儿浅表性血管瘤的临床疗效及安全性[J]. 皮肤性病诊疗学杂志, 2018, 25(3): 156-160. DOI:10.3969/j.issn.1674-8468.2018.03.009. Chen RX, Chen YH, Liu CY, et al. Clinical efficacy and safety of 2% carteolol hydrochloride eye drops combined with 595 nm pulsed dye laser in the treatment of superficial hemangioma in infants[J]. Journal of Dermatology and Venereology, 2018, 25(3): 156-160. DOI:10.3969/j.issn.1674-8468.2018.03.009. |
| 20 |
Tawfik AA, Alsharnoubi J. Topical timolol solution versus laser in treatment of infantile hemangioma:a comparative study[J]. Pediatric dermatology, 2015, 32(3): 369-376. DOI:10.1111/pde.12542. |
| 21 |
Park KH, Jang YH, Chung HY, et al. Topical timolol maleate 0.5% for infantile hemangioma; it's effectiveness and/or adjunctive pulsed dye laser-single center experience of 102 cases in Korea[J]. Journal of Dermatological Treatment, 2015, 26(4): 389-391. DOI:10.3109/09546634.2014.990412. |
 2019, Vol. 18
2019, Vol. 18


