肝母细胞瘤(hepatoblastoma, HB)是小儿最常见的肝脏恶性肿瘤,根治性手术切除是HB最基本、最有效的治疗措施。由于小儿腹腔容积小,肝脏管道解剖学结构复杂,腹腔镜下止血困难,大出血引起休克的风险较高,故小儿腹腔镜肝切除术(laparoscopic liver resection, LLR)开展很少。目前,国内外绝大多数医疗中心均采用开腹肝切除术(open liver resection, OLR)治疗小儿肝肿瘤。近年来西安交通大学第二附属医院小儿外科对LLR的临床应用进行了探索与尝试,至2019年5月已采用LLR治疗HB 19例,本研究选择了我院采用LLR、OLR治疗的HB病例进行对比分析,旨在探讨LLR治疗HB的安全性及可行性[1]。
材料与方法 一、一般资料收集2012年1月至2019年5月在西安交通大学第二医院接受手术(LLR及OLR)治疗并经术后病理证实为HB患儿的临床资料进行回顾性分析。排除标准:①LLR组中转开腹的病例; ②OLR组因肿瘤破裂行急诊手术或肝肿瘤切除术中同时附加其他手术(如血管或胆管重建、肝门部淋巴结清扫、肺部病变切除术)的病例。本研究正式开展前已获得医院伦理委员会批准。
二、术前化疗对活检确诊或临床高度怀疑HB的患儿首先进行PRETEXT分期和危险度分层[2, 3]。标危(standard risk, SR)患儿中所有PRETEXT Ⅰ期及个别Ⅱ期者未行术前化疗,其余患儿单用顺铂或联合应用顺铂+表柔比星化疗2~4个疗程。高危患儿(high risk, HR)参考SIOPEL-3HR方案交替使用顺铂/卡铂+表柔比星化疗[4]。
三、手术适应证与禁忌证LLR组:适应证为PRE/POSTTEXT Ⅰ、Ⅱ和部分Ⅲ期,肿瘤的位置和大小不影响第一、第二和第三肝门的解剖,预定切缘>1 cm,残肝体积>标准肝体积25%(化疗后该比例>30%)。禁忌证包括:肿瘤紧贴或侵及门静脉、肝静脉及下腔静脉、肝内血管瘤栓、需要行肝门部血管或胆管重建、腹腔严重粘连者。对有LLR适应证者术前告知费用问题,选择LLR或OLR由患儿家长决定并签署知情同意书。
OLR组:适应证、禁忌证与LLR组相似,对肿瘤靠近门静脉、肝静脉及下腔静脉但无浸润者可选择OLR。
自2012年1月至2019年5月,我院应用LLR治疗HB 19例,其中2例中转开腹,因此实际纳入17例。同期应用OLR治疗HB 29例,其中1例为肿瘤破裂后急诊手术,1例为肝肿瘤根治术中同时行门静脉右支重建术,1例同时切除肺转移灶,因此实际纳入26例。患儿均于术后通过病理学检查确诊为HB。两组患儿年龄、性别、血红蛋白、肝功能、甲胎蛋白、肿瘤大小、数目、位置及手术方式、PRETEXT分期、危险度分层等方面均无统计学差异(P>0.05),具有可比性,见表 1。
|
|
表 1 患儿的一般资料、术前检查及治疗、肿瘤状况及手术方式 Table 1 Comparison of demographic, preoperative clinical examination and treatment, tumor status and surgical characteristics between LLR and OLR |
两组患儿均由同一组医师实施手术,术前进行多学科会诊,根据肝脏3D影像和(或)增强CT结果制订手术规划,尽可能在确保残肝容积足够的基础上行解剖性肝切除术。
LLR组:①取头高足低20° ~30°仰卧位,可灵活调整左右侧卧位幅度,并通过腹壁缝线牵拉或器械托举肝脏显露手术视野;②使用10 mm 30°腹腔镜,多采用四孔法,Trocar位置随患儿情况行个体化调整,至少使用2个10 mm Trocar, 使目镜可在10 mm Trocar间切换且主操作孔与肝断面方向一致;③对瘤体直径>5 cm者,解剖性肝切除采用尾路+前入路切肝法,不规则肝切除采用留置Pringle法;④解剖性肝切除处理第一肝门时要逐个解剖出目标管道,确认后分别予以结扎、hemolock夹闭切断;是否留置Pringle阻断带、离断第二肝门的时机(断肝前/断肝时)及方式(hemolock/Endo-GIA)取决于患儿的具体情况;⑤根据肝缺血线确定切面,个别病例术中辅助超声明确肿瘤位置及其与管道的走形关系;不规则肝切除断面距肿瘤边缘1~2 cm;⑥肝实质离断采取边吸、边切、边凝的方法,遇到胆管及较大血管时,改为与管道平行方向将其游离出适当长度后再作处理, 断肝器械的选择应在保证手术安全的基础上兼顾经济原则,同时尽量减少胆管附近部位的电灼次数;⑦标本装袋后经扩大的脐部纵切口、Trocar间切口、下腹部Pfannenstiel切口整块取出,避免污染腹腔;⑧常规留置腹腔引流管[5-7]。
OLR组:选择上腹部横切口或肋缘下切口,进腹探查后,根据病变位置遵循肿瘤根治原则行相应的肝叶、肝部分、半肝或肝三叶切除,术中避免过度挤压肿瘤,部分病例预置肝门阻断带。
五、随访指标比较两组术中及术后相关指标、围手术期并发症发生情况以及近远期随访结果。随访终点为患儿肿瘤复发、转移或死亡。随访截止日期为2019年6月30日。
六、统计学方法采用SPSS 24.0进行统计学处理。计量资料以(x ± s)表示,两组间比较采用独立样本t检验;计数资料用率以及相对数表示,两组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,生存率比较采用Log-rank检验和Gehan-Breslow-Wilcoxon检验。P<0.05表示差异有统计学意义。
结 果 一、围手术期相关指标比较两组均获R0期切除且无一例围手术期死亡病例,围手术期有关指标比较见表 2。与OLR组相比,LLR组平均手术时间更长,术中出血量更小,手术切口长度更短,术后肝功能恢复更快,镇静剂或止痛药应用更少,术后禁食时间更短,术后住院时间更短(P < 0.05)。LLR组1例严重胆漏患儿经历3次麻醉、2次手术后治愈,共住院4次,总时间长达11个月。
|
|
表 2 两组手术指标及围手术期有关指标对比 Table 2 Operative data and perioperative information |
两组术后并发症的比较见表 3。LLR组出现术后并发症4例,包括肝断面包裹性积液1例,胆漏3例。其中1例胆漏患儿经超声引导下置管引流50余日无效,行ERCP胆总管置管未能成功,之后于腹腔镜下缝合胆漏部位,术后再次出现胆漏,最终经开腹肝门-空肠Roux-en-Y吻合术后治愈[5]。围手术期OLR组出现胆漏3例,切口感染、胸腔积液、腹水、肝断面包裹性积液各1例。肝断面包裹性积液患儿经B超引导下穿刺治愈,1例胆漏患儿最终经ERCP胆总管置管引流治愈,其余患儿均通过保守治疗治愈。另有1例术后22个月出现粘连性肠梗阻,经再次手术松解粘连后好转。两组术后30 d内并发症发生率、严重并发症发生率、再手术率无显著性差异(P>0.05)[8]。
|
|
表 3 两组术后并发症比较 Table 3 Comparison of postoperative complications between LLR and OLR |
两组患儿术后随访2~43个月,均无失访病例。
LLR组:复发3例,均发生于术后1年内[5]。第1例因术中取标本时标本袋破裂,术后切口部位出现“种植瘤”;第2例部分瘤体侵及右侧腹壁,甲胎蛋白12 ng/mL,术后病理结果为小细胞未分化型HB;第3例就诊时年龄较大(72个月),为左半肝多灶性病变,术前化疗反应差。LLR组肿瘤复发转移率为17.6%(3/17)。术后随访超过3年者无瘤存活率(3-year event-free survival,3-EFS)为75.0%(6/8)。
OLR组:复发3例,肺转移2例。2例PRETEXT Ⅲ期病例术前化疗3个疗程后肿瘤无明显缩小,给予TACE后行肝三叶切除术,其中1例局部复发,1例肺转移。1例PRETEXT Ⅱ期患儿术前未化疗,行右半肝切除术后化疗5个疗程,病理结果为胚胎型HB,术后14个月出现肝门部肿瘤复发。1例多灶型HB行右半肝+S3肿瘤切除术,术后16个月出现肝断面肿瘤复发伴肝门部多个淋巴结肿大。1例就诊时已有肺转移,术前化疗后肺部病灶消失,肝切除术后又出现肺部病变复发。OLR组肿瘤复发转移率为19.2%(5/26),术后3-EFS为76.9%(10/13)。
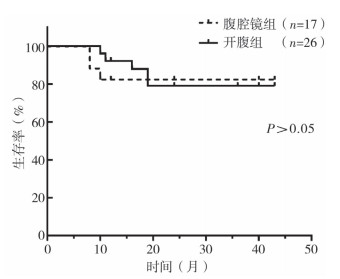
Log-rank检验和Gehan-Breslow-Wilcoxon检验结果表明,两组患儿术后无瘤生存率无显著性差异(P>0.05),见图 1。
|
Download:
|
| 图 1 43例肝母细胞瘤患儿术后无瘤生存情况 Fig. 1 Event-free survival outcomes of 43 HB patients | |
近年来,成人LLR发展迅猛,在一些国际知名的医疗中心,LLR占肝切除手术的比例已达80%以上[9, 10]。由于小儿LLR手术难度大,专用器械少,且HB发病率低,腹腔镜手术费用高,加之对LLR治疗HB的安全性及疗效等问题的顾虑,使得小儿LLR进展一直比较缓慢,国内外目前仍处于起步或摸索阶段。与成人患者相比,小儿肝肿瘤多为单病灶且极少合并肝硬化,肝脏相对较浅且代偿和再生能力强,肝断面小。对合适的病例,腹腔镜的放大作用可使得肝门、肝周显露清晰,能够更好地实现术野暴露与出血量控制。至2019年5月,我们共应用LLR治疗HB患儿19例,根据实际操作过程及治疗效果,我们认为LLR治疗HB从理论和实际操作上均具有可行性。
19例平均出血量接近80 mL,最大出血量约300 mL,患儿均获R0期切除,除2例中转开腹手术外其余患儿均顺利于腹腔镜下完成手术。LLR术中最严重的意外情况为大出血,本研究排除的2例中转手术者之一系左半肝切除时LigaSure粘连至肝中静脉粗大分支,松开时引起出血,术者随即LigaSure原位夹住出血部位,开腹缝合止血,故强调LLR除了周密的手术规划外,还需保证器械设备处于良好使用状态,必要时果断中转开腹手术。
本研究中LLR组术后出现Clavien-DindoⅢ级并发症2例,最严重的1例因胆漏住院4次,总时间长达11个月,历经3次麻醉、2次手术后最终治愈。该患儿为我们早期开展LLR阶段收治的病例,考虑系右肝管电损伤所致。OLR组出现Clavien-DindoⅢ级并发症3例,两组并发症发生率、再手术率均无显著性差异。美国有文献报道36例LLR术后发生轻微并发症5例,提示LLR并不会增加术后并发症的发生率[11]。
LLR组复发3例,OLR组复发及肺转移共5例,两组均获R0期切除,组间比较无显著性差异。分析复发原因我们认为,除LLR组1例由于手术操作原因导致种植瘤外,其余患儿的复发可能更多与患儿自身因素(年龄偏大)及肿瘤本身的不良生物学特征(小细胞未分化型HB、就诊时血AFP<100 ng/mL或伴肺转移、多灶型病变且对化疗不敏感)有关[12]。2016年美国文献报道采用LLR治疗HB 20例[11],病变直径2~9 cm,术后平均随访1年肿瘤无局部复发,但1例术前有肺转移者出现肺部复发。日本个案报道LLR治疗HB(肿瘤大小6 cm×5 cm×4 cm)术后26个月无复发[13],提示LLR并非HB复发的危险因素。理论上,LLR仅改变了进入腹腔的途径及手术者操作的习惯,只要术中严格遵循肝恶性肿瘤根治原则,手术操作本身对恶性肿瘤的生存预后影响较小。对HB患儿,我院LLR组与OLR组术后3年无瘤存活率无明显差异(约75%左右),总体上接近国内外报告水平[14, 15]。
总之,LLR组患儿较OLR组术中出血量少,切口美观,术后可更早经口进食,更少使用镇静剂或止痛药,还可加快包括肝功能在内的机体生理功能恢复,且不增加术后并发症、再手术以及肿瘤复发转移的概率,很好地展现了微创手术的优势。但由于本研究所纳入的患儿数量及远期随访情况仍存在一定的局限性,这可能会对结果的准确性造成一定影响,因此后期需要扩大样本量做进一步研究。
| 1 |
段怡涛, 郑百俊, 高亚, 等. 小儿腹腔镜下肝切除术4例[J]. 临床小儿外科杂志, 2013, 12(2): 110-112. DOI:10.3969/j.issn.1671-6353.2013.010. Duan YT, Zheng BJ, Gao Y, et al. Laparoscopic liver resection in children:a report of 4 cases[J]. J Clin Ped Sur, 2013, 12(2): 110-112. DOI:10.3969/j.issn.1671-6353.2013.010. |
| 2 |
Roebuck DJ, Olsen Ø, Pariente D. Radiological staging in children with hepatoblastoma[J]. Pediatr Radiol, 2006, 36(3): 176-182. DOI:10.1007/s00247-005-0029-6. |
| 3 |
Perilongo G, Maibach R, Shafford E, et al. Cisplatin versus cisplatin plus doxorubicin for standard-risk hepatoblastoma[J]. N Engl J Med, 2009, 361(17): 1662-1670. DOI:10.1056/NEJMoa0810613. |
| 4 |
Zsíros J, Maibach R, Shafford E, et al. Successful treatment of childhood high-risk hepatoblastoma with dose-intensive multiagent chemotherapy and surgery:final results of the SIOPEL-3HR study[J]. J Clin Oncol, 2010, 28(15): 2584-2590. DOI:10.1200/JCO.2009.22.4857. |
| 5 |
郑百俊, 段怡涛, 高亚, 等. 腹腔镜小儿肝切除术21例报告[J]. 中华小儿外科杂志, 2019, 40(7): 608-612. DOI:10.3760/cma.j.issn.0253-3006.2019.07.007. Zheng BJ, Duan YT, Gao Y, et al. Laparoscopic liver resection for hepatic masses in children:a report of 21 cases[J]. Chin J Pediatr Surg, 2019, 40(7): 608-612. DOI:10.3760/cma.j.issn.0253-3006.2019.07.007. |
| 6 |
Ogiso S, Nomi T, Araki K, et al. Laparoscopy-specific surgical concepts for hepatectomy based on the laparoscopic caudal view:a key to reboot surgeons'minds[J]. Ann Surg Oncol, 2015, 22(3): 327-333. DOI:10.1245/s10434-015-4661-6. |
| 7 |
Moris D, Rahnemai-Azar AA, Tsilimigras DI, et al. Updates and critical insights on Glissonian approach in liver surgery[J]. J Gastrointest Surg, 2018, 22(1): 154-163. DOI:10.1007/s11605-017-3613-9. |
| 8 |
Dindo D, Demartines N, Clavien PA. Classification of surgical complications:a new proposal with evaluation in a cohort of [6336] patients and results of a survey[J]. Ann Surg, 2004, 240: 205-213. DOI:10.1097/01.sla.0000133083.54934.ae. |
| 9 |
Koffron AJ, Auffenberg G, Kung R, et al. Evaluation of 300 minimally invasive liver resections at a single institution:less is more[J]. Ann Surg, 2007, 246(3): 392-394. DOI:10.1097/SLA.0b0l3e318146996c. |
| 10 |
Reddy SK, Tsung A, GelIer DA. Laparoscopic liver resection[J]. World J Surg, 2011, 35(7): 1478-1486. DOI:10.1007/s00268-010-0906-5. |
| 11 |
Veenstra MA, Koffron AJ. Minimally-invasive liver resection in pediatric patients:initial experience and outcomes[J]. HPB, 2016, 18(6): 518-522. DOI:10.1016/j.hpb.2015.11.004. |
| 12 |
Czauderna P, Haeberle B, Hiyama E, et al. The Children's Hepatic Tumors International Collaboration (CHIC):Novel global rare tumor database yields new prognostic factors in hepatoblastoma and becomes a research model[J]. Eur J Cancer, 2016, 52: 92-101. DOI:10.1016/j.ejca.2015.09.023. |
| 13 |
Yada K, Ishibashi H, Mori H, et al. Laparoscopic resection of hepatoblastoma:Report of a case[J]. Asian J Endosc Surg, 2014, 7(3): 267-270. DOI:10.1111/ases.12106. |
| 14 |
Yuan XJ, Wang HM, Jiang H, et al. Multidisciplinary effort in treating children with hepatoblastoma in China[J]. Cancer Lett, 2016, 375(1): 39-46. DOI:10.1016/j.canlet.2016.02.051. |
| 15 |
Hiyama E, Hishiki T, Watanabe K, et al. Resectability and tumor response after preoperative chemotherapy in hepatoblastoma treated by the Japanese Study Group for Pediatric Liver Tumor (JPLT)-2 protocol[J]. J Pediatr Surg, 2016, 51(12): 2053-2057. DOI:10.1016/j.jpedsurg.2016.09.038. |
 2019, Vol. 18
2019, Vol. 18


