胆道闭锁(biliary atresia,BA)以肝内外胆管闭锁和梗阻性黄疸为特点[1]。主要发生于新生儿,我国台湾地区新生儿胆道闭锁发病率约1/5 000[2]。欧洲新生儿BA发病率约1/18 000[3-5],若不加以干预,患儿多于1岁以内死亡[6]。胆管炎是胆道闭锁Kasai术后最常见并发症,发生率约60% ~90%,反复发作的胆管炎是影响BA患儿术后生活质量的重要危险因素;如胆管炎不能得到有效治疗,将导致肝硬化、门静脉高压症,最终引起肝衰竭,需行肝移植治疗[7]。
胆道闭锁术后胆管炎的发病机制目前尚不统一,肠道细菌逆行感染为其主要原因,常见菌群包括绿脓杆菌、大肠埃希菌、阴沟肠杆菌、铜绿假单胞菌、肺炎克雷伯杆菌、鲍氏不动杆菌和伤寒沙门菌[8, 9]。
目前,胆道闭锁术后胆管炎的临床诊断标准包括:无其他部位感染的发热(>38 ℃)或表现为弛张热,皮肤巩膜黄染加深或大便颜色变浅,呈白陶土色或小便呈浓茶色,总胆红素再次升高>25%。血培养发现致病菌可证实诊断,但阳性率很低,仅20% ~40%。B超显示肝内胆管壁增厚、粗糙[10, 11]。
其他少见诊断方法包括:胆汁培养,为有创操作,且行肝脏穿刺无法保证可以顺利取到胆汁(除非有明确的胆汁湖形成)。肝活检有明确诊断的意义,为有创检查方法,目前国内开展较少。CT、放射性核素扫描、磁共振胰胆管造影等检查的意义不大。检测尿液中USBA可辅助诊断胆管炎,但目前国内鲜见相关报道[11]。
自20世纪80年代初,胆道闭锁术后胆管炎的治疗多采用2代头孢菌素(头孢孟多、头孢呋辛)联合氨基糖甙类(庆大霉素、阿米卡星)。90年代后,3代头孢菌素(头孢哌酮、头孢曲松)成为主导,有时结合氨基糖甙类。近年来,广谱β-内酰胺酶类已成为预防和治疗胆道闭锁术后胆管炎的一线药物[12-15]。
然而,目前我国对于胆管炎发作的严重程度及相关治疗多为经验性用药,尚无统一治疗指南。临床随机对照试验一直被公认为是医学研究证据来源的金标准,而当干预或预期结果为小概率事件时,多中心临床研究则更有优势。多中心临床研究是指由多个研究中心的临床医生或科研人员按照同样的研究设计、朝同一个研究目的协同完成的临床研究工作。
一、研究目的通过对多个研究中心收治的胆道闭锁术后胆管炎病例进行严重程度分级,根据胆管炎严重程度进行针对性治疗,以期改善胆管炎的治疗效果,减少抗生素使用过程中的并发症。
二、研究设计 (一) 研究总体设计本研究为前瞻性、多中心、随机对照研究,纳入对象为胆道闭锁术后胆管炎患儿。
(二) 研究对象1.研究中心的选择:胆道闭锁术后胆管炎及其他并发症的发生除了与手术年龄、术前肝功能等患儿自身条件有关以外,还与术者水平及临床经验相关。据报道称具有5次以上Kasai手术经验的手术者可使患儿5年自体肝存活率达61%,而无经验的手术者手术后患儿5年自体肝成活率仅14%左右。因此,本多中心研究首先需选定研究中心单位的资质,以减少研究单位之间偏倚。本次多中心研究相关单位均为三级甲等医院,在胆道闭锁及术后胆管炎疾病诊治方面处于当地领先水平,拥有足够的病源数量(每年胆道闭锁手术量>20人次),具备全部胆道闭锁及胆管炎诊断相关检查设施:血常规、尿常规、血生化、血培养+药敏、超声检查、CT、肝活检等相关检查。研究人员均为经过临床试验培训的医师,并在高级专业人员的指导下开展工作。
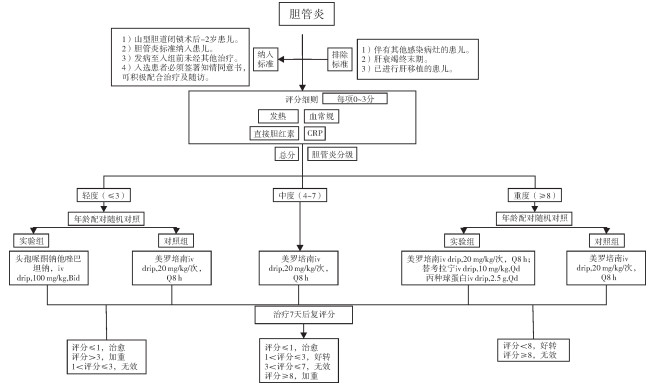
2.研究对象的选择:根据胆道闭锁术后胆管炎纳入标准初筛入组患儿。胆道闭锁术后胆管炎纳入标准:①无其他部位感染的发热(>38 ℃)或表现为弛张热;②皮肤巩膜黄染加深或大便颜色变浅呈白陶土色或小便呈浓茶色;③总胆红素再次升高>25%;符合以上3条中2条即可初步纳入此项研究。
研究过程中,由于多中心研究的研究对象来自不同地区,尽管样本量大大增加,但患儿年龄、性别、手术年龄等差异并不能消除甚至会放大系统误差,因此,需设立严格的纳入标准、排除标准、脱落标准及剔除标准,保证所收集数据的完整性、及时性、真实性。
脱落病例标准:①出现严重不良反应,经判断很难再继续进行诊断试验者;②检查结果显示病情异常加重和因其它原因经研究者判定难以再继续进行研究性治疗者;③患者对试验药物过敏或不能耐受者;④要求退出试验者;⑤失访者。
剔除标准:①违背试验方案(受试者不符合入选/排除标准等);②未用药者或用药后无任何记录者;③因故需要使用本试验禁忌的药物;④同一病例重复入组者。由于每个中心的入组速度及入组患儿年龄不同,为避免由于有的中心入组病例太多而引起的偏差,每个中心应保证按所分配的受试者人数入组。
为消除胆道闭锁术后胆管炎患儿的发病年龄及术后黄疸消退情况引起的偏倚,将按胆管炎患儿年龄及术后退黄情况进行配对实验设计,将各级别胆管炎患儿两两配对,对内随机分为对照组和实验组,配对实验设计以相应提高同质性。相关配对方案:①患儿年龄≤1岁&直接胆红素≤35 mg/dL;②患儿年龄>1岁&直接胆红素≤35 mg/dL;③患儿年龄≤1岁&直接胆红素>35 mg/dL;④患儿年龄>1岁&直接胆红素>35 mg/dL。
三、样本量估算根据各组的预试验有效率来评估本次研究所需病例数。
| $ \begin{array}{l} \;\;N = \{ {Z_{\alpha /2}}{[\left( {2{P_均}} \right)\left( {1 - {P_均}} \right)({Q_1}^{ - 1} + {Q_2}^{ - 1})]^{0.5}}\\ + {Z_\beta }{[{P_1}{Q_1}^{ - 1}\left( {1 - {P_1}} \right) + {P_2}{Q_2}^{ - 1}\left( {1 - {P_2}} \right)]^{0.5}}{\} ^2}/({P_1}\\ - {P_2}{)^2} \end{array} $ |
参数:①Zα/2:α=0.05,Zα/2=1.960; ②Zβ:β=0.10,Zβ=1.282; ③Q1、Q2:各组样本比例。本例设计Q1=0.50,Q2=0.50; ④P1、P2:各组的预试验有效率,重度有效率:P1=0.70、P2=0.90;⑤P均:两组合并率,或两组平均率。P均=P1Q1+P2Q2; ⑥N:两组样本总例数(N=n1+n2)。
样本总例数N≈173。各中心将不同严重程度胆管炎患儿按上述年龄及术后退黄情况进行配对实验设计,随机分为对照组和试验组。
四、分组及治疗方案所有入选的胆道闭锁术后胆管炎患儿由各中心根据入组时胆管炎严重程度进行评分,根据胆管炎严重程度分为轻度、中度、重度(表 1、表 2),各级胆管炎患儿按年龄及术后黄疸情况进行配对实验设计(表 3),对内随机分为对照组和实验组。实验组根据胆管炎严重程度进行分级治疗;所有对照组统一抗生素治疗(表 3)。对照组与实验组除抗生素使用不同以外,其他联合治疗方案相同,以尽可能减少抗生素治疗因素以外的其他因素干扰。
|
|
表 1 胆管炎严重程度评分细则 Table 1 cholangitis severity rating rules |
|
|
表 2 胆管炎严重程度分级 Table 2 Classification of severity of cholangitis |
|
|
表 3 胆管炎治疗方案 Table 3 Treatment plan for cholangitis |
按照随机数字表法将各单位胆管炎患儿进行随机分组。
|
|
评估周期:治疗3 d后复查、7 d后复评分。轻度胆管炎患儿:0~1分为治愈、2~3分为无效、≥4分为加重;中度胆管炎患儿:0~1分为治愈、2~3分为好转、4~7分为无效、≥8分为加重;重度胆管炎患儿:≤7分为好转、≥8分为无效。研究终点为胆管炎治愈或治疗7 d后评分。胆管炎治愈停药指征:①临床症状消失:体温<37.5℃;②感染指标降至正常范围:白细胞<10×109个/L、CRP < 10 mg/L。
安全性评价方面,用于分析的安全性指标包括不良事件、生命体征、体格检查、实验室检查(血常规、尿常规、大便常规、血生化)。本研究初始研究终点为7 d,若期间出现感染加重情况,可随时中止研究,并及时调整用药,出现此种情况的病例,视为治疗无效,既保证患儿治疗安全,同时保证研究的真实、有效。
六、技术路线图
|
统计分析采用软件编程计算。所有统计检验均采用差异性检验,P值< 0.05将被认为所检验的差别有统计学意义。可信区间采用95%的可信度,并进行脱落分析和有效性分析。
脱落分析:对两组总脱落率和由于不良事件而发生的脱落率进行比较,采用χ2检验。
基础值的均衡性分析:采用t检验和χ2检验或非参数检验来比较人口学资料和其它基础值指标,以衡量两组均衡性。
有效性分析:对主要疗效指标进行非劣效检验,非劣效界值取10%。临床症状评分方面,治疗前后的变化采用方差分析,由于本研究是一个多中心临床试验,在作此分析时,将考虑中心效应对疗效指标的影响。对次要疗效指标采用Fisher确切概率法、χ2检验或非参数检验进行组间比较。
八、数据管理与质量控制病例报告表由研究者填写,每个入选病例(包括脱落病例)必须完成病例报告表。经过监查员检查后的病例报告表,应由监查员核查签字后,将病例报告表及时送交临床试验数据管理员。移交后病例报告表的内容不再做修改。对于完成的病例报告表在研究者、监查员、数据管理员之间的传递应有专门记录,记录需妥善保存。
九、临床试验的伦理和知情同意研究者有责任确保本次试验的进行符合中国临床试验质量管理规范及赫尔辛基宣言(经东京、威尼斯、香港、南非、爱丁堡修改的版本)的要求。研究者应确保本次试验由有资格的伦理委员会审阅及批准。在试验开始之前,研究者应将本次试验方案、知情同意书以及其他必需的材料交于伦理委员会供其审阅及批准。入选本研究之前,将向受试者充分告知,受试者签署知情同意书后方可纳入研究。
十、讨 论多中心临床研究实现了多中心、多学科对同一临床问题的广泛协作研究,对于发挥临床医生的学术优势、促进医学科学的发展具有重要意义。多中心临床研究要求多个研究中心同时参与,可在较短的时间内遴选出临床科研所需的病例数;相对于单中心研究,在多中心临床研究中多个中心入选的病例在病种、病情分布等方面范围较广,研究的结果具有较为广泛的代表性,能充分发挥学术力量的优势,同时研究得到的结果具有可信度高、可靠性强、可复制等优点。因此,小儿外科医生应更多、更好地开展多中心临床研究,进一步提升我国小儿外科的临床研究水平,为科学改进治疗方法、增进治疗效果奠定基础。
参与研究的医疗单位: (按样本贡献排列参与课题的相关医疗单位及研究人员)
安徽省儿童医院 北京儿童医院 滨州医学院 长春儿童医院 成都市妇女儿童中心医院 福建省妇幼保健医院 福建医科大学附属协和医院 哈尔滨医科大学 河北医科大学第二附属医院 山西省儿童医院 深圳市儿童医院 天津市儿童医院 新疆医科大学第一附属医院 浙江大学医学院附属儿童医院郑州大学附一院 中山大学附属第一医院 遵义医学院 华中科技大学同济医学院附属同济医院
| 1 |
Hartley JL, Davenport M, Kelly DA. Biliary atresia[J]. Lancet, 2009, 374(9702): 1704-1713. DOI:10.1016/S0140-6736(09)60946-6. |
| 2 |
Lang T, Kappler M, Dietz H, et al. Biliary atresia:which factors predict the success of a kasai operation? An analysis of 36 patients[J]. Eur J Med Res, 2000, 5(3): 110-114. |
| 3 |
Chardot C, Carton M, Spire-Bendelac N, et al. Prognosis of biliary atresia in the era of liver transplantation:French national study from[1986] to 1996[J]. Hepatology, 1999, 30(3): 606-611. DOI:10.1002/hep.510300330. |
| 4 |
Livesey E, Cortina Borja M, Sharif K, et al. Epidemiology of biliary atresia in England and Wales (1999-2006)[J]. Arch Dis Child Fetal Neonatal Ed, 2009, 94(6): F451-F455. DOI:10.1136/adc.2009.159780. |
| 5 |
Leonhardt J, Kuebler JF, Leute PJ, et al. Biliary atresia:lessons learned from the voluntary German Registry[J]. Eur J Pediatr Surg, 2011, 21(2): 82-87. DOI:10.1055/s-0030-1268476. |
| 6 |
Chardot C, Carton M, Spire-Bendelac N, et al. Is the kasai operation still indicated in children older than 3 months diagnosed with biliary atresia?[J]. J Pediatr, 2001, 138(2): 224-228. DOI:10.1067/mpd.2001.111276. |
| 7 |
Superina R, Magee JC, Brandt ML, et al. The anatomic pattern of biliary atresia identified at time of kasai hepatoportoenterostomy and early postoperative clearance of jaundice are significant predictors of transplant-free survival[J]. Ann Surg, 2011, 254(4): 577-585. DOI:10.1097/SLA.0b013e3182300950. |
| 8 |
Wu ET, Chen HL, Ni YH, et al. Bacterial cholangitis in patients with biliary atresia[J]. Pediatr Surg Int, 2001, 17(5-6): 390-395. DOI:10.1007/s003830000573. |
| 9 |
张璟, 林涛, 黄柳明, 等. 胆道闭锁术后反复发作性胆管炎抗感染治疗的中长期随访[J]. 临床小儿外科杂志, 2016, 15(1): 20-22. DOI:10.3969/j.issn.1671-6353.2016.01.006. Zhang J, Lin T, Huang LM, et al. Outcomes of medium to long term follow-ups after anti-infective therapy for recurrent cholangitis after Kasai operation[J]. J Clin Ped Sur, 2016, 15(1): 20-22. DOI:10.3969/j.issn.1671-6353.2016.01.006. |
| 10 |
Luo Q, Hao F, Zhang M, et al. Serum bacterial DNA detection in patients with cholangitis after Kasai procedure[J]. Pediatr Int, 2015, 57(5): 954-960. DOI:10.1111/ped.12737. |
| 11 |
Luo Y, Zheng S. Current concept about postoperative cholangitis in biliary atresia[J]. World J Pediatr, 2008, 4(1): 14-19. DOI:10.1007/s12519-008-0003-0. |
| 12 |
Bu LN, Chen HL, Chang CJ, et al. Prophylactic oral antibiotics in prevention of recurrent cholangitis after the Kasai portoenterostomy[J]. J Pediatr Surg, 2003, 38(4): 590-593. DOI:10.1053/jpsu.2003.50128. |
| 13 |
Wong KK, Fan AH, Lan LC, et al. Effective antibiotic regime for postoperative acute cholangitis in biliary atresia-an evolving scene[J]. J Pediatr Surg, 2004, 39(12): 1800-1802. DOI:10.1016/j.jpedsurg.2004.08.027. |
| 14 |
Decharun K, Leys CM, West KW, et al. Prophylactic Antibiotics for Prevention of Cholangitis in Patients With Biliary Atresia Status Post-Kasai Portoenterostomy:A Systematic Review[J]. Clin Pediatr (Phila), 2016, 55(1): 66-72. DOI:10.1177/0009922815594760. |
| 15 |
丁洁. 关于多中心临床研究的思考[J]. 中华儿科杂志, 2011, 49(11): 801-803. DOI:10.3760/cma.j.issn.0578-1310.2011.11.001. Ding J. Thoughts on multi-center clinical trials[J]. Chinese Journal of Pediatrics, 2011, 49(11): 801-803. DOI:10.3760/cma.j.issn.0578-1310.2011.11.001. |
 2019, Vol. 18
2019, Vol. 18


