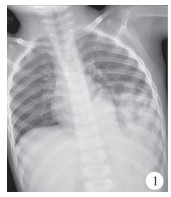
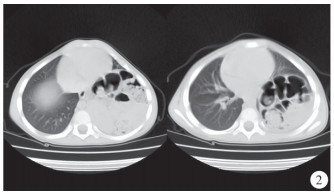
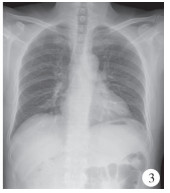
患儿,男,4岁,因间断发热7 d在当地医院就诊,胸部X线片提示左侧胸腔内巨大膈疝(图 1),转诊至连云港市第一人民医院就诊,追问病史,患儿自幼有频繁呼吸道感染病史,有进食少、发育迟缓、营养欠佳以及长期便秘病史。查体:营养状态较差,胸廓隆起畸形,胸骨下段抬高明显,呈鸡胸表现,左侧胸腔可闻及肠鸣音。CT检查提示纵膈右移、前移,左侧胸腔后外侧见大量肠管影(图 2)。入院诊断:左侧后外侧膈疝。术中情况:左侧膈肌后外侧巨大缺损,部分空肠、全部回肠、升结肠、横结肠、降结肠以及脾脏均疝入胸腔,且合并肠旋转不良。纵膈向右向前移位,胸骨向前移位,呈鸡胸表现。术中见膈肌缺损较大,无法用自体组织修补,使用7 cm×5 cm异体脱细胞人真皮基质补片1片,双层折叠,修补于缺损膈肌的后内侧。术后3 d恢复进食,未见胸腔、腹腔积液,无异常发热等排异反应表现(图 3)。术后12 d伤口拆线出院。目前随诊至术后1年,复查胸腹部立位平片,膈肌修复良好,无不适症状,无发热、胸腔积液等并发症发生。
|
Download:
|
| 图 1 先天性膈疝患儿术前全胸正位X线片 Fig. 1 Preoperative AP chest film of congenital diaphragmatic hernia | |
|
Download:
|
| 图 2 先天性膈疝患儿术前CT表现 Fig. 2 Preoperative CT manifestations of congenital diaphragmatic hernia | |
|
Download:
|
| 图 3 先天性膈疝术后全胸正位X线片 Fig. 3 Postoperative AP chest film of congenital diaphragmatic hernia | |
讨论 儿童原发性膈疝一般为先天性膈疝,是由于先天性膈肌发育缺损导致腹腔内脏器、组织疝入胸腔的一种疾病。大多数在新生儿期即可因呼吸困难就诊,少数因各种原因拖延至儿童期就诊。使用自体组织原发性手术修复膈肌是治疗膈疝常用的方法,但术后有较高的复发率,有文献报道复发率为8% ~50%,其中膈肌缺损大是主要原因之一,适当使用补片能降低膈疝复发的机率[1, 2]。对处于发育阶段的儿童而言,其体型及内环境都在不断变化,修复材料的相容性、可塑性至关重要,需要谨慎使用。
脱细胞基质材料是目前组织工程学中较热门的研究领域,它是对异体的生物组织进行脱细胞、脱抗原处理保留纤维支架结构获得的一种生物材料。植入人体后宿主细胞可以生长进入补片材料重建成为自体组织。该修补材料具有可塑性强、组织相容性好、可以被组织吸收等优点。1975年Meezan[3]报道了通用的、非破坏性的生物化学方法制作脱细胞基质,至今已经有40多年的历史,但大多仍停留在动物实验阶段,由于受伦理及受试风险的影响,临床上仍未普及。1998年,Dahms等[4]对鼠、猪和人的膀胱无细胞基质进行了成分分析,通过实验研究证实了不同种属的脱细胞基质成分构成存在差异,但其主要成分为Ⅰ型、Ⅲ型胶原和弹性蛋白,其中人和猪的膀胱无细胞基质Ⅲ型胶原含量更高,而老鼠的膀胱无细胞基质Ⅰ型胶原的含量更高一些。这为脱细胞基质材料的应用提供了理论基础。经脱细胞技术处理后,组织中的可溶性蛋白及细胞成分完全被溶解、去除,成功保留了具有完整外观形态和组织学结构的不溶性基质成分,主要内容包括胶原、弹性蛋白等。带有抗原的细胞成分被去除,为其植入机体内修复损伤或缺损及促进组织再生提供了理论基础,再加上其制备程序的日渐成熟以及可大面积获取等优越条件,为组织工程的发展奠定了基础。基于以上动物实验和病理学基础研究,膀胱无细胞基质被证实为较安全、组织相容性较好的移植物。近年来,膀胱无细胞基质移植物已经被逐渐应用于临床治疗缺损性疾病。
2002年Atala[5]报道了将膀胱无细胞基质应用于尿道下裂修复手术,取得了较理想的治疗效果。他们采用膀胱无细胞基质用“Onlay”的手术方式修复尿道缺损,在临床试验中取得了满意的疗效。2007年Lee等[6]尝试了17例人真皮脱细胞基质修补较大的食管裂孔疝。2011年Avella[7]报道了2例腹腔镜下人真皮脱细胞基质修补膈疝。在小儿外科领域中,新生儿腹裂造成的腹壁缺损是生物材料修复的最常见适应证。2016年Filisetti等[8]对20例人真皮脱细胞基质修补小儿腹壁缺损发现在没有切口感染的情况下生物材料修复效果是肯定的。而应用该生物材料来修补儿童先天性膈疝在国内外鲜有报道。我们使用该补片的体会是,补片具有韧性足,很难扯断、撕裂等优点,术中修复效果满意。术后短期未发现不良反应,目前该患儿随访至术后1年,膈肌修复效果良好,未见不良反应,远期疗效仍需进一步随访观察。
| 1 |
Yokota K, Uchida H, Kaneko K, et al. Surgical complications, especially gastroesophageal reflux disease, intestinal adhesion obstruction, and diaphragmatic hernia recurrence, are major sequelae in survivors of congenital diaphragmatic hernia[J]. Pediatr Surg Int, 2014, 30(9): 895-899. DOI:10.1007/s00383-014-3575-x. |
| 2 |
刘威, 汪风华. 膈疝复发的原因分析及处理[J]. 临床小儿外科杂志, 2017, 16(1): 41-43. DOI:10.3969/j.issn.1671-6353.2017.01.010. Liu W, Wang FH. Causes and treatments of recurrent congenital diaphragmatic hernia[J]. J Clin Ped Sur, 2017, 16(1): 41-43. DOI:10.3969/j.issn.1671-6353.2017.01.010. |
| 3 |
Meezan E, Hjelle JT, Brendel K. A simple, versatile, nondisruptive method for the isolation of morphologically and chemically pure basement membranes from several tissues[J]. Life Sci, 1975, 17(11): 1721-1732. DOI:10.1016/0024-3205(75)90119-8. |
| 4 |
Dahms SE, Piechota HJ, Dahiya R, et al. Composition and biomechanical Properties of the bladder acellular matrix graft:comparative analysis in rat, pig and human[J]. Br Jurol, 1998, 82(3): 411-419. |
| 5 |
Atala A. Experimental and clinical experience with tissue engineering techniques for urethral reconstruction[J]. Urol Clin North Am, 2002, 299(2): 485-492. DOI:10.1016/S0094-0143(02)00033-2. |
| 6 |
Lee E, Frisella MM, Matthews BD, et al. Evaluation of acellular human dermis reinforcement of the crural closure in patients with difficult hiatal hernias[J]. Surg Endosc, 2007, 21(4): 641-645. DOI:10.1007/s00464-006-9117-4. |
| 7 |
Avella DM, Podany A, Staveley-O'Carroll KF, et al. Laparoscopic repair of post-esophagectomy diaphragmatic hernias using human acellular dermal matrix[J]. Interact Cardiovasc Thorac Surg, 2011, 13(2): 248-249. DOI:10.1510/icvts.2011.272310. |
| 8 |
Filisetti C, Costanzo S, Marinoni F, et al. Effectiveness and properties of the biological prosthesis PermacolTM in pediatric surgery:A large single center experience[J]. Ann Med Surg (Lond), 2016, 7: 48-54. DOI:10.1016/j.amsu.2016.03.017. |
 2019, Vol. 18
2019, Vol. 18
