小儿肝脏肿瘤是儿童常见肿瘤之一,约占儿童实体肿瘤的1% ~4%,以恶性肿瘤为主(约75%)。肝母细胞瘤(hepatoblastoma,HB)是儿童最常见的肝脏原发性恶性肿瘤,多发生于婴儿期[1]。肝中叶切除术是指切除肝左内叶和右前叶,适用于治疗左内叶与右前叶之间的肿瘤,或左内叶、右前叶肿瘤浸润肝中静脉,需一并切除肝中静脉者。目前中央区肝脏肿瘤的常用术式为半肝或扩大半肝切除术,虽然近年来随着肝脏外科的发展及围手术期处理的不断进步,手术安全性已明显提高,但对患儿行半肝或扩大半肝切除术后肝功能衰竭的发生率和死亡率仍较高[2, 3]。而位于中心的肝脏肿瘤,涉及肝脏Ⅳ段、Ⅴ段和Ⅷ段的全部或部分,由于其与主要血管、胆管结构及深度有关,可能需要大量切除[4, 5]。然而,目前位于中央的肝脏病变可以进行肝中叶切除,尽量避免使用延长的肝切除术,可最大程度地保留剩余肝组织,在防止术后肝功能衰竭的发生上有较大优势。目前有关小儿肝脏肿瘤肝中叶切除术的报道较少,本研究回顾性收集由湖南省儿童医院收治的4例儿童肝脏肿瘤作为研究对象,旨在探讨肝中叶切除治疗小儿肝脏肿瘤的安全性及疗效。
材料与方法 一、临床资料回顾性收集2017年6月至2019年5月在湖南省儿童医院行肝中叶切除术的4例小儿肝脏肿瘤患儿作为研究对象,其中男童2例,女童2例,手术年龄分别为4个月、6个月、11个月和2岁。4例均以腹部肿块就诊,实验室检查结果为3例AFP明显异常升高,1例AFP正常;术后病理结果分别为肝间叶错构瘤上皮型-胎儿型肝母细胞瘤、混合上皮间叶型肝母细胞瘤和胎儿型肝母细胞瘤。CT检查提示肿瘤体积最大者为15 cm×16 cm×8 cm,体积最小者为12 cm×10 cm×7 cm。所有患儿或家属签署手术知情同意书,并且该研究获得伦理委员会批准。4例患儿的具体临床资料见表 1。
|
|
表 1 4例肝脏肿瘤患儿临床资料 Table 1 Clinical profiles of 4 children of hepatic tumor |
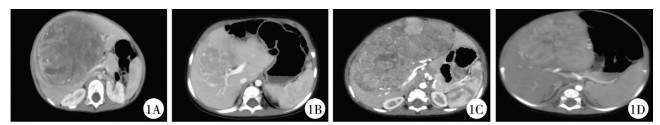
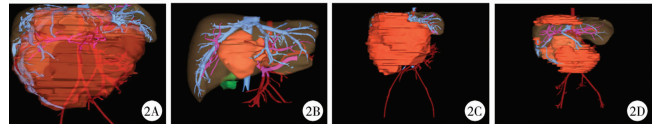
所有患儿完善血常规、凝血功能、电解质、肝肾功能、心肌酶、输血四项、血型、心电图、胸片等术前常规检查。为了评估肿瘤大小及其与周围组织解剖结构,进一步行CT平扫和增强检查(图 1),均使用海信计算机辅助系统完善肿瘤的三维成像(图 2)。
|
Download:
|
| 图 1 4例肝脏肿瘤患儿肝脏CT图 注 A:病例1;B:病例2; C:病例3; D:病例4 Fig. 1 Hepatic CT images of 4 children of hepatic tumor | |
|
Download:
|
| 图 2 海信计算机辅助系统三维成像软件显示4例肝脏肿瘤患儿肝脏的三维成像图 注 A:病例1;B:病例2; C:病例3; D:病例4 Fig. 2 Three-dimensional images of 4 children of hepatic tumor with Hi-Sense Imaging Software | |
实施全身麻醉效果满意后,提醒麻醉医师将中心静脉压控制在5~8 cmH2O(1 cmH2O=0.098 kPa),利于术中出血量控制。多取上腹部肋缘下弧形切口,电刀依次切开皮下、肌层,剪开腹膜。肝脏拉钩向外向上牵引皮肤,充分暴露,离断肝圆韧带、右侧冠状韧带、右侧三角韧带、肝肾韧带。分离第一肝门区,沟通文氏孔,套带悬吊预阻断,并于肾静脉上平面沟通肝下下腔静脉套带预阻断;分离第二肝门将肝上下腔静脉沟通套带预阻断。游离胆囊,分离至胆囊管汇入胆总管处游离不结扎。循左侧Glisson鞘向左纵沟方向游离,结扎向4段的Glisson鞘(门脉支及动脉支);循右侧Rouviere沟游离至右前与右后分叉部,结扎离断5、8段Glisson鞘(门脉分支及动脉支),结合缺血线,设计肝中叶切除平面。紧贴肝左静脉微榨法分离左肝外叶,遇Glisson蒂结扎后再次Prolene线缝扎,至肝静脉根部离断肝中静脉,可见肝中静脉紧贴肿瘤;将肝中叶向右向下翻转,结扎离断左侧肝短静脉,肝尾状叶受肿瘤挤压呈薄片状。暴露第二肝门至腔静脉陷窝,游离显示肝右静脉汇入下腔静脉处,循肝右静脉头侧途径紧贴肝右静脉向下分离右肝后叶,遇Glisson蒂结扎后再次Prolene线缝扎,至第一肝门结扎右前叶Glisson蒂(期间阻断右半肝血流20 min),移除肝中叶。离断肝脏的器械可以用超声吸引刀(cavitron ultrasonic surgical aspirator, CUSA)、水刀(water jet dissector)、蚊氏钳、Ligasure等。所遇较大管道分支一一离断结扎、缝扎、HOM-LOCK夹闭等。
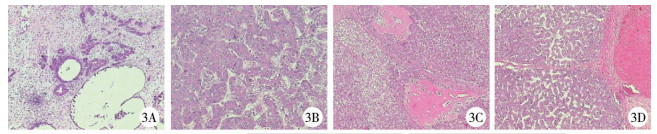
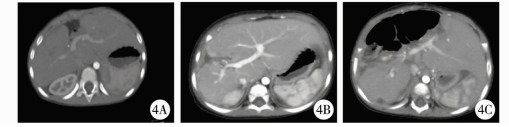
结 果所有患儿顺利实施肝中叶切除术,手术时间分别为300 min、240 min、250 min和240 min,术中出血量分别为600 mL、150 mL、400 mL和250 mL,术中均有输血,浓缩红细胞输入量分别为320 mL、240 mL、400 mL、320 mL,血浆输入量分别为200 mL、150 mL、150 mL和150 mL,具体见表 1。术后病理诊断分别为间叶性错构瘤、上皮型-胎儿型肝母细胞瘤、混合上皮间叶型肝母细胞瘤和胎儿型肝母细胞瘤(图 3)。术后1例发生胆漏,充分引流等保守治疗后治愈;无一例发生围手术期死亡。随访时间5~18个月,随访期间无一例肿瘤复发,出院后复查CT(图 4),其中第4例暂未复查CT。
|
Download:
|
| 图 3 4例肝脏肿瘤患儿术后病理检查结果 注 A:病例1;B:病例2; C:病例3; D:病例4 Fig. 3 Postoperative results of pathological examinations for 4 children of hepatic tumor | |
|
Download:
|
| 图 4 3例肝脏肿瘤患儿复查肝脏CT检查结果 注 A:病例1;B:病例2; C:病例3 Fig. 4 Results of CT re-examinations for 3 children of hepatic tumor | |
目前小儿肝脏肿瘤的治疗多采用以手术切除为主,化疗、消融、介入、高能聚焦超声刀、靶向治疗等为辅的综合化治疗模式[6]。目前,肝切除术被认为是治疗肝脏恶性肿瘤的首选术式[7]。有文献报道能否完整切除病变部位是影响肝脏肿瘤预后的重要因素之一,R0切除术后5年生存率可达30% ~50%,但R1/R2切除术后5年生存率仅为7%[8]。本研究4例患儿均达到肝脏中叶肿瘤R0切除,且无严重并发症发生,随访时间内(5~18个月)未见复发。
小儿肝脏肿瘤体积巨大,而血管细小,而且小儿血容量少,从而增加了肝中叶肿瘤切除的风险和难度,本研究安全准确切除肝中叶肿瘤,无严重并发症,总结经验主要如下:①术前准确评估肿瘤大小及其周围血管位置关系;本研究术前采用肝脏三维成像技术来评估肿瘤大小及其周围血管状况。应用该技术可减少手术损伤、降低术后并发症发生率, 防止术后肝衰竭的发生,提高手术的有效性和安全性[9, 10]。另外,有研究证实基于CT的三维成像技术,术前可以精确判断肿瘤的解剖位置及肝静脉间的变异血管[11, 12]。本组所有患儿三维重建图像对肝动脉、门静脉、肝静脉分支显示均达到三级以上,清晰地展现了个体化肝脏内脉管系统三维形态及其与肿瘤的空间毗邻关联,同时每个患者进行了个体化肝脏分段和体积测量。②术中精准操作仔细切除肿瘤,减少出血量;Glisson蒂横断式肝中叶解剖性切除术可精准判断肝实质离断平面,减少术中出血量,缩短第一肝门阻断时间[13-17]。实施Glisson蒂横断式肝中叶切除术需讲求方法与技巧,重点在于安全有效的分离Glisson鞘,术前需仔细分析影像学资料,了解肝内门静脉的分型[18, 19]。笔者首先沟通文氏孔,第一肝门预置阻断带,再实施肝门板下降,紧贴肝包膜分离下降肝门板, 置入右肝蒂悬吊带,再应用钝性分离法紧贴右前肝蒂分离。如右前肝蒂位置深,不易显露,需切开部份肝实质,仔细结扎肝门部小管道,对于肝门部出血较多的患儿需在阻断第一肝门下实施分离,可有效减少出血量。对于Glisson鞘膜上渗血点可应用双极电凝止血,慎重缝合出血点,防止引起肝门部胆管狭窄。成功置入右前肝蒂阻断带后收紧阻断带,仔细观察右前叶的缺血线。沿左侧肝蒂分离,结扎通向Ⅳa段、Ⅳb段肝蒂,此时可以看到左内叶与左外叶的缺血线,然后实行断肝操作。断肝过程中始终控制中心静脉压在5~ 8 cmH2O(1 cmH2O=0.098 kPa),减少术中渗血,使创面更加清晰,减少脉管系统的损伤,利于术中出血量控制,减少术后胆漏、出血的风险,断肝时多种器械配合使用,超声吸引刀断肝不损伤管道系统、Ligasure止血效果确切,仔细缝扎、结扎重要管道结构,减少术中术后出血量。③术后留置引流管,警惕胆漏、出血等并发症。肝中叶切除术围手术期的并发症值得关注,Lee[20]对895例肝中叶切除病例进行Meta分析,发生其并发症发生率为5.1% ~61.1%,最常见的并发症为胆漏及肝衰竭,围手术期死亡率为2.3%。术后常规留置引流管,能及时发现术后胆漏和出血情况,便于及时处置,留置引流管能充分引流腹腔内积液,减少术后感染的发生率;本组中有1例发生胆漏,经充分引流等保守治疗后治愈。术后给予滴注白蛋白能减少组织水肿,有利于伤口的愈合,减少伤口感染,缩短住院时间。
儿童解剖结构较成人细小,因此手术难度更大,对术者手术操作技术要求更高,并且需麻醉、ICU等多学科协作,且术后并发症发生率高。因此需严格完善术前评估、严格把控手术适应证,对于术前的准备评估及并发症的防治需不断总结经验。
综上所述,完善术前相关检查及肝脏的三维成像,熟料掌握Glission鞘分离的技巧,精准把控手术切除平面,可实现安全的解剖性精准肝中叶切除。
| 1 |
Aronson DC, Meyers RL. Malignant tumors of the liver in children[J]. Semin Pediatr Surg, 2016, 25(5): 265-275. DOI:10.1053/j.Sempedsurg.2016.09.002.2. |
| 2 |
Wei AC, Tung-Ping Poon R, Fan ST, et al. Risk factors for perioperative morbidity and mortality after extended hepatectomy for hepatocellular carcinoma[J]. Br J Surg, 2003, 90(1): 33-41. |
| 3 |
Melendez J, Ferri E, Zwillman M, et al. Extended hepatic resection:a 6-year retrospective study of risk factors for perioperative mortality[J]. J Am Coil Surg, 2001, 192(1): 47-53. DOI:10.1016/S1072-7515(00)00745-6. |
| 4 |
Chen XP, Qiu FZ, Lau WY, et al. Mesohepatectomy for hepatocellular carcinoma:a study of 256 patients[J]. Int J Colorectal Dis, 2008, 23(5): 543-546. DOI:10.1007/s00384-007-0411-y. |
| 5 |
Cheng CH, Yu MC, Wu TH, et al. Surgical resection of centrally located large hepatocellular carcinoma[J]. Chang Gung Med J, 2012, 35(2): 178-191. |
| 6 |
Kawaguchi Y, Honda G, Endo I, et al. Current Technical Issues for Surgery of Primary Liver Cancer[J]. Liver Cancer, 2016, 6(1): 51-58. DOI:10.1159/000449345. |
| 7 |
乔国梁, 李龙, 葛军涛, 等. 累及第二、三肝门巨大肝母细胞瘤手术切除41例[J]. 临床小儿外科杂志, 2014, 13(2): 99-102. DOI:10.3969/j.Issn.1671-6553.2014.02.004. Qiao GL, Li L, Ge JT, et al. Surgical resection of huge hepatoblastoma involving the second and third hepatic hilums[J]. J Clin Ped Sur, 2014, 13(2): 99-102. DOI:10.3969/j.Issn.1671-6553.2014.02.004. |
| 8 |
Fromer MW, Gaughan JP, Atabek UM, et al. Primary malignancyisan independent determinant of morbidity and mortality after liver resection[J]. Am Surg, 2017, 83(5): 436-444. |
| 9 |
Fang CH, Chen QS, Fang C, et al. Efficacy of three dimensional visualization technique assisted hepatectomy for the treatment of primary liver cancer[J]. Chin J Surg, 2015, 53(8): 574-579. |
| 10 |
李鹏鹏, 王志恒, 黄罡, 等. 肝脏三维可视化技术在肝脏恶性肿瘤治疗规划中的应用研究[J]. 中华外科杂志, 2017, 55(12): 916-922. DOI:10.3760/cma.j.issn.0529-5815.2017.12.008. Li PP, Wang ZH, Huang G, et al. Application of liver three-dimensional visualization technologies in the treatment planning of hepatic malignant tumor[J]. Chin J Surg, 2017, 55(12): 916-922. DOI:10.3760/cma.j.issn.0529-5815.2017.12.008. |
| 11 |
Togo S, Shizawa R, Kanemura E, et al. Usefulness of 3-dimensional computed tomography for caudate lobectomy by transhepatic anterior approach[J]. Hepatogastroenterology, 2002, 49(44): 461-466. |
| 12 |
袁荣发, 闵家祺, 邬林泉, 等. 3D技术在中央型肝肿瘤术前规划中的临床应用[J]. 中国普通外科杂志, 2018, 27(7): 818-825. DOI:10.3978/j.issn.1005-6947.2018.07.004. Yuan RF, Min JQ, Wu LQ, et al. Clinical application of 3D technology in preoperative surgical planning for central liver tumor[J]. Chinese Journal of General Surgery, 2018, 27(7): 818-825. DOI:10.3978/j.issn.1005-6947.2018.07.004. |
| 13 |
Huanwei C, Feiwen D. Purelaparoscopic right hemihepatectomy via anterior approach[J]. Surg Endosc, 2016, 30(12): 5621. DOI:10.1007/s00464-016-4903-0. |
| 14 |
Chen HW, Deng FW, Hu JY, et al. Extra-glissonian approach for totaI laparoscopic left hepatectomy:a prosective cohort study[J]. Surg Laparosc Endosc Percutan Tech, 2017, 27(6): 145-148. DOI:10.1097/SLE.0000000000000483. |
| 15 |
Chen YJ, Zhen ZJ, Chen HW, et al. Laroscopic liver resection under hemihepatic vascular inflow occlusion using the lowering of hilar plate approach[J]. Hepatobiliary Pancreat Dis Int, 2014, 13(5): 508-512. DOI:10.1016/S1499-3872(14)60293-9. |
| 16 |
Zhang Y, Yang H, Deng X, et al. Intermittent Pringle maneuver versus continuous hemihepatic vascular inflow occlusion using extraglissionian approach in laparoscopic liver resection[J]. Surg Endosc, 2016, 30(3): 961-970. DOI:10.1007/s00464-015-4276-9. |
| 17 |
Herman P, Krnger J, Lupinacci R, et al. Laparoscopic bisegmentectomy 6 and 7 using a glissonian approach and a halfpringle[J]. Surg Endosc, 2013, 27(5): 1840-1841. DOI:10.1007/s00464-012-2681-x. |
| 18 |
Wang HQ, Yang JY, Yan LN. Hemihepatic versus total hepatic inflow occlusion during hepatectomy:a systematic review and metaanalysis[J]. World J Gastroenterol, 2011, 17(26): 3158-3164. DOI:10.3748/wjg.v17.i26.3158. |
| 19 |
Kirchner VA, Kim KH, Kim SH, et al. Pure laparoscopic right anterior sectionectomy for hepatocellular carcinoma with great vascular exposure[J]. Surg Endosc, 2017, 31(8): 3349-3350. DOI:10.1007/s00464-016-5349-0. |
| 20 |
Lee SY. Central hepatectomy for centrally located malignant liver tumors:a systematic review[J]. World J Heapatol, 2014, 6(5): 347-357. DOI:10.4254/wjh.v6.i5.347. |
 2019, Vol. 18
2019, Vol. 18


