2. 上海交通大学医学院附属新华医院小儿外科(上海市, 200092);
3. 上海市儿科医学研究所(上海市, 200092);
4. 上海市小儿消化与营养重点实验室(上海市, 200092)
2. Department of Pediatric Surgery, Affiliated Xinhua Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200092, China;
3. Shanghai Institute of Pediatric Research, Shanghai 200092, China;
4. Shanghai Key Laboratory of Pediatric Gastroenterology & Nutrition, Shanghai 200092, China
小儿肠衰竭主要表现为肠道消化、吸收、运动、分泌等功能无法满足小儿生长发育的需要[1], 其中短肠综合征是小儿肠衰竭最常见的原因, 多见于新生儿坏死性小肠结肠炎、肠扭转、肠畸形等[2, 3]。肠外营养(parenteral nutrition, PN)自上世纪60年代应用于临床以来, 对提高小儿肠功能衰竭生存率的作用已得到公认[4]。但是肠衰竭患儿长期应用PN可能导致肠衰竭相关肝损害(intestinal failure associated liver disease, IFALD), 且处理难度较高[5]。有研究发现鱼油脂肪乳剂富含ω-3多不饱和脂肪酸, 且植物甾醇含量低, 能够抑制炎症通路的激活, 起到一定的保肝作用[6-8]。因此, 本研究将初步观察鱼油脂肪乳剂和中长链脂肪乳剂对肠衰竭相关肝损害患儿肝功能的影响, 为小儿肠衰竭的营养支持提供参考依据。
材料与方法 一、一般资料回顾性分析1999年1月至2017年5月在上海交通大学医学院附属新华医院住院、接受肠外营养治疗天数>42 d且发生肝损害的肠衰竭患儿临床资料, 共纳入65例。按照基线资料进行初步匹配后分为两组, 一组为中长链脂肪乳剂组(MCT/LCT组), 另一组为鱼油脂肪乳剂组(FO组)。患儿一般资料见表 1, 临床资料见表 2。该研究已获得新华医院研究伦理委员会批准, 并征得所有受试者及其家属的知情同意。
|
|
表 1 患儿一般资料[n/(x±s)/M(P25, P75)] Table 1 Baseline characteristics[n/(x±s)/M(P25, P75)] |
|
|
表 2 患儿临床资料 Table 2 Etiology of patients |
主要包括肠外营养和肠内营养, 肠外营养主要采用静脉给药的方式。患儿肠外营养使用"全合一"溶液, 配方中主要成分包括脂肪乳剂、氨基酸、葡萄糖、矿物质、微量元素、水溶性维生素和脂溶性维生素, 两种脂肪乳剂具体成分见表 3。当肠内营养量增加时, 肠外营养量相应减少。当发生IFALD后(判定标准:TBA、ALT、AST、AKP、γ-GT、Tbi、Dbi中任何3项高于正常参考值上限2倍水平, 并排除其他原因引起的肝损害)将中/长链脂肪乳剂更换为鱼油脂肪乳剂(商品名:尤文; 用量按患儿体重计算, 每日平均剂量为1 g/kg), 本研究中共31例患儿采取此方案; 另外34例继续使用中长链脂肪乳剂(商品名:力保肪宁; 用量按患儿体重计算, 每日平均剂量为1.2 g/kg)。所有患儿治疗期间均使用谷胱甘肽、熊去氧胆酸等药物保肝利胆。
|
|
表 3 脂肪乳剂成分表 Table 3 Composition of lipid emulsions |
包括TBA、ALT、AST、AKP、γ-GT、Tbi、Dbi、TP、ALB共9项, 肠外营养治疗期间需保证每7天至少监测1次。TBA、ALT、AST、AKP、γ-GT、Tbi、Dbi中原先高于正常值上限2倍的指标中, 至少有2个下降至正常范围内后方可判定为肝功能改善。
四、统计学处理采用SPSS 20.0进行统计学分析, 呈正态分布的计量资料用(x±s)表示, 同一组治疗前后指标比较采用配对t检验, 不同组治疗前后指标比较采用独立样本t检验。呈非正态分布的计量资料用M(P25, P75)表示, 组间同一指标的对比采用秩和检验。P < 0.05认为差异有统计学意义。
结 果FO组在我院接受PN时间最长达513 d, 中位时间90(51~152)d; MCT/LCT组在我院PN持续时间最长为205 d, 中位时间50(26.3~103.5)d。肝功能出现损害前肠内营养FO组热卡为(34.83±20.36)kcal/kg·d-1, 治疗后FO组肠内营养热卡为(79.62±35.70)kcal/kg·d-1, 两者差异具有统计学意义(P < 0.05)。而肝功能出现损害前MCT/LCT组肠内营养热卡为(59.86±12.09)kcal/kg·d-1, 治疗后MCT/LCT组肠内营养热卡为(72.62±32.36)kcal/kg·d-1, 两者差异无统计学意义(P>0.05), 见表 4。
|
|
表 4 两组间肝功能损害前后营养支持方案对比[(x±s)/M(P25, P75)] Table 4 Comparison of nutritional support protocols before and after liver damage in two groups[(x±s)/M(P25, P75)] |
|
|
表 5 肝功能损害前后的肝功能变化(x±s) Table 5 Liver function before and after liver function damage(x±s) |
FO组肝功能指标中ALT、γ-GT、Tbi水平显著下降(P < 0.05), 治疗前后ALT分别为(197.3±201.0)U/L和(95.9±61)U/L, γ-GT分别为(206.7±146.6)U/L和(164.8±149.7)U/L、Tbi分别为(81.3±104.7)μmol/L和(38.9±78.7)μmol/L。MCT/LCT组肝功能指标中仅AST、Tbi显著下降(P < 0.05), 治疗前后AST分别为(174.7±149.6)U/L和(92.8±77.0)U/L, Tbi分别为(49.2±61.7)μmol/L和(23.2±29.3)μmol/L。两组间比较, 干预前, FO组ALT、Dbi水平显著高于MCT/LCT组(P < 0.05), 而干预后, 两组肝功能的指标无显著差异(P>0.05)。从整体来看, 分组干预前5周TBA、ALT、AST、Tbi、Dbi等肝功能指标呈现逐渐上升的趋势; 0周时, FO组肝功能指标水平较MCT/LCT组高, 但在进行分组干预后, FO组肝功能指标下降趋势更明显, 恢复的速度较快, 第3周至第4周肝功能指标水平已经基本降至正常范围(图 1)。肝功能恢复时间FO组为22(17~32)d, MCT/LCT组为28(15~52.5)d, 两者比较差异具有统计学意义(P < 0.05)。
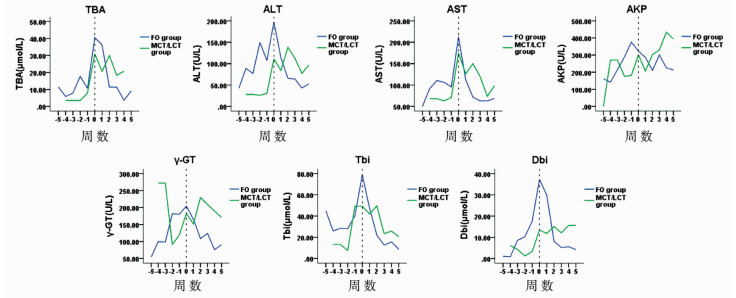
|
Download:
|
| 图 1 肝功能各指标变化趋势图 注 图中横坐标轴上的0周为分组干预时间(即肝功能出现损害时间), 分组干预前5周TBA、ALT、AST、Tbi、Dbi等肝功能指标呈现逐渐上升的趋势; 0周时, FO组肝功能指标水平较MCT/LCT组高; 但在进行分组干预后, FO组肝功能指标下降的趋势更明显, 恢复速度较快, 第3周至第4周肝功能指标水平基本降至正常范围。 Fig. 1 Trends in indicators of liver function | |
目前普遍认为IFALD的病因较为复杂, 多与胆汁酸肠肝循环被破坏、感染、肠道食物刺激减少等因素有关, 而肠外营养使用的时间、剂量也会对肝脏功能产生一定的影响[9]。
近期研究表明IFALD与脂肪乳剂的使用关系密切[10], 长期接受PN的肠衰竭患儿其IFALD的发生与大豆油脂肪乳剂剂量呈正相关。从成分上看, 中长链脂肪乳剂分别含50%的中链脂肪乳和50%的长链脂肪乳。长链脂肪乳含较多ω-6多不饱和脂肪酸, ω-6多不饱和脂肪酸(ω-6 PUFA)的代谢产物花生四烯酸有一定的促炎作用, 也会加重肝损害程度[11]。鱼油富含ω-3多不饱和脂肪酸(ω-3 PUFA), 主要为二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahenxarnoic acid, DHA)。EPA和DHA可与G蛋白偶联受体结合, 抑制炎症通路, 增强免疫力, 减少感染; 同时能够为肠道粘膜提供营养底物, 改善肠血流供应, 并减轻肠屏障损害, 这可能是鱼油发挥保肝作用的机制[12]。通过鱼油可调节脂肪乳剂中ω-6 PUFA和ω-3 PUFA的比例, 促进肠衰竭患儿肝功能的恢复。另外鱼油中的α-生育酚具有很强的抗氧化能力, 可降低肝细胞的脂质累积、氧化应激和炎症反应程度[13]。Gura等[14]于2006年首次报道了用鱼油脂肪乳剂成功治疗2例肠衰竭相关肝损害患儿的案例, 且目前临床研究已经证实鱼油脂肪乳剂的安全性与有效性; 随后Gura等[15]又采用鱼油脂肪乳剂治疗18例胆汁淤积患儿, 总治愈率达89%。Xu等[16]对大豆油脂肪乳剂治疗后出现胆汁淤积的15例患者使用鱼油脂肪乳剂, 发现鱼油对成人IFALD有效。Zhang等[17]对中长链脂肪乳剂治疗出现肝损害的32例肠衰竭患儿改用鱼油脂肪乳剂治疗, 发现鱼油脂肪乳剂对IFALD治疗有效。我们的研究发现, 使用鱼油脂肪乳剂的患儿ALT、γ-GT、Tbi均显著下降, 而中长链脂肪乳剂组仅AST、Tbi下降, 与之前的研究结果基本一致。因此可以认为, 鱼油脂肪乳剂能够更有效地减轻肠衰竭相关肝损害的严重程度。
在本次研究中, 我们还根据病人对EN的耐受性逐渐增加其肠道摄入量, 同时降低PN量。结果发现, 使用鱼油脂肪乳剂的患儿肠内营养增加的速度明显加快, 且FO组肠内营养热卡提高较显著, 表明鱼油脂肪乳剂的使用能够提高肠内营养耐受性, 使患儿能更快过渡到完全肠内营养。但是由于目前病例数还不够多, 单中心的回顾性研究结论缺乏足够的代表性, 后续还需要进行大样本的多中心研究对该结论进行进一步验证。
| 1 |
Pironi L, Arends J, Bozzetti F, et al. ESPEN guidelines on chronic intestinal failure in adults[J]. Clin Nutr, 2016, 35(2): 247-307. DOI:10.1016/j.clnu.2016.01.020. |
| 2 |
Willis TC, Carter BA, Rogers SP, et al. High rates of mortality and morbidity occur in infants with parenteral nutrition-associated cholestasis[J]. JPEN J Parenter Enteral Nutr, 2010, 34(1): 32-37. DOI:10.1177/0148607109332772. |
| 3 |
Fallon EM, Mitchell PD, Nehra D, et al. Neonates with short bowel syndrome:an optimistic future for parenteral nutrition independence[J]. Jama Surg, 2014, 149(7): 663-670. DOI:10.1001/jamasurg.2013.4332. |
| 4 |
Peden VH, Witzleben CL, Skelton MA. Total parenteral nutrition[J]. J Pediatr, 1971, 78(1): 180-181. |
| 5 |
Nandivada P, Fell GL, Mitchell PD, et al. Long-term fish oil lipid emulsion use in children with intestinal failure-associated liver disease[J]. JPEN J Parenter Enteral Nutr, 2017, 41(6): 930-937. DOI:10.1177/0148607116633796. |
| 6 |
Fell GL, Cho BS, Pan A, et al. A Comparison of fish oil sources for parenteral lipid emulsions in a murine model[J]. JPEN J Parenter Enteral Nutr, 2017, 41(2): 181-187. DOI:10.1177/0148607116640275. |
| 7 |
Bharadwaj S, Gohel T, Deen OJ, et al. Fish oil-based lipid emulsion:current updates on a promising novel therapy for the management of parenteral nutrition-associated liver disease[J]. Gastroenterol Rep(Oxf), 2015, 3(2): 110-114. DOI:10.1093/gastro/gov011. |
| 8 |
Calkins KL, Debarber A, Steiner RD, et al. Intravenous fish oil and pediatric intestinal failure-associated liver disease:changes in plasma phytosterols, cytokines, and bile acids and erythrocyte fatty acids[J]. JPEN J Parenter Enteral Nutr, 2018, 42(3): 633-641. DOI:10.1177/0148607117709196. |
| 9 |
Duro D, Mitchell PD, Kalish LA, et al. Risk factors for parenteral nutrition-associated liver disease following surgical therapy for necrotizing enterocolitis:A Glaser Pediatric Research Network Study[J]. J Pediatr Gastroenterol Nutr, 2011, 52(5): 595-600. DOI:10.1097/MPG.0b013e31820e8396. |
| 10 |
Wang Y, Zhou K, Tang Q, et al. Effect of an olive oil-based lipid emulsion compared with a soybean oil-based lipid emulsion on liver chemistry and bile acid composition in preterm infants receiving parenteral nutrition[J]. Jpen-Parenter Enter, 2016, 40(6): 842-850. DOI:10.1177/0148607114566853. |
| 11 |
Calder PC. Immunomodulation by omega-3 fatty acids[J]. Prostaglandins Leukot Essent Fatty Acids, 2007, 77(5-6): 327-335. DOI:10.1016/j.plefa.2007.10.015. |
| 12 |
Miloudi K, Comte B, Rouleau T, et al. The mode of administration of total parenteral nutrition and nature of lipid content influence the generation of peroxides and aldehydes[J]. Clin Nutr, 2012, 31(4): 526-534. DOI:10.1016/j.clnu.2011.12.012. |
| 13 |
Iyer KR, Spitz L, Clayton P. BAPS prize lecture:New insight into mechanisms of parenteral nutrition-associated cholestasis:role of plant sterols.British Association of Paediatric Surgeons[J]. J Pediatr Surg, 1998, 33(1): 1-6. DOI:10.1016/S0022-3468(98)90349-9. |
| 14 |
Gura KM, Duggan CP, Collier SB, et al. Reversal of parenteral nutrition-associated liver disease in two infantswith short bowel syndrome using parenteral fish oil:implications for future management[J]. Pediatrics, 2006, 118(1): 197-201. DOI:10.1542/peds.2005-2662. |
| 15 |
Gura KM, Lee S, Valim C, et al. Safety and efficacy of a fish-oil-based fat emulsion in the treatment of parenteral nutrition-associated liver disease[J]. Pediatrics, 2008, 121(3): 678-686. DOI:10.1542/peds.2007-2248. |
| 16 |
Xu Z, Li Y, Wang J, et al. Effect of omega-3 polyunsaturated fatty acids to reverse biopsy-proven parenteral nutrition-associated liver disease in adults[J]. Clin Nutr, 2012, 31(2): 217-223. DOI:10.1016/j.clnu.2011.10.001. |
| 17 |
Zhang T, Wang N, Yan W, et al. Effect of a fish oil-based lipid emulsion on intestinal failure-associated liver disease in children[J]. Eur J Clin Nutr, 2018, 72(10): 1364-1372. DOI:10.1038/s41430-018-0096-z. |
 2019, Vol. 18
2019, Vol. 18


