烟雾病(moyamoya disease, MMD)又称颅底异常血管网症, 发病原因尚不明确。MMD以双侧颈内动脉末端及大脑前动脉、大脑中动脉起始部进行性狭窄和闭塞, 伴颅底小血管代偿性网状增生扩张、脑实质和脑膜广泛侧支循环形成为特征的脑血管疾病[1], 1969年由日本学者Suzuki和Takaku[2]首次报道。由于这种颅底异常血管网在脑血管造影图像上形似烟雾, 故被称为烟雾病, 其中烟雾状血管的本质是扩张的穿通动脉, 并起到侧支循环的代偿作用。东亚国家的烟雾病患病率相对较高, 在日本, 1995年烟雾病发病率和患病率分别是0.35/10万和3.16/10万, 到2003年则分别增至0.54/10万和6.03/10万。男女患病比例约为1 : 2, 其中10% ~15%的患者存在烟雾病家族史, 流行病学资料显示烟雾病发病率可在以下两个年龄段达到顶峰:10~20岁和35~50岁[3-5]。Duan L等[6]曾开展了一项关于中国人群烟雾病的系统调查, 发现802例MMD患者临床表现与来自韩国和日本的患者相似, 两个发病高峰年龄段分别为5~9岁和35~39岁。但在中国患者中性别分布的差异不太明显, 有家族史者相对少见(约5.2%)。烟雾病的病因至今还不清楚, 从目前的证据来看, 遗传和环境因素与该病的发生关系较大。该病可表现出脑缺血和颅内出血相关特征, 而儿童常表现为缺血症状(约79%)[7-11]。近年来, 随着磁共振血管成像(magnetic resonance angiography, MRA)及灌注成像技术的推广应用, 神经外科医师对烟雾病的认识也在不断加深, 对烟雾病的诊断准确性逐渐提高。但国内对于幼儿烟雾病的诊治报道较少, 本文通过分析15例烟雾病患儿诊治全过程的临床资料, 旨在探讨烟雾病的临床特点、手术方式选择及预后状况。
材料与方法 一、临床资料回顾性分析2015年3月至2018年3月广州市妇女儿童医疗中心神经外科收治的15例烟雾病患儿临床资料。纳入标准: ①烟雾病的诊断均符合2012年日本烟雾病诊疗指南中烟雾病诊断标准者[12]; ②年龄≤6岁者。排除标准:患有自身免疫病、头部外伤、头部放射性照射等可导致脑血管损伤的疾病者。通过分析患儿的性别、发病年龄、首发症状、铃木分期(Suzuki分期)、影像学特征及治疗结局, 总结幼儿烟雾病的临床特征, 并评估其手术疗效[2]。
二、手术治疗脑血管重建的手术指证:烟雾病患者出现缺血症状, 影像学检查提示脑血流储备和灌注不足。为防止因出血性烟雾病导致的再出血, 即使脑血管储备不降低亦应行脑血管重建手术(证据水平Ⅲ级)[12]。手术侧别的选择:优先选择缺血较重侧进行手术治疗; 若双侧缺血情况相似, 首选优势半球。根据DSA及脑灌注状况, 12例行脑-硬脑膜-颞肌-血管融合术(encepho-dural-myo-synangiosis, EDMS), 3侧联合多点钻孔术治疗, 并观察术后近期并发症。
三、随访术后3个月返院复查MRI、MRA及脑灌注成像, 术后6个月到1年复查DSA, 并行神经系统检查, 评估手术侧治疗前后缺血改善情况及血管融合状况; 并评估未行手术的对侧, 若出现缺血症状则接受手术。定期通过门诊及电话随访患儿临床症状及神经功能, 包括术前及术后的语言功能、肢体功能及改良Rankin量表(modified Rankin scale, mRS)评分。
结 果 一、临床特征本研究15例烟雾病患儿全部表现为缺血性症状。男7例, 女8例:年龄8个月至6岁, 平均(3.7±1.8)岁。首发症状:短暂性脑缺血发作(transient ischemic attack, TIA)5例, 脑梗死8例, 头痛头晕2例。
1.影像学特征 15例均行MRA检查, 均伴有颈内动脉远端、大脑前动脉、大脑中动脉不同程度的狭窄或闭塞及颅底烟雾血管生成, 共21侧病变, 其中左侧3例, 右侧6例, 双侧6例。脑灌注成像表现为前循环灌注不足。通过入院首次DSA检查, Suzuki分期结果为:Ⅱ期1例, Ⅲ期6例, Ⅳ期5例, Ⅳ期3例。
2.手术治疗 15例中3例DSA检查结果显示颈外动脉侧枝循环形成良好, 脑灌注成像提示无明显灌注不足, 遂予以保守治疗(即改善循环及神经营养治疗)。余12例共发生17侧病变, 其中左侧2例, 右侧5例, 双侧5例, 均行EDMS术。根据术中颞浅动脉的粗细程度, 5侧病变分离颞浅动脉并行脑皮层贴敷术。由于EDMS术可沟通颅内外动脉区域, 但无法沟通前额部皮层缺血区域, 因此术前3例灌注成像显示前额明显灌注不足者同期行额骨钻孔术。
3.随访情况 对15例患儿随访12~30个月, 中位随访时间为16.3个月。12例(17侧)接受EDMS术后, 16侧(94.1%)神经功能缺损症状有所改善。其中5例TIA发作的患儿经治疗后均未再次发作, 2例头痛、头晕患儿术后未诉头部不适, 8例脑梗死患儿首发症状为肢体无力, 经手术治疗后均得到好转, 肌力从术前的Ⅰ~Ⅱ级肌力逐渐好转至Ⅳ~Ⅴ级。其中3例患儿术前出现合并语言障碍, 术后语言功能正常, 仅1例出现硬膜下血肿, 经血肿外引流后未遗留神经系统并发症。其余患儿未出现手术侧脑梗死、出血、颞肌占位及头皮坏死等并发症。术后mRS评分均显著低于术前, 见表 1。
|
|
表 1 烟雾病患儿的治疗方式和预后 Table 1 Treatments and prognostic assessments in children with moyamoya disease |
患儿男, 2岁5个月, 主诉:突发左侧肢体无力6周, 无特殊既往史。体格检查:意识清楚, 言语正常, 左侧肢体肌力Ⅲ级, 右侧肢体肌力Ⅴ级, 肌张力正常, 病理征未引出, 实验室检查结果未见异常。头部MRI及MRA结果提示:双侧颈内动脉前床突段以上闭塞, 右侧大脑中动脉、左侧大脑中动脉起始段及双侧大脑前动脉起始段未见显示, 颅底广泛侧支循环形成; 伴右侧颞顶叶脑回缺血、梗塞, 考虑为Moyamoya病。全脑血管造影术提示:双侧颈内动脉末端狭窄周围大量烟雾状血管形成, 双侧颈外动脉未见代偿供血。诊断: ①烟雾病; ②右侧颞顶叶脑梗死。由于右侧大脑半球缺血较重, 完善相关术前准备后于2015年3月20日行右侧EDMS术。手术顺利, 术后患儿恢复良好。于2015年7月4日复查DSA, 右侧颈外动脉造影示脑膜中动脉、颞浅动脉分支形成大量新生血管向颈内动脉供血区代偿供血, 大部分位于手术范围内。左侧肢体肌力恢复V级, 肢体活动正常。术前术后影像学结果对比见图 1至图 3, 手术过程照片见图 4。
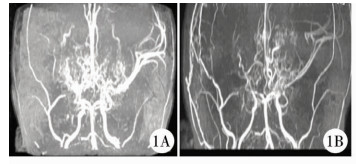
|
Download:
|
| 图 1 烟雾病患儿术前、术后MRA结果 A:术前双侧颈内动脉远端狭窄闭塞, 右侧大脑中动脉未见显影, 颅底可见多发烟雾血管, 右侧颈外动脉未见代偿; B:术后3个月双侧颈内动脉远端仍闭塞, 右侧大脑中动脉未见显影, 颅底烟雾血管较前减少, 可见右侧颈外动脉增粗, 向脑皮层代偿供血 Fig. 1 Preoperative and postoperative MRA in children with moyamoya disease | |

|
Download:
|
| 图 2 烟雾病患儿术前、术后DSA右侧颈内动脉造影结果 A:术前右侧颈内动脉远端狭窄, 右侧大脑前动脉可见显影, 右侧大脑中动脉部分显影, 颅底可见多发烟雾血管; B:术后3个月右侧颈内动脉远端闭塞, 右侧大脑前动脉及大脑中动脉未见显影, 颅底烟雾血管明显减少 Fig. 2 Right internal carotid artery angiography before and after surgery in children with moyamoya disease | |
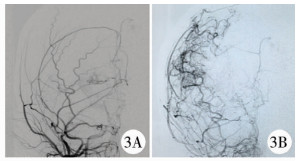
|
Download:
|
| 图 3 烟雾病患儿术前、术后DSA右侧颈外动脉造影 A:术前右侧颈外未见代偿; B:术后3个月正位造影示脑膜中动脉、颞深动脉及颞浅动脉通过血管融合灌注右侧皮层 Fig. 3 Right external carotid artery angiography before and after surgery in children with moyamoya disease | |

|
Download:
|
| 图 4 脑-硬脑膜-颞肌-血管融合术治疗幼儿烟雾病 A:分离颞浅动脉; B:保留脑膜中动脉主干及分支, 硬脑膜翻转贴敷于脑皮层; C:颞浅动脉穿过颞肌贴敷于脑表面, 颞肌缝合于硬脑膜边缘; D:骨瓣还纳并固定 Fig. 4 Surgical field of encepho-dural-myo-synangiosis | |
烟雾病常见的初始临床表现可概括为脑缺血和脑出血两种类型, 其中成人以脑出血表现为主, 而儿童以脑缺血表现为主[7], 主要特点为反复发作的肢体无力、失语、头痛等TIA症状。由于烟雾病具有进展性和不可逆性, 缺血状态得不到自身代偿及外界干预改善的情况下常可导致脑梗死的发生[13]。脑梗死的发生常伴有神经功能缺损的症状, 患儿生活质量明显随之下降。对于缺血性脑血管病, 常见的病因包括动脉粥样硬化、心源性栓塞、血管炎、烟雾病及血液高凝状态等。幼儿烟雾病容易被误诊为血管炎, 血管炎的诊断标准为具有明确的实验室检查证据或中枢系统感染处于活动期, 实验室检查证据包括炎性标记物阳性、血液检查结果异常、狼疮抗凝组织抑制血栓形指数异常、自身抗体谱阳性、抗心磷脂抗体阳性、脑脊液检查提示炎症等[14]。而烟雾病患儿相关炎性指标则多数正常。
目前临床常用CTA、MRA或DSA评估颅内血管情况, 并辅助判断缺血性血管病的病因, 其中DSA是诊断烟雾病的金标准。烟雾病的DSA典型表现为颈内动脉远端、大脑前动脉、大脑中动脉不同程度的狭窄或闭塞, 且颅底烟雾血管生成。而血管炎引起的烟雾综合征DSA表现为血管节段性狭窄、闭塞, 血管壁增厚并强化。因此如需排除血管炎病变, 我们会增加主动脉弓造影检查, 并以此结果评估各大动脉是否存在节段性狭窄或典型的串珠样狭窄病变。烟雾病的患儿可通过DSA了解颅内动脉的狭窄状况、侧枝循环代偿情况及颈外动脉是否已建立侧支循环, 这对制定手术策略至关重要。由于有时烟雾状血管首发于一侧, 但随着年龄的增长, 另一侧病变开始逐渐出现, 因此发生于儿童的单侧病变也被认为是烟雾病[8]。对DSA资料进行回顾并通过Suzuki分期的结果判读评估患儿的烟雾病进展的情况, 可为手术方式的选择提供重要依据。本文15例患儿的Suzuki分期如下:Ⅱ期1例, Ⅲ期6例, Ⅳ期5例, Ⅴ期3例。其中3例Ⅴ期患儿已出现颈外动脉的代偿供血, 脑血管灌注尚可, 均予以保守治疗, 3个月后复查DSA均提示颈外动脉增粗, 通过侧枝循环向颅内皮层代偿供血, 临床上未见TIA及脑梗死症状出现。
2012年出版的烟雾病诊疗指南中明确指出, 对表现为缺血症状的烟雾病患者进行血管重建是有效的。手术治疗MMD的主要目标是逆转脑缺血和脑梗死, 从而保护大脑功能。儿童MMD通常表现为脑缺血症状, 脑灌注随着病情发展逐渐减小, 最终表现为脑缺血梗死, 通过外科手术将颈外动脉的血管融合灌注于大脑皮层已被证实对改善缺血症状有益。关于手术时机的选择, 目前较为一致的观点是一旦确诊应尽早接受手术, 但应避开脑梗死或颅内出血的急性期, 具体时间间隔仍存在争议[15]。目前手术方式可分为直接血运重建、间接血管重运及联合血运重建3类[8], 上述3种手术方案均可用于儿童烟雾病的治疗。由于幼儿的皮层血管极细, 行直接血管重建操作难度很大, 血管融合困难; 此外患儿头皮较薄, 分离颞浅动脉容易导致头皮血供差, 从而引起头皮坏死。而间接血管重建则是利用头皮、颞肌、硬脑膜的颈外动脉供血分支与大脑皮层血管融合, 从而达到颈外动脉向颅内代偿供血的目的, 该方式已普遍用于儿童烟雾病的手术治疗中[16]。相关研究显示, 在儿童患者中采用的方式主要为间接搭桥, 且效果显著(将术后1~5年时间点的卒中风险由32% ~90%降低为 < 5%)[17]。2017的一篇文献回顾描述了每种方法的优势和劣势, 通过术后10年各项指标对比该研究团队发现, 间接方法治疗烟雾病比直接方法更有优势[18]。同时, 间接血管重建术方式也很多, 本研究中12例接受了EDMS术及MBH术。EDMS术充分利用脑膜中动脉、颞深动脉及颞浅动脉, 将绝大部分颞肌贴敷于脑皮层, 术后融合的血管范围广、数量多, 主要覆盖于大脑中动脉供血区。其中术中评估颞浅动脉粗细的目的在于判断是否需要分离颞浅动脉并行贴敷术, 本研究中7侧颞浅动脉较粗, 较易分离, 遂行EDMS时同期行分离颞浅动脉行贴敷术, 术后无一例头皮坏死。其中3例患儿由于前额叶血供灌注较差, 单纯行EDMS无法明确改善该区域血供, 遂向额部扩大切口, 联合行额骨钻孔术, 骨窗直径均在2.5 cm左右, 切开硬脑膜向内侧翻转, 同时切开相应蛛网膜, 还纳骨瓣。3侧联合手术后复查DSA, 发现该区域硬膜血供向皮层代偿良好, 因此我们认为, 联合运用EDMS及MBH能达到更大范围的间接血管重建, 可显著改善大范围脑缺血区域的重新灌注。12例幼儿烟雾病幼儿共行17侧手术, 围手术期中1侧出现硬膜下出血, 其余16侧均未出现手术侧脑梗死、出血、颞肌占位及头皮坏死等并发症。由此可以看出, EDMS治疗烟雾病相对简单、安全。3个月后复查DSA均可见颈外动脉向脑皮层血管出现不同程度的代偿, 证明血管融合效果满意。
综上所述, 幼儿烟雾病多表现为缺血性改变。经MRI及DSA检查明确诊断后, 应根据血管代偿及灌注情况尽早行间接脑血管融合术, 及时接受诊治的患儿多预后良好。
| 1 |
Ikezaki K, Han DH, Kawano T, et al. A clinical comparison of definite moyamoya disease between South Korea and Japan[J]. Stroke, 1997, 28(12): 2513-2517. DOI:10.1161/01.STR.28.12.2513. |
| 2 |
Suzuki J, Takaku A. Cerebrovascular "moyamoya" disease.Disease showing abnormal net-like vessels in base of brain[J]. Arch Neurol, 1969, 20(3): 288-299. DOI:10.1001/archneur.1969.00480090076012. |
| 3 |
Wakai K, Tamakoshi A, Ikezaki K, et al. Epidemiological features of moyamoya disease in Japan:findings from a nationwide survey[J]. Clin Neurol Neurosurg, 1997, 99(suppl 2): S1-S5. |
| 4 |
Im SH, Cho CB, Joo WI, et al. Prevalence and epidemiological features of moyamoya disease in Korea[J]. J Cerebrovasc Endovasc Neurosurg, 2012, 14(2): 75-78. DOI:10.7461/jcen.2012.14.2.75. |
| 5 |
Ahn IM, Park DH, Hann HJ, et al. Incidence, prevalence, and survival of moyamoya disease in Korea:a nationwide, population-based study[J]. Stroke, 2014, 45(4): 1090-1095. DOI:10.1161/STROKEAHA.113.004273. |
| 6 |
Duan L, Bao XY, Yang WZ, et al. Moyamoya disease in China:its clinical features and outcomes[J]. Stroke, 2012, 43(1): 56-60. DOI:10.1161/STROKEAHA.111.621300. |
| 7 |
Kuroda S, Houkin K. Moyamoya disease:current concepts and future perspectives[J]. Lancet Neurol, 2008, 7(11): 1056-1066. DOI:10.1016/S1474-4422(08)70240-0. |
| 8 |
Kim T, Lee H, Bang JS, et al. Epidemiology of Moyamoya Disease in Korea:Based on National Health Insurance Service Data[J]. J Korean Neurosurg Soc, 2015, 57(6): 390-395. DOI:10.3340/jkns.2015.57.6.390. |
| 9 |
Hu J, Luo J, Chen Q. The susceptibility pathogenesis of Moyamoya disease[J]. World Neurosurgery, 2017, 101(10): 731-741. DOI:10.1016/j.wneu.2017.01.083. |
| 10 |
Park EK, Lee YH, Shim KW, et al. Natural history and progression factors of unilateral moyamoya disease in pediatric patients[J]. Childs Nerv Syst, 2011, 27(8): 1281-1287. DOI:10.1007/s00381-011-1469-y. |
| 11 |
Smith ER, Scott RM. Spontaneous occlusion of the circle of Willis in children:pediatric moyamoya summary with proposed evidence-based practice guidelines[J]. J Neurosurg Pediatr, 2012, 9(4): 353-360. DOI:10.3171/2011.12.PEDS1172. |
| 12 |
Research committee on the pathology and treatment of spontaneous occlusion of the circle of willis; health labour sciences research grant for research on measures for infractable diseases. Guidelines for diagnosis and treatment of moyamoya disease (spontaneous occlusion of the circle of Willis)[J]. Neurol Med Chir (Tokyo), 2012, 52(5): 245-266. DOI:10.2176/nmc.52.245. |
| 13 |
Kim SK, Cho BK, Phi JH, et al. Pediatric moyamoya disease:an analysis of 410 consecutive cases[J]. Anna Neurol, 2010, 68(1): 92-101. DOI:10.1002/ana.21981. |
| 14 |
Kuker W, Gaertner S, Nagele T, et al. Vessel wall contrast enhancement:a diagnostic sign of cerebral vasculitis[J]. Cerebrovasc Dis, 2008, 26(1): 23-29. DOI:10.1159/000135649. |
| 15 |
Matsushima Y, Aoyagi M, Masaoka H, et al. Mental outcome following encephaloduro-arteriosynangiosis in children with moyamoya disease with the onset earlier than 5 years of age[J]. Childs Nerv Syst, 1990, 6(8): 440-443. DOI:10.1002/ana.21981. |
| 16 |
Guzman R, Lee M, Achrol A, et al. Clinical outcome after 450 revascularization procedures for moyamoya disease.Clinical article[J]. J Neurosurg, 2009, 111(5): 927-935. DOI:10.3171/2009.4.JNS081649. |
| 17 |
Scott RM, Smith ER. Moyamoya disease and moyamoya syndrome[J]. N Engl J Med, 2009, 360(13): 1226-1237. DOI:10.1056/NEJMra0804622. |
| 18 |
Macyszyn L, Attiah M, Ma TS, et al. Direct versus indirect revascularization procedures for moyamoya disease:a comparative effectiveness study[J]. J Neurosurg, 2017, 126(5): 1523-1529. DOI:10.3171/2015.8.JNS15504. |
 2019, Vol. 18
2019, Vol. 18


