儿童神经肿瘤(又称中枢神经系统肿瘤)是除血液系统恶性肿瘤外最常见的儿童肿瘤, 约占儿童肿瘤的15% ~20%, 也是儿童最常见的实体肿瘤。该病在5~9岁的男性患儿中较为常见, 而在0~14岁患儿中, 脑肿瘤是最为常见的肿瘤相关死因。有别于成人常见的高级别胶质瘤, 低级别胶质瘤在儿童中更加常见。
一、儿童神经肿瘤常见病理类型和好发部位我国早期报道的儿童神经肿瘤发病率为每年2.2/100 000~2.5/100 000, 男性发病率稍高于女性(约1.1 : 1), 神经肿瘤发病率排名前五类分别是星形细胞肿瘤、颅咽管瘤、髓母细胞瘤、生殖细胞肿瘤和室管膜瘤[2]。
华中科技大学同济医学院附属同济医院2011至2018年共收治了828例18岁以下接受神经肿瘤相关手术的患儿, 其中脑肿瘤715例、椎管肿瘤113例; 715例脑肿瘤中, 各种组织病理类型占比从高到低依次为:低级别胶质瘤23.6%、髓母细胞瘤11.2%、颅咽管瘤9.0%、垂体瘤8.4%、室管膜瘤7.8%、高级别胶质瘤6.9%、血管瘤(海绵状血管瘤)6.3%、生殖细胞肿瘤4.5%、脑膜瘤3.1%、脉络丛乳头状瘤/癌2.7%、其他恶性肿瘤2.4%、原始神经外胚层肿瘤2.1%。从年龄分布来看, 儿童垂体瘤主要见于15岁以上患儿(88.3%)。
就好发部位而言, 脑肿瘤中幕上肿瘤占64.8%(其中幕上半球肿瘤占56.4%、幕上中线肿瘤占43.6%); 幕下肿瘤占35.2%(小脑及四脑室肿瘤占84.9%、脑干及脑干旁小脑外肿瘤占15.1%), 而椎管肿瘤占所有神经系统肿瘤的13.6%。
从病理类型和病变部位来看, 幕上肿瘤中, 良性(WHOⅠ级)、恶性(WHOⅡ级及以上)肿瘤比例基本接近, 常见的良性肿瘤包括:颅咽管瘤、垂体瘤(主要见于青少年)、Ⅰ级的低级别胶质瘤(黏液细胞星形细胞瘤、胚胎发育不良性神经外胚层肿瘤DNET等)、海绵状血管瘤、脑膜瘤、脉络丛乳头状瘤、生殖细胞肿瘤(成熟畸胎瘤)等, 多见于幕上中线部位。幕上常见的恶性肿瘤则包括:Ⅱ级的低级别胶质瘤、高级别胶质瘤、室管膜瘤、生殖细胞肿瘤(多为生殖细胞瘤)、原始神经外胚层肿瘤(primary neuroectodermal tumor, PNET)等, 以幕上半球部位多见。幕下肿瘤中, 常见病理类型包括:髓母细胞瘤(31.3%)、毛细胞星形细胞瘤(15.9%)、室管膜瘤(11.9%)、高级别胶质瘤(10.7%)等。就肿瘤大小而言, 约68.2%肿瘤直径>3 cm, 约17.8%肿瘤直径>6 cm, 约0.6%肿瘤直径>10 cm。
从上述数据可以看出, 儿童神经肿瘤中良、恶性比例接近, 幕上中线肿瘤以颅咽管瘤、Ⅰ级的低级别胶质瘤等良性肿瘤相对多见, 幕上半球则以Ⅱ级和高级别胶质瘤、室管膜瘤等恶性肿瘤相对多见。幕下肿瘤最常见的是髓母细胞瘤, 也有一定比例的良性毛细胞星形细胞瘤, 然后是室管膜瘤。低级别胶质瘤是儿童最常见的颅内肿瘤(约占1/4), 与文献报道一致。部分肿瘤具有巨大生长特性, 特别是在婴幼儿患者中。
二、儿童神经肿瘤危害和慢病特点 (一) 儿童恶性神经肿瘤治疗困难、预后差儿童恶性脑肿瘤除了较多见的髓母细胞瘤、室管膜瘤等, 还包括一些相对少见的病理类型(如PNET、非典型畸胎瘤样横纹肌样瘤等高度恶性且可能在术后短期内复发和转移的类型), 且往往见于婴幼儿(图 1)。这部分患儿往往无法接受放疗, 而化疗药物的选择和治疗效果也非常有限。同时, 这部分婴幼儿脑肿瘤巨大生长的情况更多见, 术后出现脑积水概率更大, 往往需要通过多次手术综合处理(图 2)。因此, 除了Wnt、Shh等亚型的髓母细胞瘤以及生殖细胞瘤可以通过综合治疗得到良好的控制外, 大多数儿童恶性脑肿瘤仍具有难以控制、预后极差的特点, 在治疗上仍然存在着巨大挑战。
|
Download:
|
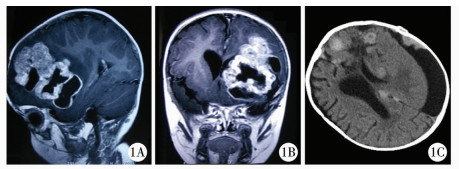
| 图 1 男, 十月龄, 非典型畸胎瘤样横纹肌样瘤 A、B:MRI提示左侧额颞叶肿瘤; C、术后20余天复查CT提示全脑种植转移。 Fig. 1 A 10-month-old boy with atypical teratoma-like rhabdoid tumor | |
|
Download:
|
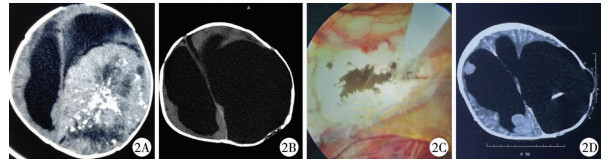
| 图 2 女, 13月龄, 巨大间变型室管膜瘤 A:MRI提示左侧大脑半球巨大肿瘤; B:行占位切除术后; C:术后1月患儿出现脑积水, 行内镜下透明隔造瘘+脑室腹腔分流术; D:术后3年分流管堵塞且CT提示肿瘤多处转移。 Fig. 2 A 13-month-old girl with giant interstitial ependymoma | |
儿童最常见的低级别胶质瘤、颅咽管瘤等虽然为低度恶性或良性肿瘤, 无论采取手术治疗还是采取放、化疗等综合治疗方案, 病情仍然会缓慢进展、复发(部分颅咽管瘤具有反复、快速生长的恶性行为特点), 病情往往会迁延10余年甚至更长, 形成典型的慢病特点。这在一方面对患儿的生存质量提出了更高的要求, 另一方面对肿瘤的控制也凸显出专业和多学科合作的重要性。
儿童脑肿瘤的慢病特点中, 治疗过程中的任意环节出现意外均可能导致神经系统后遗症的发生, 包括肿瘤本身、手术治疗、化疗、放疗以及上述因素的共同作用等[1]。一项只以接受手术治疗的儿童肿瘤患者为观察对象的研究结果表明:约35%的患儿术后会出现严重的共济失调、痉挛性瘫痪、严重视力减弱或每年超过两次的癫痫; 一组针对19例接受小脑肿瘤切除术患儿的研究中, 研究者发现患儿的执行能力出现了明显的减弱(包括规划和排序、视觉-空间感、语言表达、言语记忆以及情感控制等)。反复的神经外科手术导致的后遗症使这些患儿的恢复变得更艰难, 因此需要进行长期的随访跟踪。在对100例接受小脑星形细胞瘤术后患儿随访31年后发现, 9例在儿童阶段因复发需要再次接受手术, 另15例因脑积水需置入分流管, 其中有4例因分流管故障行一次或多次调整[1]。
术后放疗在儿童脑肿瘤的治疗中可导致神经系统后遗症是有明确证据的。因为即使采用了适宜放疗技术, 患儿仍可出现多种后遗症, 包括:智力损伤、内分泌紊乱、肥胖、嗜睡、血管病及神经系统铁沉积症等。因此, 对于处于神经系统快速发育、突触和髓鞘不断成熟和完善的婴幼儿和低龄儿童, 化疗替代放疗在儿童脑肿瘤治疗中往往会成为首选, 甚至是唯一选择。对脑肿瘤患儿来说, 化疗会造成全身性副反应, 有证据表明甲氨蝶呤的鞘内注射剂量与次数与患儿智力的下降程度均呈明显相关。并且, 持久的术后化疗及以亚硝基肼为基础的化疗方案具有使肿瘤发生恶性转化的风险。
三、儿童神经肿瘤不同于成人的临床和病理特点 (一) 儿童低级别胶质瘤(Pediatric low-grade gliomas, PLGG)以儿童最常见的低级别胶质瘤为例, 病理类型多为毛细胞型星形细胞瘤(pilocytic astrocytoma, PA, WHO Ⅰ级), 好发于小脑和视路, 而成人常见的少突胶质细胞瘤和弥漫性星形细胞瘤在小儿中相对少见; 同时, 成人常见的分子病理改变(如IDH、1p19q缺失, TP53、Tert表达异常等)也鲜见于PLGG, 故不能直接将其作为预后等级的分层因素。PLGG特征性的基因改变, 多累及MAPK(mitogen-activated protein kinase)信号通路, 包括:BRAF基因融合突变或V600E点突变、FGFR1点突变、NF1突变、CDKN2A以及NTRK2突变等[3]。因此, PLGG虽然在组织病理形态上和成人肿瘤相似, 但就分子病因而言, 可以认为PLGG与成人肿瘤是两种不同的疾病。此外, PLGG中基因突变的发生频率相对较低, 平均每个肿瘤中仅可检测到一个基因突变, 因此更容易确认相应的致病突变关系和机制, 同时也提供了更为明确的治疗靶点。相应靶点均有成熟的上市靶向药物, 且已有报道或临床试验正在进行。PLGG还有一个不同于成人的显著临床特点, 就是很少有肿瘤会向高级别胶质瘤发生转化(3% ~10%)。
(二) 儿童高级别胶质瘤(pediatric high-grade gliomas, PHGG)儿童高级别胶质瘤的中位生存期为9~15个月, 最显著的分子病理改变是组蛋白H3的基因突变。儿童胶质瘤里有一种特殊类型被称为弥漫性桥脑胶质瘤(diffuse intrinsic pontine glioma, DIPG), 好发于6~8岁儿童, 预后较其他高级别胶质瘤更差。2016版WHO中枢神经系统肿瘤新分类将分子病理诊断与组织病理诊断相结合, 将具有组蛋白H3突变的中线结构胶质瘤单独作为一个新的类型。WHO新分类也将此类H3突变的中线胶质瘤归为Ⅳ级, 但其组织病理学分级为WHO Ⅱ级, 肿瘤进展迅速, 中位生存期9~12个月。H3K27M突变常与p53的过表达和ATRX缺失相关联。目前研究发现DIPG中约80%发生H3突变, 其中约2/3为H3.3K27M突变, 即H3.3中第27位的赖氨酸被甲硫氨酸所取代, 其次为H3.1K27M突变。H3K27M突变可引起组蛋白三甲基化的缺失, 导致H3K27M的低甲基化, 影响基因组转录稳定性, 可能导致异常的表观遗传沉默、引起异常的细胞周期调控、抑制细胞自噬行为、介导化疗抵抗。但是, 仅H3K27M突变不足以在活体内形成肿瘤, 往往合并TP53/PPM1D, ACVR1/PI3KR等突变才会促进肿瘤形成。动物实验发现, H3K27M可抑制细胞分化、促进脑干神经干细胞的自我更新, 选择性地加速动物后脑的肿瘤形成, 和Tp53及PDGFRa突变一起可以共同诱导形成DIPG, 而敲除H3K27M突变基因可促进肿瘤细胞分化、抑制肿瘤生长, 提示H3K27M可能可以作为治疗DIPG的靶点。
(三) 其他类型儿童神经肿瘤除上述儿童胶质瘤外, 其他类型肿瘤也存在不同于成人的临床和病理特点。比如儿童少见的脑膜瘤, 脑室内型在临床上较成人多见, 具有巨大生长和囊变特点, 病理类型以移行性和纤维型多见, 其中纤维型大多巨大且伴囊变, 易复发[4]。此外, 婴幼儿室管膜瘤、儿童PNET等均有巨大生长的特点, 本组资料中, 肿瘤直径>6 cm(甚至>10 cm)的以此类病理类型居多。
总之, 儿童脑肿瘤有别于成人的分子病理特点和临床表现, 可能与儿童(特别是婴幼儿阶段)特殊的神经发育背景及其颅骨颅腔的生长发育特点有关[5]。
四、儿童神经肿瘤基础和临床研究现状目前, 儿童脑肿瘤基础研究所积累的数据及经验远不及成人脑肿瘤。在2016年新版的WHO中枢神经系统分类中加入了分子病理的相关内容, 最显著的特点是依据脑肿瘤的分子病理特征明确组织形态, 以诊断临床上辨别较为困难的病理类型、指导预后分层和放化疗方案。然而, 除了好发于儿童的髓母细胞瘤在该版分类中加入了较为明确的分子病理内容外, 其他类型的儿童神经肿瘤并没有更多地涉及儿童脑肿瘤的分子病理。
针对PLGG患儿出现的特征性基因改变, 目前已有靶向治疗临床试验正在进行(表 1、表 2)[6]。PLGG患儿总体生存期长, 因此对患儿的神经功能、生活质量均提出了更高的要求。传统化疗或放疗对病灶部位并不敏感, 且具有一定的毒副作用, 相关临床试验往往历时数年甚至数十年。而对于已有或即将进行的临床试验, 需要加入基因检测指标, 进一步明确靶向治疗的效用, 解决靶向治疗与传统化疗的联合以及联合治疗的先后时机等问题。随着二代测序技术的普及和成本的不断降低, 今后有望积累更多PLGG的基因组信息并深入了解其中的驱动突变特征。除了PLGG, 颅咽管瘤中也发现特异性的CTNNB1和BRAF V600E突变, 并有相应的靶向治疗成功的病例报道和相关临床试验正在开展。
|
|
表 1 目前国际上进行的NF1阴性儿童低级别胶质瘤患儿前瞻性临床试验研究资料 Table 1 Prospective clinical trial data of low-grade glioma in NF1-negative children |
|
|
表 2 目前国际上进行的NF1阳性儿童低级别胶质瘤患儿前瞻性临床试验研究资料 Table 2 Prospective clinical trial data of low-grade glioma in NF1-positive children |
此外, 儿童神经肿瘤研究尚需要更完善的临床资料和分子检测数据库资料, 目前关于儿童脑肿瘤的数据库(除髓母细胞瘤外)相对较少, 肿瘤基因检测或表达谱数据库则更少。国内已有北京、上海等地的医疗单位正在积极开展相应工作, 参与相应的国际合作临床试验项目。
五、小结神经肿瘤是继血液系统恶性肿瘤外最常见的儿童肿瘤。无论是好发部位还是病理类型(或是同种病理类型而完全不同的临床疾病进程和分子改变), 均表现出不同于成人的显著特点。儿童(特别是婴幼儿)恶性脑肿瘤的恶性程度高, 多数患儿无法接受放疗, 或肿瘤对放疗不敏感, 而化疗药物的选择和效果也非常有限, 故预后较差。常见的低级别胶质瘤、颅咽管瘤因具有缓慢进展或复发、病情迁延等一系列慢病特点, 随着二代测序技术的进步和成本的降低, 儿童神经肿瘤分子机制的研究也在不断深入(如2016版WHO新分类中将具有组蛋白H3突变的中线结构胶质瘤单独作为新的Ⅳ级胶质瘤类型, 并认为H3K27M可能可以作为治疗DIPG的靶点)。未来儿童神经肿瘤的研究, 更需要多中心合作的临床试验和完善的临床资料及分子病理数据库来提供新的思路。
| 1 |
Fountain DM. Multidisciplinary rehabilitation for children with brain tumors:A systematic review[J]. Dev Neurorehabil, 2017, 20(2): 68-75. DOI:10.3109/17518423.2015.1065017. |
| 2 |
周大彪, 罗世祺, 马振宇, 等. 1267例儿童神经系统肿瘤的流行病学[J]. 中华神经外科杂志, 2007, 23(1): 4-7. DOI:10.3760/j.issn:1001-2346.2007.01.002. Zhou DB, Luo SQ, Ma ZY, et al. Epidemiology of nervous system tumors in childhood:a survey based on [1267] consecutive cases[J]. Chinese Journal of Neurosurgery, 2007, 23(1): 4-7. DOI:10.3760/j.issn:1001-2346.2007.01.002. |
| 3 |
陈籽荣, 王震, 厉亚坤, 等. 儿童低级别胶质瘤的分子病理特点和临床意义[J]. 中华医学杂志, 2018, 98(5): 393-396. DOI:10.3760/cma.j.issn.0736-2491.2018.05.019. Chen ZR, Wang Z, Li YK, et al. Molecular pathology and clinical implications of pediatric low-grade glioma[J]. Natl Med J China, 2018, 98(5): 393-396. DOI:10.3760/cma.j.issn.0736-2491.2018.05.019. |
| 4 |
万锋, 王玉平, 陈劲草, 等. 儿童脑膜瘤23例报告[J]. 中华小儿外科杂志, 2002, 23(4): 310-312. DOI:10.3760/cma.j.issn.0253-3006.2002.04.006. Wan F, Wang YP, Chen JC, et al. Meningiomas in children:a report of 23 cases[J]. Chinese Journal of Pediatric Surgery, 2002, 23(4): 310-312. DOI:10.3760/cma.j.issn.0253-3006.2002.04.006. |
| 5 |
Jones DT, Kieran MW, Bouffet EA, et al. Pediatric low-grade gliomas:next biologically driven steps[J]. Neuro Oncol, 2018, 20(2): 160-173. DOI:10.1093/neuonc/nox141. |
| 6 |
Thangarajh M, Gutmann DH. Low-grade gliomas as neurodevelopmental disorders:insights from mouse models of neurofibromatosis-1[J]. Neuropathology & Applied Neurobiology, 2012, 38(3): 241-253. DOI:10.1111/j.1365-2990.2011.01230.x. |
 2019, Vol. 18
2019, Vol. 18


