在儿童癫痫的发病原因中, 脑肿瘤约占1% ~3%[1-5]。其中, 低级别肿瘤的发病率要远远高于高级别肿瘤[5]。约70%低级别肿瘤患儿在疾病进程中至少会出现一次癫痫发作[3, 5, 6]。常见的致痫性低级别肿瘤包括节细胞胶质瘤、胚胎发育不良性神经上皮瘤、弥漫星形细胞瘤、毛细胞性星形细胞瘤、多形性黄色星形细胞瘤、少突胶质细胞瘤等, 这些肿瘤多呈良性生长, 发生恶变的概率极低, 甚至呈静止状态达数十年。与恶性肿瘤不同, 低级别肿瘤患儿往往有很长的生存期, 如何控制癫痫发作并保证患儿的生活质量是患儿家长最关心的问题[7]。肿瘤相关癫痫倾向于呈顽固性, 且严重影响患儿生活质量, 致使其认知功能减退, 并导致一系列并发症[4, 7, 8]。所以, 致痫性肿瘤一经发现, 应在条件允许的情况下尽早行手术治疗; 且手术治疗的目的不仅包括手术切除肿瘤, 还包括儿童癫痫手术, 力求在肿瘤、癫痫、神经心理发育三方面达到最优治疗结局[8-10]。
目前, 如何设计儿童致痫性低级别肿瘤的手术切除范围并制定手术策略尚未达成共识, 笔者结合自身临床经验, 对儿童致痫性低级别肿瘤的手术策略与切除范围设计提出自己的见解。
一、肿瘤切除程度与预后的关系已经有众多研究证实, 肿瘤全切除可有效预防术后发作, 达到控制病情的目的[10]。Dario J.Englot[9]纳入了41项研究共1 181例位于颞叶的致痫性低级别肿瘤患者资料, 发现肿瘤次全切除术后癫痫无发作的人数仅占总观察人数的42.7%, 而肿瘤全切除术后癫痫无发作的人数则占总观察人数的78.6%。如果在肿瘤全切除的基础上还结合致痫结构的选择性切除(如海马切除、新皮质切除或海马加新皮质切除), 术后无发作率则提高至86.0% ~87.0%。因此, 手术应尽量做到肿瘤的全切除。值得注意的是, 应尽量避免在单一模态的影像下完成切除, 因为这样处理可能遗漏一部分病灶, 最好是在多模态影像下观察肿瘤所累及的范围, 充分切除各种病变成分(如CT所显示的钙化灶、T1增强序列强化灶以及T2 Flair序列信号增高灶等)。
有时肿瘤术后少许残留并不意味着发作控制不佳。三九脑科医院收治的30例行手术治疗的低级别肿瘤伴癫痫患儿中, 有7例行肿瘤次全切除, 其中4例肿瘤通过内侧颞叶累及基底节, 3例肿瘤累及中央区及深部锥体束。7例均为基底节或深部白质残留少许肿瘤, 但术后均未出现癫痫发作, 原因可能是:第一, 不同部位肿瘤的致痫性很可能存在差异, 位于深部白质或基底节的肿瘤残余部分致痫性并不高, 而更易于导致癫痫的皮层或近皮层部位的肿瘤已经被完全切除, 因此整体治疗效果仍然良好; 第二, 经次全切除, 原肿瘤所造成的局部占位或压迫效应已经解除, 减少了对周围皮层的刺激[11]。因此, 对于累及深部功能结构的肿瘤, 临床上允许为保护功能而行次全切除。
二、致病区切除不容忽视目前国内很多神经外科医师十分重视全切肿瘤的方案设计, 但忽视了对致痫区的处理, 普遍的误解是认为癫痫系肿瘤引发, 只要切除肿瘤就能控制癫痫。在癫痫外科, 致痫病灶并不等同于致痫区[12]。由于双重病理因素的存在, 致痫区与致痫病灶并不重叠, 有时致痫区的范围甚至超出了肿瘤本身(如前述荟萃分析结果所示), 结合致痫结构扩大切除范围方能进一步提高手术疗效[9]。
关于具体如何扩大切除致痫结构, 一种经验式的做法是扩大切除肿瘤周边1~2 cm的范围皮质区域[14], 以更好地控制癫痫发作。但也有颅内电极研究显示距离肿瘤边界1.5 cm以外的远隔皮层也可呈现发作起始表现[15]。一般而言, 切除范围的设计应考虑病史、影像、脑电图、PET等术前评估资料, 还应考虑术中电生理监测、患者受教育程度和对脑功能的需求等因素。如位于颞叶外侧新皮质的低级别肿瘤, 手术是否切除海马、杏仁核等内侧颞叶结构应有不同的指征:若患者癫痫病史较长, 发作呈药物难治性, 症状学符合典型内侧颞叶癫痫表现, MRI影像显示内侧颞叶信号增高, 则更倾向于选择更大范围的切除(如结合前颞叶切除术或选择性杏仁核海马切除术); 反之, 则可考虑行较为保守的肿瘤周边扩大切除, 保留内侧颞叶结构。手术策略制定前还需要预估肿瘤性质, 以胚胎发育不良性神经上皮瘤(dysembryoplastic neuroepithelial tumor, DNET)为例, 如果影像学结果提示DNET呈简单型, 那么仅仅切除肿瘤即可较为理想地控制发作; 倘若DNET为复杂型或非特异型, 则需要在肿瘤切除的基础上进一步结合致痫皮质切除[13]。此外, 患儿自身状态与家庭条件也是纳入考量的因素之一:若患儿自身状态优良, 家庭经济条件相对较好, 对记忆等高级脑功能的保留有着较高要求, 可考虑先行肿瘤切除, 保留海马等内侧颞叶结构, 随访观察癫痫控制效果, 待未来证实的确残存内侧颞叶癫痫后再考虑二期手术切除内侧颞叶; 但如果患儿术前即存在明显记忆障碍或神经功能发育迟滞, 手术切除颞叶不太可能引起新的神经缺失或加重病情恶化, 且低收入家庭经济条件仅够支持患儿完成一次手术, 则可考虑积极行前颞叶切除术, 力求一步到位解决肿瘤和癫痫两方面的问题[14]。还应强调的是, 手术切除范围的设计应与患方充分沟通, 权衡肿瘤、癫痫、脑功能三者功能及结构层面的得失取舍, 做到让患者充分知情。典型病例见图 1。
|
Download:
|
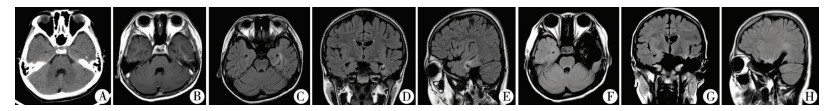
| 图 1 顽固性癫痫典型病例 患儿10岁男孩, 右利手, 顽固性癫痫病史9年。发作症状:眨眼→口咽自动运动→植物神经症状(心慌)。脑电图显示左颞区癫痫样放电。影像学提示左侧颞叶囊实性病变。图A中CT可见病变含钙化灶。图B中MRI增强后可见病变部位有所强化。图C至图E中T2 Flair序列显示病变呈高信号, 累及左侧梭状回、海马旁回中部。上述影像表现符合节细胞胶质瘤特征。考虑患儿癫痫病史长, 呈顽固性, 发作症状学符合典型内侧颞叶癫痫表现, 家庭经济条件一般, 故在切除范围设计时不能仅仅考虑病变本身, 还应扩大行前颞叶切除(包括杏仁核及海马区域)。图F至图H中术后MRI复查T2 Flair序列显示病灶以及前颞叶已被彻底切除。病理结果:节细胞胶质瘤(WHO Ⅰ级)。患儿术后随访两年余未见发作。 Fig. 1 Typical case of intractable epilepsy | |
术前评估中, 当常规头皮脑电图不能准确定位、术前各检查结果不完全一致或致痫区与脑重要功能区关系密切时, 应采用颅内电极脑电图(intracranial electroencephalogram, IEEG)进行评估。颅内电极脑电图包括硬膜下电极脑电图(Subdural EEG)和立体脑电图(Stero-EEG), 它们可以精确定位癫痫发作的起始位置及癫痫放电的传导方式, 有助于术者理解肿瘤致癫痫的病理生理机制[15, 16]。但由于iEEG对技术要求高, 诊治环节多, 诊疗时间周期长, 经济成本较高, 一般行业内很少常规针对低级别肿瘤行颅内电极置入。
四、术中电生理监测的指导意义术中皮层脑电图(electrocorticogram, ECoG)反映的是大脑间歇期的放电情况, 但一般情况下术中脑电信号可能受麻醉药物的影响, 且术中监测时间短, 采集的脑电信号仅局限于术区范围, 以脑表面皮层为主, 难以探测完整的致痫网络, 因此ECoG对于癫痫放电的检测在时间和空间方面都存在局限性。目前, ECoG对癫痫手术的指导意义及手术预后的评估价值尚存在争议。多数专家认为, 尽管ECoG不能作为指导手术切除的金标准, 但其应用仍能够显著改善患者术后癫痫发作控制的结局, 提高患者的癫痫长期治愈率[17-20]。
五、功能区致痫性肿瘤的切除策略由于儿童患者配合程度低, 术前评估中功能磁共振成像(functional magnetic resonance imaging, fMRI)、脑磁图(Magnetoencephalography, MEG)、Wada实验等功能性检查及术中唤醒技术均较成人更难实施。因此对于儿童功能区致痫性肿瘤, 其处理一直存在着挑战。应强调的是功能保护是放在首位的。对于低级别肿瘤而言, 牺牲重要功能(运动、语言等)来换取肿瘤全切是不可取的, 应在保障功能安全的前提下尽可能全切肿瘤[11]。
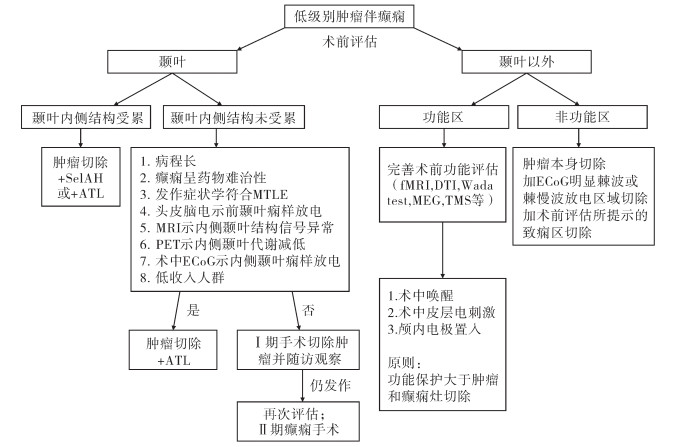
肿瘤本身一般无功能, 故如果病灶边界清楚, 大多能做到完整切除肿瘤; 如果边界不清, 则可在术中电刺激或术中唤醒的状态下进行肿瘤的最大化切除。年龄小并非术中唤醒的绝对禁忌指标, 经评估发现, 心智发育较好以及可以配合简单语言、运动任务的儿童, 亦可以实施术中唤醒。本院收治病例中, 有3例接受术中唤醒状态下手术, 年龄最小者仅10岁[11]。图 2为笔者结合临床经验自行总结的儿童致痫性低级别肿瘤的外科诊治策略图。
|
Download:
|
| 图 2 儿童致痫性低级别肿瘤的外科诊治策略图 Fig. 2 Surgical strategy of epileptic low-grade tumors in children | |
总之, 对于儿童致痫性低级别肿瘤的手术, 不能将其视为单纯的肿瘤手术, 而应充分结合现代癫痫外科理念, 在保护患儿脑功能的前提下, 最大程度切除肿瘤和致痫结构。
| 1 |
Fattal-Valevski A, Nissan N, Kramer U, et al. Seizures as the clinical presenting symptom in children with brain tumors[J]. J Child Neurol, 2013, 28(3): 292-296. DOI:10.1177/0883073812445786. |
| 2 |
Khajavi K, Comair YG, Wyllie E, et al. Surgical management of pediatric tumor-associated epilepsy[J]. J Child Neurol, 1999, 14(1): 15-25. |
| 3 |
Ullrich NJ, Pomeroy SL, Kapur K, et al. Incidence, risk factors, and longitudinal outcome of seizures in long-term survivors of pediatric brain tumors[J]. Epilepsia, 2015, 56(10): 1599-1604. DOI:10.1111/epi.13112. |
| 4 |
Ceddia A, Di Rocco C, Iannelli A, et al. Epilepsy and low grade gliomas in pediatric neurosurgery[J]. J Neurosurg Sci, 1993, 37(2): 91-95. |
| 5 |
Borwn MT, Boop FA. Epilepsy surgery for pediatric low-grade gliomas of the cerebral hemispheres:neurosurgical considerations and outcomes[J]. Childs Nerv Syst, 2016, 32(10): 1923-1930. DOI:10.1007/s00381-016-3162-7. |
| 6 |
You G, Sha Z, Jiang T. The pathogenesis of tumor-related epilepsy and its implications for clinical treatment[J]. Seizure, 2012, 21(3): 153-159. DOI:10.1016/j.seizure.2011.12.016. |
| 7 |
Klein M, Engelberts NH, van der Ploeg HM, et al. Epilepsy in low-grade gliomas:the impact on cognitive function and quality of life[J]. Ann Neurol, 2003, 54(4): 514-520. DOI:10.1002/ana.10712. |
| 8 |
郭强, 朱丹, 潘伟东, 等. 神经节细胞胶质瘤伴癫痫21例临床分析[J]. 立体定向和功能性神经外科杂志, 2011, 2(2): 97-100. Guo Q, Zhu D, Pan WD, et al. Clinical researeh of gang lioglioma with epilepsy(21 cases report)[J]. Chinese Journal of Stereotactic and Functional Neurosurgery, 2011, 2(2): 97-100. |
| 9 |
Englot DJ, Han SJ, Berger MS, et al. Extent of surgical resection predicts seizure freedom in low-grade temporal lobe brain tumors[J]. Neurosurgery, 2012, 70(4): 921-928. DOI:10.1227/NEU.0b013e31823c3a30. |
| 10 |
Giulioni M, Marucci G, Pelliccia V, et al. Epilepsy surgery of "low grade epilepsy associated neuroepithelial tumors":A retrospective nationwide Italian study[J]. Epilepsia, 2017, 58(11): 1832-1841. DOI:10.1111/epi.13866. |
| 11 |
张伟, 郭强, 陈俊喜, 等. 儿童低级别肿瘤伴癫痫的外科治疗[J]. 中华神经外科杂志, 2018, 34(9): 894-897. DOI:10.3760/cma.j.issn.1001-2346.2018.09.007. Zhang W, Guo Q, Chen JX, et al. Surgical treatment of low-grade tumor with epilepsy in children[J]. Chinese Journal of Neurosurgery, 2018, 34(9): 894-897. DOI:10.3760/cma.j.issn.1001-2346.2018.09.007. |
| 12 |
Sommer B, Grummich P, Coras R, et al. Integration of functional neuronavigation and intraoperative MRI in surgery for drug-resistant extratemporal epilepsy close to eloquent brain areas[J]. Neurosurgical Focus, 2013, 34(4): E4. DOI:10.3171/2013.2.focus12397. |
| 13 |
Chassoux F, Landré E, Mellerio C, et al. Dysembryoplastic neuroepithelial tumors:epileptogenicity related to histogical subtypes[J]. J Clin Neurophysiol, 2013, 124(6): 1068-1078. DOI:10.1016/j.clinph,2012,11.015. |
| 14 |
谭启富, 胡志刚. 癫痫外科治疗在低收入人群中的策略[J]. 实用医院临床杂志, 2009, 6(4): 9-11. DOI:10.3969/j.issn.1672-6170.2009.04.004. Tan QF, Hu ZG. Strategies for surgical treatment of epilepsies in low income people[J]. Practical Journal of Clinical Medicine, 2009, 6(4): 9-11. DOI:10.3969/j.issn.1672-6170.2009.04.004. |
| 15 |
Mittal S, Barkmeier D, Hua J, et al. Intracranial EEG analysis in tumor-related epilepsy:Evidence of distant epileptic abnormalities[J]. Clinical Neurophysiology, 2016, 127(1): 238-244. DOI:10.1016/j.clinph.2015.06.028. |
| 16 |
Sweet JA, Hdeib AM, Sloan A, et al. Depths and grids in brain tumors:Implantation strategies, techniques, and complications[J]. Epilepsia, 2013, 54(9): 66-71. DOI:10.1111/epi.12447. |
| 17 |
Mikuni N, Ikeda A, Takahashi JA, et al. A step-by-step resection guided by electrocorticography for nonmalignant brain tumors associated with long-term intractable epilepsy[J]. Epilepsy & Behavior, 2006, 8(3): 560-564. DOI:10.1016/j.yebeh.2006.01.010. |
| 18 |
Wray CD, McDaniel SS, Saneto RP, et al. Is postresective intraoperative electrocorticography predictive of seizure outcomes in children?[J]. J Neurosurg Pediatr, 2012, 9(5): 546-551. DOI:10.3171/2012.1.PEDS11441. |
| 19 |
Fallah A, Weil AG, Sur S, et al. Epilepsy surgery related to pediatric brain tumors:Miami Children's Hospital experience[J]. J Neurosurg Pediatr, 2015, 16(6): 675-680. DOI:10.3171/2015.4.PEDS14476. |
| 20 |
Yao PS, Zheng SF, Wang F, et al. Surgery guided with intraoperative electrocorticography in patients with low-grade glioma and refractory seizures[J]. J Neurosurg, 2018, 128(3): 840-845. DOI:10.3171/2016.11.JNS161296. |
 2019, Vol. 18
2019, Vol. 18


