2. 深圳市儿童医院泌尿外科(广东省深圳市, 518038);
3. 中山大学附属第一医院病理科(广东省广州市, 510080)
2. Department of Urology Surgery, Municipal Children's Hospital, Shenzhen 518038, China;
3. Department of Pathology, First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是最常见的胃肠道间叶源性肿瘤,发病率约6.5/1 000 000~14.5/1 000 000,儿童期发病仅占1.5% ~2%,且早期没有明显的临床表现[1, 2]。本文回顾性分析中山大学附属第一医院近5年收治的3例儿童GIST的临床资料,并复习国内外文献,总结儿童GIST的诊治策略。
材料与方法 一、临床资料回顾性收集中山大学附属第一医院近5年收治的3例GIST患儿的临床资料,其中男童1例,女童2例,年龄分别为9岁、11岁和15.6岁;主因“头晕乏力、腹部不适”等就诊,临床表现包括:活动后虚弱、腹痛,排柏油样大便等(表 1)。
|
|
表 1 3例胃肠道间质瘤患儿的临床资料 Table 1 Clinical profiles of 3 children with gastrointestinal stromal tumors |
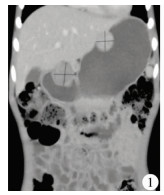
病例1:女,9岁,面色苍白、排黑便1个月,伴活动后虚弱、乏力,血红蛋白56 g/L,大便常规隐血(+++);肿瘤标志物均正常;腹部CT检查提示胃小弯侧内多发软组织占位(图 1);胃镜可见胃腔多发黏膜下隆起。纠正贫血后,行胃小弯侧部分切除术,术中可见多发的胃肿瘤。
|
Download:
|
| 图 1 胃肠道间质瘤患儿(病例1)腹部冠状位CT图 胃小弯侧两处肿物存在,向腔内外生长,与肝脏毗邻 Fig. 1 Abdominal coronal CT of Case No.1 | |
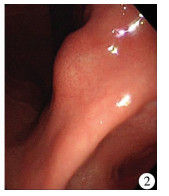
病例2:女,11岁,腹痛、排黑便7 d,腹痛以左上腹部为著,血红蛋白72 g/L,腹部CT检查提示胃肿瘤,行胃部分切除术,术后口服舒尼替尼治疗2个疗程,出现骨髓抑制后停药。术后18个月,复查时腹部CT检查提示胃胰间隙新发结节灶,胃镜可见胃体近胃角偏后壁见一3 cm半球形隆起病变,表面黏膜光滑(图 2)。肿瘤标志物均正常。行根治性远端胃切除术、胰颈部间质瘤切除术,术中探查胃胰间隙小弯侧一肿瘤;胃小弯后壁一肿物,侵犯胰颈部。
|
Download:
|
| 图 2 胃肠道间质瘤患儿(病例2)胃镜图 胃体小弯侧见一3 cm半球形隆起病变,向腔内及腔外突出,表面黏膜光滑 Fig. 2 Endoscopic view of Case No.2 | |
病例3:男,15岁8个月,活动后头晕2个月余,无腹痛,无恶心、呕吐,血红蛋白为37 g/L。肿瘤标志物血清铁蛋白4.78 g/L,而甲胎蛋白、癌胚抗原、铁蛋白、CA125、CA19-9均正常。胃镜检查提示胃体近胃角处黏膜下肿物,表面光滑,顶端糜烂,有渗血,覆盖有血痂。纠正贫血后,行胃小弯侧部分切除术,肿物位于小弯侧胃体后壁,呈外生型。
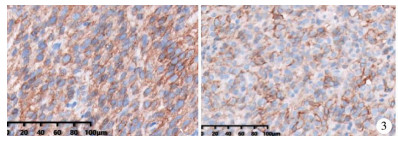
结 果 一、病理检查结果3例患儿均通过病理检查明确诊断为胃肠道间质瘤。病例1:病理检查见梭形及上皮型细胞,核分裂像34~40个/50高倍视野(high power field, HPF),没有坏死灶,高度危险性;免疫组织化学提示CD117、Dog-1(图 3)和SDHB强阳性,Actin、Desmin和S-100阴性。DNA分析未见KIT基因(外显子9, 11, 13, 17)及PDGFRA基因(外显子12, 18)变异。
|
Download:
|
| 图 3 胃肠道间质瘤患儿(病例1)肿瘤细胞免疫组化图(×400) CD117阳性(左)及Dog-1阳性(右) Fig. 3 CD117 (left) and Dog-1 (right) were positive for immunohistochemical staining in Case No.1 | |
病例2:病理检查提示肿瘤细胞呈圆形或短梭形,核分裂像>10个/50HPF。免疫组织化学提示CD117、CD34、Actin强阳性,SDHB、Desmin及S-100阴性。DNA分析未见KIT基因及PDGFRA基因变异。
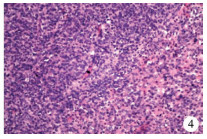
病例3:病理检查见肿瘤细胞位于胃肌层间,圆形和卵圆形细胞,核分裂像12个/50 HPF(图 4),高度危险性;免疫组织化学提示CD117、Dog-1和CD34强阳性,Actin、Desmin和S-100阴性。
|
Download:
|
| 图 4 胃肠道间质瘤患儿(病例3)病理图 肿瘤细胞呈圆形或卵圆形,核分裂像大于12个/50 HPF(HE染色,× 20) Fig. 4 Pathological morphology was observed in Case No.3 | |
3例患儿,分别随访16个月、10个月及48个月,随访方式包括门诊就诊、电话随访,目前生存状态良好,均无复发。
讨 论 一、儿童GIST的流行病学特征GIST起源于胃肠道的肌间神经节细胞(Cajal的间质细胞),多发于成人。儿童GIST临床极为罕见,仅占间质瘤患者的1.4%,好发于10~18岁,中位年龄为13岁,临床症状持续时间为几个小时至2年不等[1, 3];约20% ~29%患儿在确诊时存在转移,临床多以女孩多见。虽然有研究表明儿童GIST与成人患者的生存率无统计学差异,但儿童GIST具有不同的分子遗传学、形态学差异,以及不同的肿瘤生物学特性[4, 5]。
二、儿童GIST的临床特点及表现胃是儿童GIST最易发生的部位,约占50% ~60%,也可发生在食道、小肠或结肠,胃肠外发病部位包括网膜、肠系膜、腹膜和腹膜后,最易转移的部位是肝脏[1, 6, 7]。本研究中3例患儿中2例为女性,胃是病变部位,且均发生于胃小弯侧,其中1例转移至胃胰间隙胰颈部,符合该病的临床特征,但3例未见明确肝脏转移,需密切随访观察。儿童GIST早期进展缓慢,其临床表现多缺乏特异性,如腹胀、腹痛、呕吐、肠梗阻等,最常见的表现为贫血和消化道出血症状,但也有10% ~30%的患儿没有临床症状而延误诊断,与贫血相关的症状包括疲劳及活动后晕厥等[1]。因此,对于10~18岁儿童不明原因的贫血和消化道出血,需警惕GIST的存在。腹痛通常伴有腹部肿块或肠梗阻,较少出现的临床症状是发烧和体重减轻[2]。
三、儿童GIST的诊断与鉴别诊断辅助检查方面,早期的直肠指检及粪便常规检查具有重要的诊断或鉴别诊断意义。儿童GIST缺乏特异的肿瘤标记物,本组3例患儿仅1例患儿血清铁蛋白异常。腹部CT或MR(magnetic resonance, MR)检查可提供原发肿瘤范围、位置以及转移灶的相关信息;胃镜可提示病变部位、大小,如果病变外黏膜下方肿胀,提示病变处黏膜溃疡或出血。超声内镜检查可以进一步提高了后期手术的准确性,更好地确定病灶相邻结构,包括区域淋巴结转移或胃周肿瘤部位的位置、大小及范围。但最终确诊需通过组织活检和组织病理学检查。在组织学分析上,间质瘤可表现出3种形态类型,即梭形细胞、上皮样细胞和混合细胞,而儿童间质瘤主要是上皮样和混合型[8]。免疫组织化学95%的病例中CD117呈阳性表达,70%的病例中CD34呈阳性表达[9]。本组3例患儿均符合上述特征。
缺乏KIT基因或血小板衍生生长因子受体α(platelet-derived growth factor receptor alpha, PDGFRA)基因变异的GIST,被定义为野生型间质瘤,而儿童GIST的85%为野生型,且女童多见[5, 10, 11]。另一方面,儿童GIST不仅可以独自发生,亦可出现于一些综合征中,如卡尼三联征(Carney triad)或Carney-Stratakis综合征(Carney-Stratakis syndrome, CSS)[11]。卡尼三联征是一种与GIST、肺软骨瘤和副神经节瘤相关的非遗传性综合征;Carney-Stratakis综合征是一种常染色体显性遗传综合征,患儿可患有副神经节瘤和GIST。二者有共同的组织学特征,间质瘤主要发生在胃部,呈多灶性,且有广泛的淋巴结转移[11]。从分子水平上来看,这些综合征出现GIST,是因为琥珀酸脱氢酶(succinatedehydrogenase, SDH)复合物的缺陷所致[12]。这些研究有望为儿童GIST药物的研究提供了新的治疗策略。本组3例患儿均无上述综合征,临床工作中需注意鉴别。
四、儿童GIST的的治疗目前儿童GIST尚缺乏公认的治疗指南。患儿可表现为重度或极重度贫血,首先需纠正贫血,以维持生命体征稳定。手术治疗有助于解除消化道出血症状,且对病理诊断具有重要作用,因此手术仍然被认为是首选治疗[7]。然而,诸多研究表明:广泛胃切除及淋巴结清扫与生率存之间没有直接关联[5]。全胃切除术会影响患儿术后的生活质量,主张胃部分切除术或楔形切除术。因此,只要手术指征明确,即建议行限期手术治疗。国外虽有通过腹腔镜微创治疗小儿胃肠道间质瘤的报道,但具体手术方式的选择需外科医生根据患儿实际情况来决定[1]。小弯侧部分胃切除术可能会切断迷走神经,而引起胃排空障碍或延迟,必要时需行幽门成形术。本组3例均接受胃部分切除术或转移瘤切除术,肿瘤且均位于胃小弯侧,但3例术后均未出现胃排空延迟或障碍,这说明幽门成形术并非必然。
尽管手术是治疗中最重要的方面,对儿童GIST,尚需肿瘤科医生、病理科医生及外科医生进行多学科讨论,以制定综合治疗方案。对于KIT基因或PDGFRA基因变异的患儿,酪氨酸激酶抑制剂(如伊马替尼)具有抑制肿瘤生长、减少复发的作用;对于缺乏基因突变的儿童GIST,有报道发现伊马替尼不太敏感,但第二代激酶抑制剂(如舒尼替尼等)可以提供更大的帮助[13, 14]。因此,对儿童GIST,需对其KIT基因和PDGFRA基因突变进行评估,有助于确定靶向治疗的效果。术后内镜、放射学监测, 可以了解治疗后的反应,及有无复发。本研究中,患儿无KIT和PDGFRA基因突变,考虑到高度危险级别,综合考虑后仍予酪氨酸激酶抑制剂治疗。
综上所述,儿童贫血及胃肠道出血需警惕GIST的存在,诊断以胃镜及腹部CT检查为首选,确诊仍需病理诊断,治疗需综合考虑,以制定个体化的治疗方案,并需进行长期随访。
| 1 |
Cianci P, Luini C, Marinoni M, et al. Pediatric GIST presenting as anemia[J]. Pediatr Hematol Oncol, 2017, 34(5): 343-347. DOI:10.1080/08880018.2017.1396387. |
| 2 |
Tran S, Dingeldein M, Mengshol SC, et al. Incidental GIST after appendectomy in a pediatric patient:a first instance and review of pediatric patients with CD117 confirmed GISTs[J]. Pediatric Surg Int, 2014, 30(4): 457-466. DOI:10.1007/s00383-013-3432-3. |
| 3 |
Kurucu N, Sari N, Celasun B, et al. Gastrointestinal stromal tumor in a newborn diagnosed in prenatal period:a case report and review of literature[J]. J Pediatr Hematol Oncol, 2014, 36(8): 649-652. DOI:10.1097/MPH.0b013e3182a8f73f. |
| 4 |
Bhatt NR, Collins D, Crotty P, et al. Prognosis and management of adult wild type gastrointestinal stromal tumours (GISTs):A pooled analysis and review of literature[J]. Surg Oncol, 2016, 25(3): 152-157. DOI:10.1016/j.suronc.2016.05.003. |
| 5 |
Weldon CB, Madenci AL, Boikos SA, et al. Surgical management of wild-type gastrointestinal stromal tumors:a report from the National Institutes of Health Pediatric and Wildtype GIST Clinic[J]. J Clin Oncol, 2017, 35(5): 523-528. DOI:10.1200/JCO.2016.68.6733. |
| 6 |
Lima M, Gargano T, Ruggeri G, et al. Laparoscopic resection of a rare gastrointestinal stromal tumor in children[J]. Springerplus, 2015, 4: 73. DOI:10.1186/s40064-015-0850-9. |
| 7 |
Mullassery D, Weldon CB. Pediatric/"Wildtype" gastrointestinal stromal tumors[J]. Semin Pediatr Surg, 2016, 25(5): 305-310. DOI:10.1053/j.sempedsurg.2016.09.004. |
| 8 |
Nannini M, Astolfi A, Urbini M, et al. Integrated genomic study of quadruple-WT GIST (KIT/PDGFRA/SDH/RAS pathway wild-type GIST)[J]. BMC Cancer, 2014, 14: 685. DOI:10.1186/1471-2407-14-685. |
| 9 |
Corless CL, Fletcher JA, Heinrich MC. Biology of gastrointestinal stromal tumors[J]. J Clin Oncol, 2004, 22(18): 3813-3825. DOI:10.1200/JCO.2004.05.140. |
| 10 |
Kalfusova A, Kodet R. Molecular mechanisms of primary and secondary resistance, molecular-genetic features and characteristics of KIT/PDGFRA non-mutated GISTs[J]. Cesk Patol, 2017, 53(4): 167-173. |
| 11 |
Boikos SA, Stratakis CA. The genetic landscape of gastrointestinal stromal tumor lacking KIT and PDGFRA mutations[J]. Endocrine, 2014, 47(2): 401-408. DOI:10.1007/s12020-014-0346-3. |
| 12 |
Killian JK, Miettinen M, Walker RL, et al. Recurrent epimutation of SDHC in gastrointestinal stromal tumors[J]. Sci Transl Med, 2014, 6(268): 268ra177. DOI:10.1126/scitranslmed.3009961. |
| 13 |
Agaram NP, Laquaglia MP, Ustun B, et al. Molecular characterization of pediatric gastrointestinal stromal tumors[J]. Clin Cancer Res, 2008, 14(10): 3204-3215. DOI:10.1158/1078-0432.CCR-07-1984. |
| 14 |
Janeway KA, Albritton KH, Van Den Abbeele AD, et al. Sunitinib treatment in pediatric patients with advanced GIST following failure of imatinib[J]. Pediatr Blood Cancer, 2009, 52(7): 767-771. DOI:10.1002/pbc.21909. |
 2019, Vol. 18
2019, Vol. 18


