2. 连云港市第一人民医院小儿外科(江苏省连云港市, 222000);
3. 成都市妇女儿童中心医院(四川省成都市, 610031)
2. Department of Pediatric Surgery, First Municipal People's Hospital, Lianyungang 222000, China;
3. Municipal Central Women & Children's Hospital, Chengdu 610031, China
血管瘤是以血管瘤内皮细胞异常增殖和大量血管增生为主要病理学特征的婴幼儿常见良性肿瘤。近年来,有研究发现β受体阻断剂普萘洛尔可有效治疗婴幼儿血管瘤。有研究认为血管瘤的发病机制与细胞凋亡有关[1]。其中,NF-κBp65、抑制因子IκB-α和抗凋亡因子Bcl-2在婴幼儿血管瘤治疗机制中发挥了重要作用[2, 3]。本研究通过检测普萘洛尔干预裸鼠血管瘤模型过程中核转录因子NF-κBp65、抑制因子IκB-α和抗凋亡因子Bcl-2的表达情况,探讨NF-κB等抗细胞凋亡因子在普萘洛尔治疗婴幼儿血管瘤中的作用。
材料与方法 一、实验材料雌性裸鼠50只,鼠龄18~21 d,平均19 d,体重16~20 g,平均为18 g,所有裸鼠均由中科院北京实验动物中心提供,许可证号是SCXK(京)2009 - 0007;在SPF级的恒温层流室内分笼培养。
血管瘤组织标本来源于一名4月龄女性患儿,实验设计经医院科学实验伦理委员会审核通过。
兔抗人NF-κBp65、IκB-α、Bcl-2多克隆抗体由北京博奥森生物技术有限公司提供;EnVision试剂盒由上海Dako公司提供;盐酸普萘洛尔片购自云鹏制药;NF-κBp65引物由北京泰吉兴科生物科技有限公司合成。
二、实验方法在无菌条件下手术切除血管瘤组织,少部分瘤体组织送病理检查,按Mulliken分类标准证实为增殖期婴幼儿型毛细血管瘤。其他大部分瘤体组织用生理盐水洗净血液,冲洗3次后立即置于4℃的无菌湿盒中,转运至实验室进行移植。血管瘤组织块移植到裸鼠皮下,建立婴幼儿血管瘤的裸鼠异种移植动物模型,实验裸鼠继续按原条件饲养。
移植瘤体后密切观察裸鼠及肿瘤生长情况,隔日观察1次;在移植后的第45天,筛选出两处移植瘤体均存活的50只实验裸鼠,随机分为普萘洛尔干预组(n=25)和生理盐水对照组(n=25)。普萘洛尔干预组裸鼠予以普萘洛尔溶液经口灌胃,灌入约0.5 mL,灌药量按0.1~0.2 mL/10 g,隔日1次。普萘洛尔溶液浓度为0.25 mg/mL,在无菌条件下制备;药物干预剂量按常用实验动物及人体表面积比例对照表进行剂量换算。生理盐水对照组裸鼠予以生理盐水0.5 mL灌胃,隔日1次;继续原条件饲养裸鼠。
在分组当日药物干预前及药物干预后的第7天、第14天、第21天、第28天,用颈椎脱臼法将每组裸鼠各随机处死5只,切取移植的血管瘤组织,用游标卡尺测量两组移植瘤的最大直径a和横径b,根据公式V=π/6×a×b2,估算移植瘤的体积,并观察瘤体颜色及质地变化。部分组织经4%多聚甲醛固定24 h,常规石蜡包埋,制成5 μm厚切片,行HE染色,在光学显微镜下观察移植瘤的组织形态特点;同时行NF-κBp65、IκB-α、Bcl-2免疫组化染色检测。另取部分组织行半定量RT-PCR检测NF-κBp65 mRNA的表达情况。
三、实验内容1. 检测瘤体体积和形态学改变;
2. NF-κBp65、IκB-α、Bcl-2免疫组化染色检测:每张切片在光镜下观察免疫组化染色结果,在400倍镜下随机选取10个视野,使用Image-Pro Plus 6.0软件分析图片,计算平均光密度值(mean density,MD=IOD SUM/area),来反映阳性颗粒表达强度。
3. NF-κBp65 mRNA的表达情况:行NF-κBp65 mRNA的RT-PCR产物电泳测定,运用Quantity One 4.52软件采用泳道/条带轨迹定量法进行半定量分析。
四、统计学处理实验数据采用SPSS17.0统计软件进行统计学处理,计量资料采用均数±标准差(x±s)表示,组间比较采用独立样本t检验。对NF-κBp65与Bcl-2表达的相关性分析采用Pearson线性相关分析。以P<0.05为差异有统计学意义。
结 果 一、移植瘤体积和形态学改变在实验过程中,无实验裸鼠意外死亡。在干预前,两组瘤体体积无明显差异(P>0.05)。在干预后第7天,普萘洛尔干预组中的瘤体体积与生理盐水对照组相比,差异有统计学意义(P<0.05),说明瘤体体积有缩小,并在干预后第14天、第21天、第28天时体积进一步缩小;同时与组内干预前相比较,瘤体体积也缩小了(P<0.05)。而生理盐水对照组瘤体体积在干预后第7天、第14天继续增大,而在干预第21天、第28天缩小。普萘洛尔干预组瘤体组织颜色苍白、弹性差,并附着脂肪组织;而生理盐水对照组移植瘤体组织在第7天、第14天颜色红润,血供良好,较有弹性,而第21天、第28天瘤体血供变差,颜色变淡,质地偏硬。
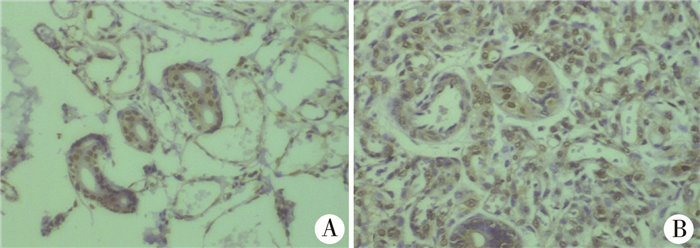
二、NF-κBp65、IκB-α、Bcl-2免疫组化染色检测结果干预前两组间NF-κBp65平均光密度值分别为0.12± 0.07和0.11± 0.03,差异无统计学意义(P>0.05)。在干预后各时间点(除干预后第7天),普萘洛尔干预组NF-κBp65的平均光密度值均低于生理盐水对照组组(P<0.05),见表 1、图 1。NF-κBp65的表达随干预时间表现为逐渐降低;而生理盐水对照组则表现为先升后降,在干预后第14天时为高峰状态。
|
|
表 1 移植瘤组织NF-κBp65表达情况 Table 1 Expression status of NF-κBp65MD in transplanted tumor tissues |
|
Download:
|
| 图 1 NF-κBp65免疫组化染色情况(×400) A:普萘洛尔干预组第14天时NF-κBp65的表达情况;B:生理盐水对照组瘤体中NF-κBp65的表达 Fig. 1 Immunohistochemical staining with NF-κBp65 (×400) | |
干预前两组间IκB-α平均光密度值无明显差异(P>0.05)。在干预后各时间点,IκB-α的表达普萘洛尔干预组明显高于生理盐水对照组(P<0.05),而在生理盐水对照组中IκB-α的平均光密度表现为在干预后第7天、第14天时较组内干预前下降,然后在干预第21天、第28天表达逐渐升高(表 2)。
|
|
表 2 移植瘤组织IκB-α表达情况(x±s) Table 2 Expression status of IκB-αMD in transplanted tumor tissue (x±s) |
干预前两组间Bcl-2平均光密度值无明显差异(P>0.05)。在干预后各时间点上,普萘洛尔干预组Bcl-2平均光密度值明显低于生理盐水对照组(P<0.05),随干预时间而表现为持续降低;而生理盐水对照组的表达呈先升后降的趋势(表 3)。
|
|
表 3 移植瘤组织Bcl-2表达情况(x±s) Table 3 Expression status of Bcl-2MD in transplanted tumor tissue(x±s) |
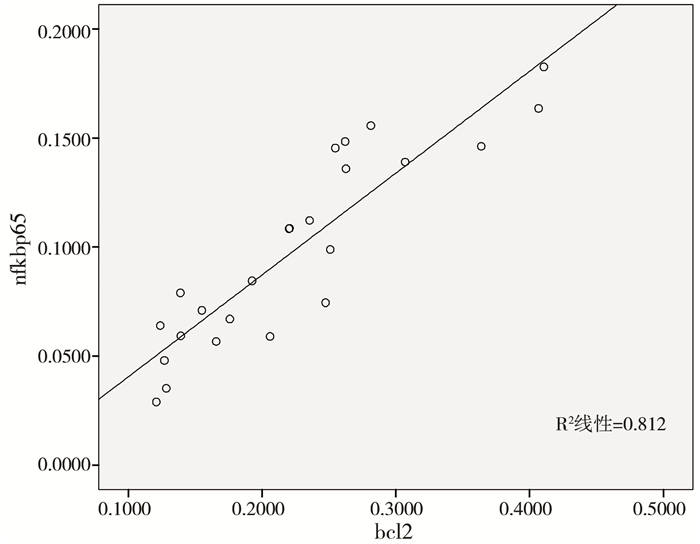
对普萘洛尔干预组中NF-κBp65与Bcl-2的表达呈正相关(r=0.901, P<0.01), 见图 2。
|
Download:
|
| 图 2 NF-κBp65与Bcl-2表达的散点图 Fig. 2 Linear correlation analysis of scatter diagram for the expressions of nf-kappa65 and bcl-2 | |
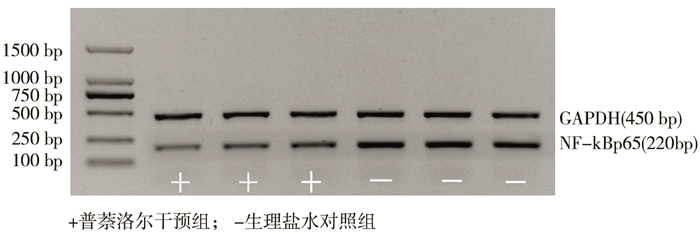
220 bp处条带为NF-κBp65 mRNA的扩增产物,450 bp处条带为内参基因GAPDH的扩增产物,以亮度强弱判定产物量(图 3)。如表 4所示,干预前两组间NF-κBp65 mRNA相对表达量无差异(P>0.05)。在各个干预时间段内,普萘洛尔干预组NF-κBp65 mRNA的相对表达低于生理盐水对照组,差异有统计学意义(P<0.05)。普萘洛尔干预组NF-κBp65 mRNA的表达持续下降而生理盐水对照组则表现为先升后降的趋势。
|
Download:
|
| 图 3 NF-κBp65 mRNA的基因及内参基因在干预后2周的电泳图 Fig. 3 Electrophoretic map of nf-kappa65 mRNA and reference genes at 2 weeks post-intervention | |
|
|
表 4 NF-κBp65 mRNA在干预后各时间段内表达情况(x±s) Table 4 Expressions of nf-kappa65 mRNA at different timepoints after intervention(x±s) |
目前普萘洛尔已成为治疗血管瘤的一线用药。但其对血管瘤的治疗机制仍不完全明确。研究表明, 普萘洛尔在早期可激活一氧化氮,从而使瘤内平滑肌收缩,使之色泽变淡,瘤体缩小;在中后期可降低血管瘤内皮生长因子(endothelial growth factor,VEGF)等细胞因子的表达,使其增殖能力减弱[4]。普萘洛尔除了降低相关细胞因子表达外,也可通过抑制基质金属蛋白酶(matrix metalloproteimse,MMP)如MMP-2、MMP-9等的表达,直接作用于血管瘤内皮细胞壁,促使瘤体消退[5]。此外,有文献还表明,caspase级联激发可以引发血管瘤细胞凋亡[6]。
NF-κBp65蛋白对血管内皮生长因子有正向调节作用,可促进肿瘤细胞的血管增殖。应用NF-κB的抑制剂IκB可以阻断血管平滑肌细胞基质金属蛋白酶的产生与激活,进而阻止动脉瘤发展[7]。通过比较皮肤血管瘤不同时期NF-κBp65的表达,证明增生期血管瘤组织中NF-κBp65表达水平明显高于退化期[8]。
本研究表明,NF-κBp65在普萘洛尔干预后的瘤体中表达明显低于生理盐水对照组,而IκB-α的表达则高于生理盐水对照组;生理盐水对照组中的NF-κBp65表达呈现为先升后降,而IκB-α表现为先降后升;同时研究发现两项指标都在干预后第14天,即瘤体体积差异最大时,表达差异最大。这提示在普萘洛尔对裸鼠模型中的血管瘤干预过程中,IκB-α作为NF-κB的重要抑制因子,被广泛激活,而进一步抑制NF-κBp65的活性,减少细胞中增殖相关因子的转录和表达,使细胞增殖活力降低,进而降低肿瘤细胞的抗凋亡能力,从而使得瘤体消退。当然,二者的关系尚需进一步研究。NF-κB在肿瘤中起到重要逃逸凋亡作用,而Bcl-2是重要的抗凋亡基因,二者是否存在联系,是否相互作用,是否在肿瘤抗凋亡作用上相互影响,目前有待进一步研究。Bravo等[9]在研究人类慢性粒细胞白血病U937细胞时,发现化疗药物在降低NF-κBp65磷酸化的同时降低了Bcl-2的表达,该研究还指出Bcl-2基因启动子具有NF-κB的结合位点,NF-κB可能参与Bcl-2的调控。唐小云等[10]在研究裸鼠脾细胞凋亡过程中发现细胞凋亡率升高可能是通过降低NF-κBp65与Bcl-2来实现的。本实验通过普萘洛尔干预血管瘤裸鼠模型,对瘤体组织NF-κBp65与Bcl-2的平均光密度值进行相关性分析,发现两者存在正相关,这提示在普萘洛尔干预后,婴幼儿血管瘤裸鼠模型中的瘤体消退过程中,NF-κBp65和Bcl-2都发生了改变,瘤体细胞抗凋亡能力下降,增殖能力减弱,从而使得瘤体消退。
综上所述,普萘洛尔可使裸鼠模型血管瘤组织IκB-α表达升高,NF-κBp65和Bcl-2表达降低。普萘洛尔促进裸鼠模型中血管瘤消退的作用机制,可能与其降低NF-κB表达,从而促进血管瘤内皮细胞凋亡有关。
| 1 |
Yao TH, Pataer P, Regmi KP, et al. Propranolol induces hemangioma endothelialcell apoptosis via a p53BAX mediated pathway[J]. Mol Med Rep, 2018, 18(1): 684-694. |
| 2 |
Aoki T, Nishimura M, Matsuoka T, et al. PGE(2)-EP(2)signalling in endothelium is activated by haemodynamic stress and induces cerebral aneurysm through an amplifying loop via NF-kappa B[J]. Br J Pharmacol, 2011, 163(6): 1237-1249. DOI:10.1111/j.1476-5381.2011.01358.x. |
| 3 |
俞松, 刘文英, 胡月光, 等. Fas、bcl-2与移植血管瘤自然退化的动态研究[J]. 中华小儿外科杂志, 2007, 28(3): 149-151. DOI:10.3760/cma.j.issn.0253-3006.2007.03.011. Yu S, Liu WY, Hu YG, et al. Apoptosis and the expressions of Fas and bcl-2 in xenografted human hemangioma[J]. Chin J Pediatr Surg, 2007, 28(3): 149-151. DOI:10.3760/cma.j.issn.0253-3006.2007.03.011. |
| 4 |
Lin ZY, Wang LH, Huang G, et al. Propranolol inhibits the activity of PI3K, AKT, and HIF-1 alpha in infantile hemangiomas[J]. Pediatr Surg Int, 2018, 34(11): 1233-1238. DOI:10.1007/s00383-018-4347-9. |
| 5 |
Wnek A, Andrzejewska E, Kobos J, et al. Molecular and immunohistochemical expression of apoptotic proteins Bax, Bcl-2 and Caspase 3 in infantile hemangioma tissues as an effect of propranolol treatment[J]. Immunol Lett, 2017, 185(7): 27-31. |
| 6 |
Xu W, Li S, Yu F, et al. Role of thrombospondin-1 and nuclear factor-kappa B signaling pathways in anti-angiogenesis of infantile hemangioma[J]. Plast Reconstr Surg, 2018, 142(3): 310-321. DOI:10.1097/PRS.0000000000004684. |
| 7 |
Aoki T, Nishimura M, Matsuoka T, et al. PGE(2)-EP2 signalling in endothelium is activated by haemodynamic stress and induces cerebral aneurysm through an amplifying loop via NF-kappa B[J]. Br J Pharmacol, 2011, 163(6): 1237-1249. |
| 8 |
张永婷, 徐伟立, 李索林, 等. TSP-1与NF-κB通路蛋白在婴幼儿毛细血管瘤中的表达[J]. 中华整形外科杂志, 2016, 32(6): 441-446. DOI:10.3760/cma.j.issn.1009-4598.2016.06.011. Zhang YT, Xu WL, Li SL, et al. Expression and significance of the proteins in TSP-1 and NF-κB signal pathways of infantile capillary hemangioma[J]. Chin J Plast Surg, 2016, 32(6): 416-441. DOI:10.3760/cma.j.issn.1009-4598.2016.06.011. |
| 9 |
Bravo-Cuellar A, Hernández-Flores G, Lerma-Díaz JM, et al. Pentoxifylline and the proteasome inhibitor MG132 induce apoptosis in human le-ukemia U937 cells through a decrease in the expression of Bcl-2 and Bcl-XL and phosphorylation of p65[J]. Biomed Sci, 2013, 28(20): 13-18. |
| 10 |
唐小云, 李霞, 宋宝辉, 等. 小柴胡汤对免疫抑制小鼠脾细胞凋亡的影响及其机制[J]. 国际免疫学杂志, 2010, 33(3): 242-244. DOI:10.3760/cma.j.issn.1673-4394.2010.03.020.10. Tang XY, Li X, Song BH, et al. Influence of bupleuri decoction on the apoptosis of splenic cells of immunosuppressed mice and its mechanism[J]. Int J Immunol, 2010, 33(3): 242-244. DOI:10.3760/cma.j.issn.1673-4394.2010.03.020.10. |
 2019, Vol. 18
2019, Vol. 18


