患儿,男,2岁。因发现右侧阴囊空虚2年于2017年2月6日收入昆明市儿童医院。生长发育状况和心肺功能均未见异常,腹软,无压痛、反跳痛,腹部未触及异常包块,左侧阴囊内睾丸触诊正常,右侧阴囊空虚且腹股沟区未触及睾丸(图 1)。患儿母亲孕期产检结果无异常,既往体健,无手术外伤史。实验室检查:甲胎蛋白101 ng/mL;癌胚抗原4.83 ng/mL;总睾酮5.26 nmol/L;β-HCG 0.232 mLU/mL。影像学检查:B超结果提示膀胱右后上方可见一不规则形包块,大小约6.9 cm×6.0 cm×4.5 cm,边界清,内部呈低回声,无回声混杂,无回声区可见分隔。增强核磁共振检查结果提示腹腔内膀胱右后方见一类圆形混杂信号灶,大小约6.7 cm×5.8 cm,T1W稍高且低信号,T2W稍低且高信号,增强扫描轻度不均匀强化(图 2、图 3)。患儿入院后积极完善相关检查,无绝对手术禁忌证,做好术前准备后行膀胱后包块探查术。术中可见右侧膀胱后包块与右侧精索相连,大小约6 cm×6 cm×5 cm,囊实性,考虑为右侧腹腔型隐睾肿瘤(图 4、图 5)。探查肿瘤无破损,精索及腹腔内各处无转移,术中冰冻病理检查结果提示成熟性畸胎瘤,遂高位结扎精索、完整切除肿瘤组织后送检。术后病理检查发现肿瘤内含大量神经胶质成分(约80%),其中可见大量砂粒体和钙化灶伴灶性出血,另见少量脉络膜上皮、软骨、骨、脂肪、皮肤及附属器及被覆消化道或呼吸道上皮的囊腔,未见原始神经管样结构,送检精索组织无转移(图 6~图 8)。术后诊断:右侧腹腔型隐睾、右侧睾丸成熟性囊实性畸胎瘤(主要成分为神经胶质)。术后恢复顺利,随访1年6个月,一般情况良好,复查甲胎蛋白、癌胚抗原水平均正常,复查核磁共振未见肿瘤复发及转移。

|
Download:
|
| 图 1 右侧阴囊空虚 Fig. 1 Right scrotum was empty | |

|
Download:
|
| 图 2 增强MRI(增强后可见密度不均匀腹腔内膀胱右后方包块) Fig. 2 Enhanced MRI | |
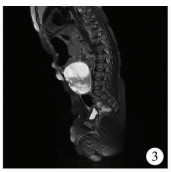
|
Download:
|
| 图 3 增强MRI(增强后可见密度不均匀腹腔内膀胱右后方包块) Fig. 3 Enhanced MRI | |

|
Download:
|
| 图 4 隐睾肿瘤(术中见膀胱右后方与精索相连的囊实性包块) Fig. 4 Testicular tumor | |
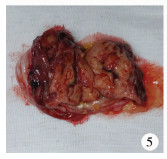
|
Download:
|
| 图 5 隐睾肿瘤(术中成功完整切除包块,切面观) Fig. 5 Testicular tumor | |
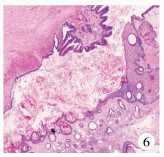
|
Download:
|
| 图 6 鳞状上皮和消化道上皮 Fig. 6 Squamous and alimentary epithelium | |
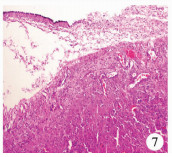
|
Download:
|
| 图 7 柱状上皮和神经胶质成分 Fig. 7 Columnar epithelium and glia | |
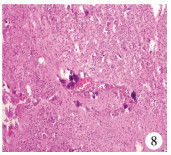
|
Download:
|
| 图 8 神经胶质成分伴大量砂粒体和钙化灶 Fig. 8 Glia with sand bodies and calcification foci | |
隐睾是男性儿童常见的先天性疾病,腹腔型隐睾作为其中一种类型并不少见。儿童原发性睾丸肿瘤是小儿先天性肿瘤之一,发病率约0.5/10万~2.0/10万,约占小儿实体肿瘤发病总数的2%,以生殖细胞肿瘤为主,其中卵黄囊瘤最为多见,其次为畸胎瘤,精原细胞瘤及混合细胞瘤较少见[1, 2]。本例睾丸肿瘤即为畸胎瘤中的成熟性畸胎瘤,但以神经胶质为主要成分,且合并同侧腹腔型隐睾,临床上较为罕见[3]。
隐睾肿瘤的病因尚不明确,目前认为与腹腔内温度相对较高、血流供应不畅、内分泌失调及性腺发育不全等因素有关。儿童腹腔型隐睾肿瘤多以阴囊空虚就诊,易诊断为隐睾;患儿母亲孕期产检可无异常发现、患儿常无手术及外伤病史,偶有因肿瘤增大发现腹部包块或腹腔内隐睾扭转腹痛而就诊的情况[4]。体检结果提示腹股沟区及阴囊空虚,常规B超检查腹股沟区及阴囊内未探及睾丸,需进一步完善MRI及甲胎蛋白、癌胚抗原、人绒毛膜促性腺激素等检查,确诊则依赖于术中病理检查。此外,儿童腹腔内隐睾肿瘤需与腹腔内隐睾相鉴别,临床工作中遇到腹股沟及阴囊均未探及睾丸的情况需考虑隐睾肿瘤的可能,建议术前完善MRI检查,并根据术中具体情况决定是否需行术中冰冻健康病理检查。儿童腹腔内隐睾肿瘤治疗以手术切除为主,但需根据术中冰冻切片决定是否保留睾丸及手术切除范围,本病例术中冰冻病理结果虽提示为成熟性畸胎瘤,但由于肿瘤组织充满睾丸,难以区分,故选择睾丸完全切除[5]。术后根据病检结果决定是否放化疗,且需长期随访进一步评估患儿预后[6]。
| 1 |
Karmazyn B, Weatherly DL, Lehnert SJ, et al. Characteristics of testicular tumors in prepubertal children(age 5-12 years)[J]. Journal of Pediatric Urology, 2018, 14(3): 259.e1-259.e6. DOI:10.1016/j.jpurol.2018.01.013. |
| 2 |
魏仪, 吴盛德, 林涛, 等. 64例儿童睾丸畸胎瘤病例分析[J]. 中华男科学杂志, 2015, 21(9): 809-815. DOI:10.13263/j.cnki.nja.2015.09.008. We iY, Wu SD, Lin T, et al. Case analysis of pediatric testicular tumors:a report of 64 cases[J]. Chinese Journal of Adrology, 2015, 21(9): 809-815. DOI:10.13263/j.cnki.nja.2015.09.008. |
| 3 |
Abu-Zaid A, Azzam A, Amin T. Mixed germ cell tumor complicating an intra-abdominal cryptorchidism[J]. Hematology/oncology & Stem Cell Therapy, 2013, 6(3-4): 122-3. DOI:10.1016/j.hemonc.2013.09.003. |
| 4 |
石秦林, 杨炼, 张德迎, 林涛. 小儿腹膜后成熟畸胎瘤伴睾丸成熟畸胎瘤1例[J]. 临床小儿外科杂志, 2018, 17(08): 639-640. DOI:10.3969/j.issn.1671-6353.2018.06.019. Shi QL, Yang L, Zhang DY, Lin T. Mature pediatric retroperitoneal teratoma with testicular tumor:one case report[J]. Journal of Clinical Pediatric Surgery, 2018, 17(08): 639-640. DOI:10.3969/j.issn.1671-6353.2018.06.019. |
| 5 |
Chen J, Fok KL, Chen H, et al. Cryptorchidism-induced CFTR down-regulation results in disruption of testicular tight junctions through up-regulation of NF-B/COX-2/PGE2[J]. Human Reproduction, 2012, 27(9): 2585. DOI:10.1093/humrep/des254. |
| 6 |
Rescorla FJ, Ross JH, Billmire DF, et al. Surveillance after initial surgery for Stage Ⅰ pediatric andadolescent boys with malignant testicular germ cell tumors:Report from the Children's Oncology Group[J]. Journal of Pediatric Surgery, 2015, 50(6): 1000-1003. DOI:10.1016/j.juro.2016.07.061. |
 2019, Vol. 18
2019, Vol. 18


