囊肿完全切除术和肝管空肠Roux-en-Y吻合术是目前治疗先天性胆总管囊肿的2种标准术式[1-3]。2002年李龙教授在国内首次报道应用腹腔镜技术治疗先天性胆总管囊肿的案例,并逐渐得到国内医者的广泛接受和应用[4]。随着产前超声筛查技术的普及和水平的不断提高,越来越多的胆总管囊肿可在产前被发现,其中以Ⅰa型多见。为避免梗阻性黄疸、胆管炎及囊肿穿孔等可预见的并发症发生,胆总管囊肿的手术干预时机较以往有所提前,但新生儿非常细小的肝管直径(2~3 mm)对吻合操作提出了更高的技术要求[5];另一部分Ⅳa型囊肿在肝门处不伴胆管扩张,进行肝外病变胆管切除后,胆管断端深陷于肝门内,肝内胆管直径通常不超过5 mm[6]。以上两种情况均可增加腹腔镜下吻合的难度及术后发生吻合口狭窄的风险。因此,本研究团队提出采用腹腔镜肝门扩大埋入空肠的吻合术,旨在解决以上难题,并采用动物模型进行验证,初步评估该术式的临床应用价值和中期随访结果。
材料与方法 一、实验动物巴马小型猪(共24只)购自江苏泰州生物科技有限公司,体重15~20 kg,雌雄不限,将其随机分为A、B两组,每组12只。分别构建两种手术模型,其中A组行胆总管套入式吻合,模拟肝门扩大置入空肠吻合术;B组行单纯胆总管空肠端侧吻合,模拟经典肝管空肠端端吻合术。动物实验方案通过华中科技大学同济医学院伦理委员会批准。
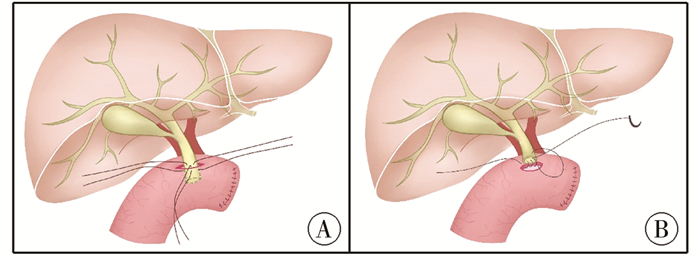
二、模型构建实验动物术前禁食24 h,采用3%戊巴比妥钠盐溶液按30 mg/kg剂量进行臀大肌肌肉注射麻醉,术中酌情追加麻醉剂量,每次5~10 mL,总量不超过60 mL。麻醉后取仰卧位,固定四肢,监测心率、动脉血压等生命体征。消毒,铺无菌巾。取右上腹横切口,进入腹腔,游离肝门并暴露胆总管。于胆总管远端结扎并离断,准备好空肠袢,从横结肠后方引向肝门。为对比两组吻合方式的疗效,A组将胆总管断端套入空肠内约1~2 cm,再用5 - 0可吸收线将胆总管外侧浆肌层与空肠壁全层做间断缝合(图 1A);B组将胆总管断端与空肠壁全层做间断对合缝合(图 1B)。于胆囊底部做一小切口,置入14号T型引流管并固定,确认腹腔无活动性出血后分层关闭腹腔,皮下再次加强固定引流管并夹闭,用于胆道造影检查。术后连续3 d肌肉注射头孢他啶预防感染。观测时间点分别为术后1周、术后1个月和术后3个月,静脉血通过静脉采集获得,采用相同的方式麻醉后进行胆道造影,并收集影像学资料。后经同一腹壁切口进入腹腔,仔细游离显露后切取整个吻合口标本,最后空气栓塞处死实验动物。
|
Download:
|
| 图 1 两种吻合方式示意图 A.胆总管套入式吻合;B.胆总管空肠端侧吻合 Fig. 1 Schematic diagram of two anastomotic methods A.common bile duct anastomosis; B.common bile duct end jejunostomy | |
测量并记录两组实验动物在吻合术时和术后3个不同时间点的体重、一般情况、吻合口内径及肝功能各项指标。对比分析两组实验动物的吻合口照片、胆管造影资料及吻合口横断面石蜡切片的HE染色和Masson染色照片。用RNA later处理后冻存于-80℃低温环境下用于荧光实时定量PCR检测,2^-ΔΔCt法分析术后不同时间点两组吻合口局部组织中TGF-β1和Ⅰ型胶原纤维(type Ⅰ collagen)的mRNA表达水平。引物序列见表 1。
|
|
表 1 荧光实时定量PCR引物序列 Table 1 Fluorescence real-time PCR primer sequences |
2012年1月到2018年1月,华中科技大学同济医学院附属协和医院小儿外科共收治47例胆总管囊肿(30例女性,17例男性)并接受腹腔镜肝门扩大埋入空肠吻合术的患儿。患儿年龄3周至15岁,其中1月龄以内的患儿19例,1至3月龄(不包括3月龄)10例,3至6月龄(不包括6月龄)5例,6月龄至1岁(不包括1岁)8例,1岁及以上5例。术前均经肝胆B超及肝胆MRI检查进行病情评估。胆总管囊肿类型为Ⅰa型37例(占78.7%),Ⅳa型10例(21.3%)。手术方法:气管插管,全麻,仰卧位;置尿管、胃管,消毒铺巾。采用经典四孔法,经脐放置5 mm或10 mm trocar并置入镜头,气腹压力6~10 mm Hg(1 mm Hg=0.133 kPa),流量2.5~4.5 L/min。右侧的两个操作trocar分别在腋前线肋下缘交界处和腹直肌外缘,左侧辅助trocar置于左侧腋前线肋缘下。肝外囊肿切除遵循本研究团队之前报道的方法[7]。关于肝门部胆管的处理:新生儿和小婴儿的肝总管直径在2~3 mm左右甚至更小,劈开左、右两侧肝管能将吻合直径扩大到4~6 mm;对于肝门胆管狭窄的Ⅳa型囊肿,在彻底切除肝外胆管后,移除胆栓并冲洗胆管,挖除位于肝门组织浅层的狭窄区,最终留下陷于肝门内的胆管断端,直径4~5 mm。将准备好的Roux空肠袢从横结肠后方牵引向肝门,切开肠壁,取肝门胆管断端周围的Glisson包膜与空肠壁的全层做连续缝合,从后壁到前壁依次吻合,直至肝门胆管被完全包裹在空肠腔内。在肝下放置引流管并固定,确认无明显出血后分层关闭腹腔。
五、统计学方法采用SPSS 23.0进行统计学分析。符合正态分布的计量资料采用(x±s)进行统计描述,两组间计量资料的对比采用独立样本t检验,不同时间点血清指标采用重复测量方差分析。P<0.05认为差异具有统计学意义。
结 果 一、动物实验24只实验动物吻合手术过程均顺利。术前A组和B组的胆总管直径分别为(5.91±0.78)mm和(5.87±1.09)mm。B组12只实验动物在接受单纯端侧吻合术后有5只出现吻合口狭窄相关症状,表现为皮肤及巩膜黄染、乏力、厌食和消瘦,其中症状较重的1只因急性梗阻性胆管炎在术后3周左右死亡,而接受套入式吻合的A组实验动物中无一例出现上述症状。A组实验动物肝功能指标均在正常范围内,B组有4只血清总胆红素、AST和ALT均明显增高(P<0.05),肝功能异常主要发生在术后1个月和术后3个月。两组肝功能指标对比结果见表 2。
|
|
表 2 两组实验动物术前及术后血清肝功能指标对比 Table 2 Comparison of preoperative and postoperative serum parameters of hepatic functions |
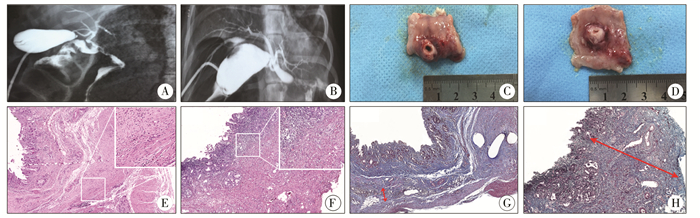
胆道造影检查及大体观均未见A组实验动物出现吻合口狭窄征象(图 2A和2C),B组中有4只出现吻合口狭窄,近端胆管显著扩张(图 2B),吻合口标本大体观也呈针尖样(图 2D)。术后1周,吻合口内径尚未表现出差异(P>0.05);术后1个月,A组和B组吻合口内径分别为(5.67±0.82)mm和(3.00±2.28)mm,差异有统计学意义(P<0.05);术后3个月,A组仍然表现为更宽的吻合口,内径为(5.58±0.49)mm,B组为(3.83±1.47)mm,差异有统计学意义(P<0.05)。根据HE染色结果,术后1周A组吻合口黏膜层愈合平滑,仅少量炎症细胞散在分布于吻合口外围(图 2E)。B组吻合口黏膜层粗糙,组织水肿,大量炎症细胞浸润于吻合口壁全层(图 2F)。术后3个月,吻合口瘢痕形成过程逐渐稳定,Masson染色显示A组吻合口瘢痕纤维较薄,整齐排列于外围(图 2G),而B组表现为全层可见的粗大瘢痕纤维,排列紊乱(图 2H)。
|
Download:
|
| 图 2 术后3个月吻合口大体观和组织学资料对比 A.胆管造影通畅;B.吻合口出现狭窄,箭头示近端胆管显著扩张;C.吻合口大体观未出现狭窄;D.吻合口出现针尖样狭窄;E.少量炎症细胞散在分布于吻合口外围;F.大量炎症细胞浸润于吻合口壁全层;G.吻合口纤维组织薄,整齐排列于外围;H.粗大紊乱的胶原纤维累及吻合口全层 Fig. 2 Comparison of gross aneurysm and histological data at 3 months after operation | |
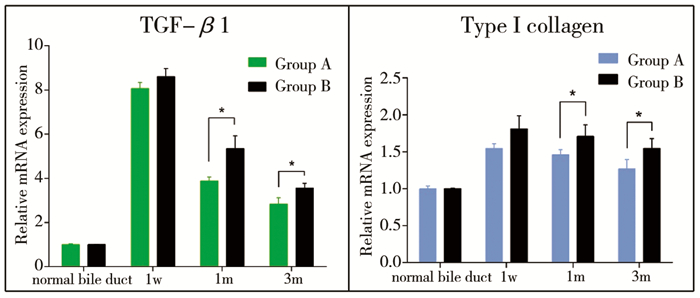
两组吻合口组织中TGF-β1和Ⅰ型胶原纤维的mRNA表达水平随时间变化趋势具有一定的相似性,均于术后1周左右上升到峰值,术后1个月和术后3个月与相邻的前一个时间组相比均呈现逐渐下降的趋势。但在术后1个月和术后3个月时,B组吻合口组织中TGF-β1和Ⅰ型胶原纤维水平较A组均明显增高,差异具有统计学意义(图 3)。
|
Download:
|
| 图 3 两组术后吻合口组织中TGF-β1和Ⅰ型胶原的mRNA表达水平对比 Fig. 3 Comparison of postoperative mRNA expression levels ofTGF-β1 and type Ⅰ collagen in anastomotic tissues of two groups | |
本中心47例胆总管囊肿患儿均顺利接受腹腔镜肝门扩大埋入空肠吻合术,无一例中转开放手术,手术时长(165±15)min,无明显术中出血,住院时间(9±2)d。随访时间为(31±18)个月,无一例出现胆管炎、胆管结石或吻合口狭窄等并发症。
讨 论腹腔镜下胆总管囊肿切除和肝管空肠吻合术由Farello等[8]在1995年提出,因该术式具有安全、有效、微创等优势而逐渐被广泛采用。但据文献报道,吻合口狭窄这一术后并发症在开放手术中发生率为6% ~40%[9-12],而在腔镜手术中为0.6% ~28.6%[1, 3, 13-16]。吻合口狭窄多发生于Ⅰa型和Ⅳa型囊肿[10, 14, 17, 18],同时也是患儿接受再次手术的最主要原因[19, 20]。Kim等[10]在2008年等报道了34例开腹肝管空肠吻合术患儿的治疗情况,发现8例出现吻合口狭窄,其中7例为Ⅳa型囊肿。2012年Jung等[14]报道了35例接受腹腔镜肝管空肠吻合术患儿的治疗情况,结果发现出现吻合口狭窄的10例患儿中有7例为Ⅰa型囊肿。本中心从2005年开始应用腹腔镜肝管空肠吻合术治疗胆总管囊肿[7],截至2016年1月,本中心共接诊了396例胆总管囊肿患儿并行腹腔镜下胆总管囊肿切除肝管空肠吻合术,初步统计发现吻合口狭窄发生率为3.8%,发生时间为术后(4.6±2.2)年。发生狭窄的15例患儿中包括Ⅰa型囊肿10例(含3例新生儿),Ⅰc型1例,Ⅳa型4例。
术后狭窄发生与否与吻合口直径大小存在重要关系。2015年Naoto Urushihara报道了4例因狭窄接受再次手术的患儿,吻合口直径均<5 mm[21]。近年,上海的一项单中心回顾性研究纳入了275例有效样本,共发现5例存在吻合口狭窄的病例,平均直径为(4.8±0.8)mm[20]。本研究中所用的实验动物胆总管直径基本在5~6 mm之间,这也与新生儿左、右肝管劈开后的口径大小相当。我们回顾了上文提到的本中心10例吻合口狭窄的Ⅰa型囊肿初次手术资料,平均肝管直径为(4.1±0.9)mm。关于理想的胆肠吻合直径目前虽然没有定论,但根据上面列举的相关数据,我们推测能够保证胆流通畅的吻合口直径至少不会<5 mm。
国内外关于预防胆肠吻合术后狭窄的方案并不少,包括肝管成型后肝管空肠吻合术[22-24]、改良Kasai术及局部肝切除肝管空肠吻合术[17, 25, 26],随访资料提示肝管成型术可有效降低吻合口狭窄的发生风险[27],但在某些临床案例中操作仍然十分困难。一些新生儿Ⅰa型囊肿在切除后,肝总管直径仅为3 mm甚至更小,即使劈开左、右肝管也只能将吻合直径扩大至5~6 mm[6]。于是部分医者选择保留小部分“喇叭口”,以获得8~10 mm的吻合直径。但是,残留的病变肝外胆管会增加远期癌变的发生风险[28-31]。Ohashi[32]曾报道过术后15年发生残留囊肿壁恶变的病例。Sastry[33]也提到,胆总管囊肿在18岁前恶变率低(仅0.4%左右),但成年后,恶变率可达11.7%,最高甚至可达38%。Ten Hove[34]在一项基于2 904例样本的meta分析中发现,平均随访36年后99%的恶变病例都发生于残留囊壁的Ⅰ型和Ⅳ型囊肿(位于吻合口的胆管壁)中。因此,彻底切除扩张的胆管壁十分重要。而另一部分伴有肝门胆管狭窄的Ⅳa型囊肿在切除肝外病变部位的胆管后,胆管断端深陷在肝门内,肝管空肠吻合操作难度大。我们意识到,解决吻合口狭窄问题的关键在于彻底切除囊肿壁和改变吻合方式。
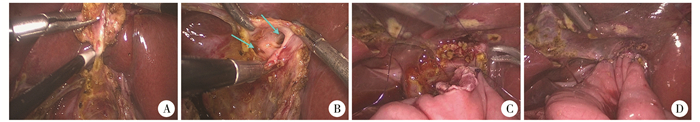
受Morotomi提出的Kasai术式[25]启发,我们总结出一套综合性手术方案(即腹腔镜肝门扩大埋入空肠吻合术),该术式的操作过程包括3个要点:①彻底切除扩张的胆管壁(图 4A);②纵行劈开左、右肝管,扩大肝门胆管直径(图 4B);③取肝门胆管断端周围的Glisson包膜与空肠壁全层进行吻合(图 4C),最终将肝门胆管完全包裹在空肠腔中(图 4D)。本术式设计保留了多种有利因素:彻底切除囊肿壁是为了将远期癌变风险降到最低;肝管劈开成型则有利于保证胆流足够通畅;在肝门胆管周围做吻合,有助于减少瘢痕形成对吻合口直径的影响。
|
Download:
|
| 图 4 腹腔镜肝门扩大置入空肠吻合术手术要点 A.彻底切除肝外囊肿壁;B.向上纵行劈开左、右肝管,直至清晰显露双侧胆汁流出道开口(箭头处所示);C.取肝门胆管周围的Glisson包膜进行吻合;D.完成后外观 Fig. 4 Surgical essentials of laparoscopic widened-porta embedding anastomosis | |
本研究应用了巴马小型猪模型,从组织病理学角度验证了该吻合方式的有效性。由于本研究选择的实验动物具有与人体相近的遗传基础、器官功能和组织结构[35],因此适合用来模拟两组吻合方式并对后期疗效进行对比。伤口愈合过程包括炎性细胞趋化迁移、胶原合成及基质重构等一系列复杂的生理变化,大致分为炎症期、增生期、收缩期和稳定期4个时期。TGF-β1是调节细胞外基质(包括Ⅰ型胶原纤维)合成的关键细胞因子,具有促纤维化作用[36, 37]。B组实验动物有5只出现吻合口狭窄,提示吻合直径<6 mm时单纯端侧吻合不能较好地维持胆流通畅,而异常肝功能指标也反映出吻合口梗阻后出现了一定的肝损伤征象。组织学证据表明端侧吻合后腔内黏膜形态紊乱、局部炎症反应较重,TGF-β1显著增高且作用时间持续较长,Ⅰ型胶原纤维沉积异常,粗大紊乱的纤维组织累及吻合口全层,形成环形狭窄。而套入式吻合则效果更理想,得益于管壁外围炎症反应程度较轻、腔内黏膜愈合早以及组织中TGF-β1和Ⅰ型胶原表达较低,最终排列有序的纤维组织仅位于吻合口外围,对内径造成的影响较小。瘢痕形成过程见图 5。
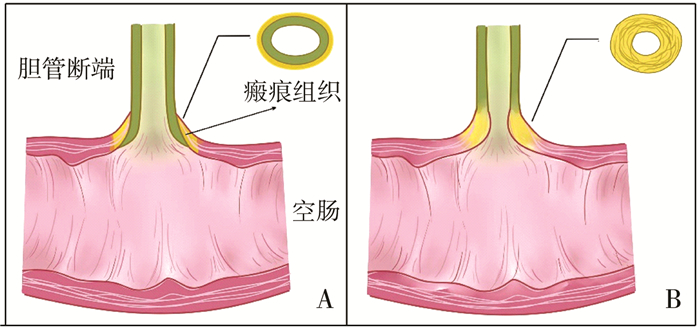
|
Download:
|
| 图 5 套入式吻合 A.与单纯端侧进行吻合; B.术后瘢痕形成 Fig. 5 Diagrams of scar formation for widened-porta embedding anastomosis | |
不难设想,直径5~6mm的吻合口径采用单纯端侧吻合后,环状瘢痕的收缩可将口径缩小到3~4 mm,而同样直径的吻合口在肝门扩大置入空肠吻合术后仍可保留5~6 mm的胆汁流出道。肝门扩大置入空肠吻合术的临床应用效果也进一步证明了其可行性和有效性,同时,本中心从2015年开始应用da Vinci机器人开展小儿消化道畸形的手术治疗(包括胆总管囊肿根治术)[38],2018年底我们开展了机器人肝门扩大置入空肠吻合术,获得了更理想的操作精准性和流畅性。
总之,腹腔镜肝门扩大埋入空肠吻合术适合应用于肝门胆管直径<6 mm的胆总管囊肿,中期随访效果基本满意,但后续还需进一步开展临床对比研究和远期随访验证。
| 1 |
Senthilnathan P, Patel ND, Nair AS, et al. Laparoscopic management of choledochal cyst-technical modifications and outcome analysis[J]. World J Surg, 2015, 39(10): 2550-2556. DOI:10.1007/s00268-015-3111-8. |
| 2 |
Wen Z, Liang H, Liang J, et al. Evaluation of the learning curve of laparoscopic choledochal cyst excision and Roux-en-Y hepaticojejunostomy in children:CUSUM analysis of a single surgeon's experience[J]. Surg Endosc, 2017, 31(2): 778-787. DOI:10.1007/s00464-016-5032-5. |
| 3 |
Yeung F, Chung PH, Wong KK, et al. Biliary-enteric reconstruction with hepaticoduodenostomy following laparoscopic excision of choledochal cyst is associated with better postoperative outcomes:a single-centre experience[J]. Pediatr Surg Int, 2015, 31(2): 149-153. DOI:10.1007/s00383-014-3648-x. |
| 4 |
李龙, 余奇志, 刘刚, 等. 经腹腔镜行先天性胆总管囊肿切除肝管空肠Roux-Y吻合术的探讨[J]. 临床小儿外科杂志, 2002, 1(1): 54-56. DOI:10.3969/j.issn.1671-6353.2002.01.024. Li L, Yu QZ, Liu G, et al. Laparoscopic excision of choledochal cyst plus bile duct jejunum Roux-Y anastomosis[J]. Journal of Clinical Pediatric Surgery, 2002, 1(1): 54-56. DOI:10.3969/j.issn.1671-6353.2002.01.024. |
| 5 |
Diao M, Li L, Cheng W. Timing of surgery for prenatally diagnosed asymptomatic choledochal cysts:a prospective randomized study[J]. J Pediatr Surg, 2012, 47(3): 506-512. DOI:10.1016/j.jpedsurg.2011.09.056. |
| 6 |
Hamada Y, Ando H, Kamisawa T, et al. Diagnostic criteria for congenital biliary dilatation 2015[J]. J Hepatobiliary Pancreat Sci, 2016, 23(6): 342-346. DOI:10.1002/jhbp.v23.6. |
| 7 |
Tang ST, Yang Y, Wang Y, et al. Laparoscopic choledochal cyst excision, hepaticojejunostomy, and extracorporeal Roux-en-Y anastomosis:a technical skill and intermediate-term report in 62 cases[J]. Surg Endosc, 2011, 25(2): 416-422. DOI:10.1007/s00464-010-1183-y. |
| 8 |
Farello GA, Cerofolini A, Rebonato M, et al. Congenital choledochal cyst:video-guided laparoscopic treatment[J]. Surg Laparosc Endosc, 1995, 5(5): 354-358. |
| 9 |
Todani T, Watanabe Y, Urushihara N, et al. Biliary complications after excisional procedure for choledochal cyst[J]. J Pediatr Surg, 1995, 30(3): 478-481. DOI:10.1016/0022-3468(95)90060-8. |
| 10 |
Kim JH, Choi TY, Han JH, et al. Risk factors of postoperative anastomotic stricture after excision of choledochal cysts with hepaticojejunostomy[J]. J Gastrointest Surg, 2008, 12(5): 822-828. DOI:10.1007/s11605-007-0415-5. |
| 11 |
Kim JW, Moon SH, Park DH, et al. Course of choledochal cysts according to the type of treatment[J]. Scand J Gastroenterol, 2010, 45(6): 739-745. DOI:10.3109/00365521003675054. |
| 12 |
Cho MJ, Hwang S, Lee YJ, et al. Surgical experience of 204 cases of adult choledochal cyst disease over 14 years[J]. World J Surg, 2011, 35(5): 1094-1102. DOI:10.1007/s00268-011-1009-7. |
| 13 |
Wang DC, Liu ZP, Li ZH, et al. Surgical treatment of congenital biliary duct cyst[J]. BMC Gastroenterol, 2012, 12: 29. DOI:10.1186/1471-230X-12-29. |
| 14 |
Jung K, Han HS, Cho JY, et al. Is preoperative subclassification of type Ⅰ choledochal cyst necessary?[J]. Korean J Radiol, 2012, 13 Suppl 1: 112-116. |
| 15 |
Narayanan SK, Chen Y, Narasimhan KL, et al. Hepaticoduodenostomy versus hepaticojejunostomy after resection of choledochal cyst:a systematic review and meta-analysis[J]. J Pediatr Surg, 2013, 48(11): 2336-2342. DOI:10.1016/j.jpedsurg.2013.07.020. |
| 16 |
Qiao G, Li L, Li S, et al. Laparoscopic cyst excision and Roux-Y hepaticojejunostomy for children with choledochal cysts in China:a multicenter study[J]. Surg Endosc, 2015, 29(1): 140-144. DOI:10.1007/s00464-014-3667-7. |
| 17 |
Dutta HK. Hepatic lobectomy and mucosectomy of intrahepatic cyst for type Ⅳ-A choledochal cyst[J]. J Pediatr Surg, 2012, 47(11): 2146-2150. DOI:10.1016/j.jpedsurg.2012.07.008. |
| 18 |
Perdikakis E, Chryssou EG, Koulentaki M, et al. Assessment of a postoperative anastomotic stricture following correction surgery of a type Ⅳa choledochal cyst using Gd-EOB-DTPA-enhanced magnetic resonance cholangiography[J]. Clin J Gastroenterol, 2011, 4(6): 396-400. DOI:10.1007/s12328-011-0261-6. |
| 19 |
Diao M, Li L, Cheng W. Recurrence of biliary tract obstructions after primary laparoscopic hepaticojejunostomy in children with choledochal cysts[J]. Surg Endosc, 2016, 30(9): 3910-3915. DOI:10.1007/s00464-015-4697-5. |
| 20 |
Sheng Q, Lv Z, Xu W, et al. Reoperation after cyst excision with hepaticojejunostomy for choledochal cysts:our experience in 18 cases[J]. Med Sci Monit, 2017, 23(12): 1371-1377. |
| 21 |
Urushihara N, Fukumoto K, Nouso H, et al. Hepatic ductoplasty and hepaticojejunostomy to treat narrow common hepatic duct during laparoscopic surgery for choledochal cyst[J]. Pediatr Surg Int, 2015, 31(10): 983-986. DOI:10.1007/s00383-015-3779-8. |
| 22 |
Stringer MD. Wide hilar hepaticojejunostomy:the optimum method of reconstruction after choledochal cyst excision[J]. Pediatr Surg Int, 2007, 23(6): 529-532. DOI:10.1007/s00383-007-1929-3. |
| 23 |
Urushihara N, Fukuzawa H, Fukumoto K, et al. Totally laparoscopic management of choledochal cyst:Roux-en-Y Jejunojejunostomy and wide hepaticojejunostomy with hilar ductoplasty[J]. J Laparoendosc Adv Surg Tech A, 2011, 21(4): 361-366. DOI:10.1089/lap.2010.0373. |
| 24 |
Li S, Wang W, Yu Z, et al. Laparoscopically assisted extrahepatic bile duct excision with ductoplasty and a widened hepaticojejunostomy for complicated hepatobiliary dilatation[J]. Pediatr Surg Int, 2014, 30(6): 593-598. DOI:10.1007/s00383-014-3501-2. |
| 25 |
Morotomi Y, Todani T, Watanabe Y, et al. Modified Kasai's procedure for a choledochal cyst with a very narrow hilar duct[J]. Pediatr Surg Int, 1996, 11(1): 58-59. DOI:10.1007/BF00174590. |
| 26 |
Pal K, Singh VP, Mitra DK. Partial hepatectomy and total cyst excision is curative for localized type Ⅳ-a biliary duct cysts-report of four cases and review of management[J]. Eur J Pediatr Surg, 2009, 19(3): 148-152. DOI:10.1055/s-0029-1202365. |
| 27 |
Xia HT, Liu Y, Yang T, et al. Better long-term outcomes with hilar ductoplasty and a side-to-side Roux-en-Y hepaticojejunostomy[J]. J Surg Res, 2017, 215(1): 21-27. |
| 28 |
Watanabe Y, Toki A, Todani T. Bile duct cancer developed after cyst excision for choledochal cyst[J]. J Hepatobiliary Pancreat Sci, 1999, 6(3): 207-212. DOI:10.1007/s005340050108. |
| 29 |
Liu YB, Wang JW, Devkota KR, et al. Congenital choledochal cysts in adults:twenty-five-year experience[J]. Chin Med J(Engl), 2007, 120(16): 1404-1407. |
| 30 |
Stringer MD. Laparoscopic management of choledochal cysts:is a keyhole view missing the big picture?[J]. Pediatr Surg Int, 2017, 33(6): 651-655. DOI:10.1007/s00383-017-4089-0. |
| 31 |
Ohtsuka H, Fukase K, Yoshida H, et al. Long-term outcomes after extrahepatic excision of congenital choladocal cysts:30 years of experience at a single center[J]. Hepatogastroenterology, 2015, 62(137): 1-5. |
| 32 |
Ohashi T, Wakai T, Kubota M, et al. Risk of subsequent biliary malignancy in patients undergoing cyst excision for congenital choledochal cysts[J]. J Gastroenterol Hepatol, 2013, 28(2): 243-247. |
| 33 |
Sastry AV, Abbadessa B, Wayne MG, et al. What is the incidence of biliary carcinoma in choledochal cysts, when do they develop, and how should it affect management?[J]. World J Surg, 2015, 39(2): 487-492. DOI:10.1007/s00268-014-2831-5. |
| 34 |
Ten Hove A, de Meijer VE, Hulscher JBF, et al. Meta-analysis of risk of developing malignancy in congenital choledochal malformation[J]. Br J Surg, 2018, 105(5): 482-490. DOI:10.1002/bjs.10798. |
| 35 |
Yin L, Yang H, Li J, et al. Pig models on intestinal development and therapeutics[J]. Amino acids, 2017, 49(12): 2099-2106. DOI:10.1007/s00726-017-2497-z. |
| 36 |
Lichtman MK, Otero-Vinas M, Falanga V. Transforming growth factor beta(TGF-beta)isoforms in wound healing and fibrosis[J]. Wound Repair Regen, 2016, 24(2): 215-222. DOI:10.1111/wrr.12398. |
| 37 |
Klass BR, Grobbelaar AO, Rolfe KJ. Transforming growth factor beta1 signalling, wound healing and repair:a multifunctional cytokine with clinical implications for wound repair, a delicate balance[J]. Postgrad Med J, 2009, 85(999): 9-14. DOI:10.1136/pgmj.2008.069831. |
| 38 |
张茜, 曹国庆, 汤绍涛, 等. da Vinci机器人腹腔镜治疗小儿先天性胆总管囊肿[J]. 临床小儿外科杂志, 2016, 15(2): 137-139. Zhang Q, Cao GQ, Tang ST, et al. Laproscopic treatment of congenital choledochal cysts in children using da Vinci robot[J]. Journal of Clinical Pediatric Surgery, 2016, 15(2): 137-139. |
 2019, Vol. 18
2019, Vol. 18


