神经母细胞瘤是最常见的儿童颅外实体恶性肿瘤,占儿童肿瘤患者总数的8% ~10%,其中腹膜后来源的神经母细胞瘤又占神经母细胞瘤总数的65%[1]。手术是治疗神经母细胞瘤的主要方法之一,能否完整切除肿瘤并精确判断肿瘤扩散程度是决定肿瘤能否准确分期和后续治疗能否顺利进行的关键。虽然新辅助化疗能在一定程度上提高肿瘤切除的成功率,然而如何在精准、完整切除肿瘤的同时保证周围血管(特别是被肿瘤包裹的下腔静脉、腹主动脉、肾动脉、腹腔干等重要血管)不受损伤已成为临床研究的热点。近年来,肿瘤分块切除技术及血管骨骼化手术逐渐兴起,对于提高肿瘤切除的成功率具有重要意义[2]。由于神经母细胞瘤往往呈浸润性生长,重要血管往往被包绕在肿瘤中,而血管骨骼化手术要求外科医师切除肿瘤至血管外膜,因此在不清楚肿瘤与血管间关系或肿瘤内部血管走行的情况下,分块切除手术及血管骨骼化手术均易造成相应的血管并发症。近年来,3D打印技术已开始逐步应用到外科临床工作中,并有了较为成功的尝试[3-7]。它能在术前重建肿瘤实体模型,进行精确的手术规划和高难度的手术训练,也更便于医患间进行术前交流,但该技术目前在儿童腹膜后肿瘤中的应用报道相对较少。因此本研究将初步探讨3D打印技术在儿童腹膜后神经母细胞瘤血管骨骼化手术中的应用价值。
材料与方法 一、研究对象以2016年1月至2018年6月重庆医科大学附属儿童医院收治的神经母细胞瘤患儿为研究对象。纳入标准:①拟行血管骨骼化肿瘤切除术者;②由同一团队完成手术者;③CT结果提示肿瘤包绕血管生长者。排除标准:①肿瘤未包绕血管者;②随访时间<3个月者。患儿术前均行全腹部平扫及增强CT,并完善术前化验检查,同时记录患儿性别、年龄、肿瘤大小、手术时间、手术切除率、并发症发生率等资料。患儿家属在了解研究目的后均明确表示同意参与本临床研究。
本研究共纳入符合标准的患儿40例,男女各20例,术前均进行医患沟通拟初步确定基于3D打印模型的治疗方案,最终根据家属术前是否选择3D打印模型将患儿分为3D打印组和非3D打印组。其中3D打印组15例,男7例,女8例,平均月龄(40.5±28.6)个月;非3D打印组25例,男13例,女12例,平均月龄(43.3±24.8)个月。两组患儿年龄、性别、肿瘤分期、肿瘤大小、肿瘤侵犯血管数目(主要观察重要血管,如腹主动脉、腹腔干、肠系膜上动脉、肾动脉、下腔静脉、肾静脉、脾静脉、门静脉等)差异均无统计学意义(P>0.05),具有可比性,见表 1。
|
|
表 1 两组患儿基线资料对比 Table 1 Baseline profiles of two groups |
三维重建软件为Mimics,3D打印机型号为Objet 500 Connex3(上海三的部落信息科技有限公司)。分别采集3D打印组患儿动脉期、静脉期、延迟期血流信号数据并存储为DICOM格式文件,并导入Mimics软件进行三维重建。人工去除肿瘤周围脂肪组织,保留并重建肿瘤周围大动脉、静脉及其他邻近脏器,以更清晰地显示肿瘤部位及其与周围结构的关系。打印采用多色树脂喷射法,将重建数据以stl格式导入Objet 500 Connex3打印机自带软件,选择合适的颜色进行快速成型。
三、手术方法实际手术中多采用腹部肋缘下切口进腹,根据术前影像学检查及3D打印模型预先制定手术计划。从未被肿瘤包裹的血管开始解剖游离,依次切除,必要时行分块切除,避免遗漏肿瘤组织;与肿瘤关系紧密但切除后不造成并发症的血管予以切断结扎。同时应注意肿瘤占位效应造成的血管位置变化,降低手术的盲目性,避免误伤重要血管和器官。
四、满意度调查术前由同一术者向患儿家属交待病情,借助3D打印模型帮助患儿家属了解肿瘤性质、位置、特点,同时对手术方式及可能出现的并发症等内容进行说明。患儿家属于沟通前后分两次回答手术相关问题,旨在对3D打印模型用于医患交流的认可度进行调查。
五、统计学处理应用SPSS22.0进行统计学分析。两组间性别比例、手术切除率、并发症发生率及家属对手术相关问题掌握情况的对比采用χ2检验,两组间年龄、肿瘤大小、手术时间的对比采用两独立样本t检验,患儿家属两次问卷得分的结果对比采用配对t检验,P < 0.05为差异有统计学意义。
结 果3D打印组术前接受CT扫描后使用三维重建软件和3D打印机对肿瘤模型进行分色打印(图 1),并应用3D模型联合CT资料向患儿家属交代病情,患儿家属对肿瘤病变特点、周围器官血管的分布情况及手术方案的认知程度均显著优于非3D打印组(P < 0.05),见表 2。
|
Download:
|
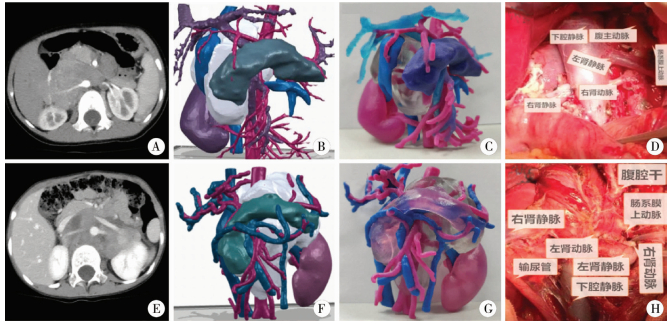
| 图 1 2例患儿CT、3D模型及术中大体图片 注 图A至图D为病例1的CT、软件重建、3D模型及术中图片;图A示右侧腹膜后肿瘤,跨越中线,双侧肾动静脉、肠系膜上动脉包绕在肿瘤中,图B为软件重建后示意图,图C为3D打印模型,图D为血管骨骼化手术后瘤床图。图E至图H为病例2的CT、软件重建、3D模型及术中图片,图E示左侧腹膜后肿瘤,跨越中线,肿瘤包绕双侧肾动静脉、肠系膜上动脉、肠系膜上动脉、腹腔干、下腔静脉,图F为软件重建后示意图,图G为3D打印模型,图H为血管骨骼化手术后瘤床图 Fig. 1 CT, 3D model and intraoperative gross pictures of two case | |
|
|
表 2 两组患儿家长对手术相关问题的了解程度 Table 2 Parents' understanding of surgery-related problems in two groups of children |
3D打印组无一例血管并发症发生,非3D打印组有1例术后出现患侧肾动脉闭塞及肾萎缩,1例术后出现脾脏短暂缺血性改变,经过扩血管治疗后恢复。3D打印组手术时间明显短于非3D打印组[(212.8±28.5)vs.(261.5±32.5),P < 0.05]。两组患儿术后均按儿童神经母细胞瘤诊疗专家共识进行治疗[8]。至随访完成时,3D打印组患儿疾病进展(包括原发部位复发)2例,3例因疾病进展死亡,2年生存率80%;非3D打印组患儿疾病进展(包括原发部位复发)3例,6例因疾病进展死亡,2年生存率76%;两组比较差异无统计学意义(P>0.05)。
讨 论神经母细胞瘤常起源于腹膜后,手术切除的过程中容易造成血管相关的并发症[9]。因此,全面准确地评估肿瘤与周围脏器及血管的关系对于手术规划具有重要意义。虽然3D可视化系统的出现提高了术者对人体解剖层面的认识[10],但3D可视化结果的判读高度依赖于观察者将数字3D图像转换为虚拟3D结构的能力。此外,术者在3D可视化系统中无法对肿瘤的触觉产生直观认知,而这对于正确理解器官和组织构造至关重要[11]。而3D打印技术能够从现有的“现实-虚拟”模式转变为“现实-虚拟-现实”模式,依托3D实体肿瘤模型进行术前规划,有望更加精准、完整地切除肿瘤,减少术后相关并发症。
虽然目前医患沟通开始慢慢被重视起来,但由于医学知识的专业性,尽管医生可以做到对患儿家属详细分析CT结果,并采用图文解说的方法介绍手术方案,但患儿家属仍存在较大的理解障碍。有文献报道,使用3D模型在术前与患儿家属进行沟通可使患儿家属对病情、手术方案的理解度明显提高[12];同时可有效提高住院医师专业学习的积极性,激发其探索能力,缩短学习曲线,为培养出更多高素质的住院医师奠定了坚实的基础[13]。但是也应该注意到,参与本研究的患儿家属多数是在医生先使用CT模型沟通后,再使用3D模型进行病情讲解,而多次的沟通本身可能会在一定程度上增强家属对病情的理解能力。本研究中参与调研的低年资医师认为,3D打印模型能够直观、多角度显示肿瘤特点及周围组织(特别是血管)的情况,弥补了低年资外科医师阅片经验不足的局限性,有助于提高手术成功率。但在实际的临床操作中存在部分较小的血管和术中实际大小不符合的情况,另有部分临近脏器组织的显示效果欠佳。这可能是因为在3D打印的过程中,如果血管内径较小(< 4 mm),为了满足打印效果并最大程度还原肿瘤与血管的关系,这些细小血管通常会被人为加厚;同时为了控制打印成本,我们仅仅选择了临近的肾脏、胰腺进行打印,而未打印输尿管、肠道、骨骼等部位,因此可能对肿瘤与周围脏器组织的整体认识产生偏差。另外,阅读3D模型后低年资医生对病理解剖和增强CT认知程度能够得到提升才是3D模型对于年轻医生培训有效性的关键所在,而满意度作为一个主观性较强的评价指标,可能存在个体化差异对研究结论造成的偏倚。
段光琦等[14]报道了采用3D打印技术可将儿童腹膜后肿瘤等比例还原,并能清晰显示儿童腹膜后肿瘤复杂的解剖关系,有助于术前规划出合理的手术方案。但在他们的报道中,作为儿童腹膜后肿瘤中手术难度最高的肿瘤-神经母细胞瘤仅3例。Yang T[15]等报道使用3D打印模型有利于提高术者腹膜后解剖层面的认知。结合本次研究结果,我们总结出如下经验:第一,评估腹膜后神经母细胞瘤与腹腔脏器的关系需重点重建并打印出肾脏、胰腺、肝脏、脾脏等实质器官,对于胃、膀胱等空腔脏器可根据具体情况选择是否打印。第二,评估肿瘤与重要血管关系需重点重建并打印出腹主动脉、腹腔干、肠系膜上下动脉、肾动脉、下腔静脉、门静脉、肾静脉、髂静脉等腹腔主要血管(尤其是静脉血管),因为静脉往往被肿瘤包绕生长,血管受压明显;且静脉血管壁较薄,术中容易发生撕裂造成大出血,故术前准确重建并预判重要血管的位置及其与肿瘤的关系对于血管骨骼化手术的成功施行具有重要指导意义。第三,手术过程中必要时可借助术中超声提高手术成功率,减少血管并发症的发生。本组患儿的2年生存率较高,可能与大多数病例在随访时仍处于治疗期或治疗结束的早期阶段相关,后续条件允许的情况下可继续随访观察本组病例的长期存活情况。需要注意的是,因3D打印的费用相对较高,在临床中不能应用于所有病人,因此本研究分组未完全遵循随机化的原则。但由于来我院就诊的神经母细胞瘤患儿以Ⅲ期Ⅳ期为主,均对腹膜后的血管有较多的累及,且基线资料提示两组间肿瘤大小及血管数目没有统计学差异,因此本研究结论具有一定的借鉴意义。
| 1 |
Van Golen CM, Soules ME, Grauman AR, et al. N-Myc overexpression leads to decreased beta1 integrin expression and increased apoptosis in human neuroblastoma cells[J]. Oncogene, 2003, 22(17): 2664-2673. DOI:10.1038/sj.onc.1206362. |
| 2 |
Newman EA, Abdessalam S, Aldrink JH, et al. Update on neuroblastoma[J]. J Pediatr Surg, 2018, S0022-3468(18): 30574-30578. DOI:10.1016/j.jpedsurg.2018.09.004. |
| 3 |
张文举, 滕勇, 季明华, 等. 基于3D打印技术辅助治疗胫骨远端粉碎性骨折[J]. 中国医学装备, 2017, 14(12): 60-64. DOI:10.3969/J.ISSN.1672-8270.2017.12.017. W J, Teng Y, Ji MH, et al. Adjuvant treatment for comminuted fractures of distal tibia based on 3D printing technique[J]. China Medical Equipment, 2017, 14(12): 60-64. DOI:10.3969/J.ISSN.1672-8270.2017.12.017. |
| 4 |
方驰华, 方兆山, 范应方, 等. 三维可视化、3D打印及3D腹腔镜在肝肿瘤外科诊治中的应用[J]. 南方医科大学学报, 2015, 35(5): 639-645. DOI:10.3969/j.issn.1673-4254.2015.05.04. C H, Fang ZS, Fan YF, et al. Application of 3D visualization, 3D printing and 3D laparoscopy in the diagnosis and surgical treatment of hepatic tumors[J]. Journal of Southern Medical University, 2015, 35(5): 639-645. DOI:10.3969/j.issn.1673-4254.2015.05.04. |
| 5 |
Wang J, Yang M, Zhu Y, et al. Phage nanofibers induce vascularized osteogenesis in 3D printed bone scaffolds[J]. Adv Mater, 2014, 26(29): 4961-4966. DOI:10.1002/adma.201400154. |
| 6 |
Schmauss D, Juchem G, Weber S, et al. Three-dimensional printing for perioperative planning of complex aortic arch surgery[J]. Ann Thorac Surg, 2014, 97(6): 2160-2163. DOI:10.1016/j.athoracsur.2014.02.011. |
| 7 |
Chan HH, Siewerdsen JH, Vescan A, et al. 3D rapid prototyping for otolaryngology-head and neck surgery:applications in image-guidance, surgical simulation and patient-specific modeling[J]. PLoS One, 2015, 10(9): e0136370. DOI:10.1371/journal.pone.0136370. |
| 8 |
中国抗癌协会小儿肿瘤专业委员会, 中华医学会小儿外科学分会肿瘤外科学组. 儿童神经母细胞瘤诊疗专家共识[J]. 中华小儿外科杂志, 2015, 36(1): 3-7. DOI:10.3760/cma.j.issn.0253-3006.2015.01.002. CCCG, Oncology Surgery Group, Society of Pediatric Surgery, Chinese Medical Association. Expert consensus of diagnosing and treating pediatric neuroblastoma[J]. Chin J Pediatr Surg, 2015, 36(1): 3-7. DOI:10.3760/cma.j.issn.0253-3006.2015.01.002. |
| 9 |
Mirilas P, Skandalakis JE. Surgical anatomy of the retroperitoneal spaces, Part V:Surgical applications and complications[J]. Am Surg, 2010, 76(4): 358-364. |
| 10 |
Fang CH, Tao HS, Yang J, et al. Impact of three-dimensional reconstruction technique in the operation planning of centrally located hepatocellular carcinoma[J]. J Am Coll Surg, 2015, 220(1): 28-37. DOI:10.1016/j.jamcollsurg.2014.09.023. |
| 11 |
Lee N. The Lancet Technology:3D printing for instruments, models, and organs?[J]. Lancet, 2016, 388(10052): 1368. DOI:10.1016/S0140-6736(16)31735-4. |
| 12 |
葛宏伟, 张弋, 李宁忱, 等. 3D打印技术在肾肿瘤手术规划中的应用研究初探[J]. 中华泌尿外科杂志, 2014, 35(9): 659-663. DOI:10.3760/cma.j.issn.1000-6702.2014.09.007. Ge HW, Zhang Y, Li NC, et al. Application of 3D-printing technology in surgical planning for renal tumor:a preliminary report[J]. Chin J Urol, 2014, 35(9): 659-663. DOI:10.3760/cma.j.issn.1000-6702.2014.09.007. |
| 13 |
姬文晨, 蒋婉婷, 李志强, 等. 3D打印结合PBL在骨科住院医师规范化培训中的应用[J]. 中国医学教育技术, 2017, 31(1): 64-67. DOI:10.13566/j.cnki.cmet.cn61-1317/g4.201701019. Ji WC, Jiang WT, Li ZQ, et al. Combined use of 3D printing and PBL in orthopedic residents' standardized training[J]. China Medical Education Technology, 2017, 31(1): 64-67. DOI:10.13566/j.cnki.cmet.cn61-1317/g4.201701019. |
| 14 |
段光琦, 王啸, 刘洁, 等. 3D打印技术在儿童腹膜后肿瘤手术规划中的应用[J]. 临床小儿外科杂志, 2017, 16(5): 430-435. DOI:10.3969/j.issn.1671-6353.2017.05.004. Duan GQ, Wang X, Liu J, et al. Application of 3-dimensional printing in surgical planning for pediatric retroperitoneal tumor[J]. J Clin Ped Sur, 2017, 16(5): 430-435. DOI:10.3969/j.issn.1671-6353.2017.05.004. |
| 15 |
Yang T, Lin S, Tan T, et al. Impact of 3D printing technology on comprehension of surgical anatomy of retroperitoneal tumor[J]. World J Surg, 2018, 42(8): 2339-2343. DOI:10.1007/s00268-018-4489-x. |
 2019, Vol. 18
2019, Vol. 18


