新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是新生儿期常见的消化道感染性疾病之一,早产、极低出生体重儿的发病率约为12%,极低出生体重儿NEC病死率达20% ~30%[1, 2]。目前有关NEC的发病机制尚不清楚,其中早产被认为是最重要的危险因素,其他危险因素包括窒息、配方奶粉喂养、脓毒症、肠道缺血再灌注损伤、宫内生长发育迟缓等[3, 4]。NEC常见的临床表现包括腹胀、腹壁固定肠袢、腹壁颜色改变(呈红色或青紫色)、大便潜血、呼吸暂停、温度不稳定等,严重者可出现低血压、呼吸衰竭,甚至死亡。然而NEC早期临床表现没有很高的特异性,难以与新生儿其他胃肠道疾病鉴别。因此,在腹腔感染及严重肠坏死发生之前,如何通过简便、重复性高的诊断方法指导最佳治疗方式的选择是当前新生儿外科医师重点关注的问题。传统炎性指标C反应蛋白(C reactive protein, CRP)、血清淀粉样蛋白A(serum amyloid A, SAA)虽然敏感性高,但存在特异性低、发病后达到浓度峰值时间长等不足,因此难以对NEC进行早期诊断[5, 6]。降钙素原(procalcitonin, PCT)为监测细菌感染的一种特性指标,据报道降钙素原在早期辅助诊断NEC时兼具较好的灵敏度和特异度[7]。白细胞介素6(interleukin-6, IL-6)是参与脓毒症及脓毒血症发生过程的一种炎性介质,在机体发生炎症2~3 h后达到血浓度高峰,可作为机体感染后的一种监测指标。有研究曾分别报道血清PCT、IL-6、CRP在NEC诊断过程中的参考意义[8],但未见将PCT、IL-6、CRP作为NEC手术治疗最佳时机决策依据的相关报道,因此本研究选择新生儿NEC为研究对象,探讨PCT、IL-6、CRP在指导NEC手术时机选择中的应用价值。
材料与方法 一、研究对象选择遵义医学院附属医院2010年1月至2017年10月收治的NEC患儿作为研究对象,NEC的诊断标准:①胃残奶增多、腹胀或呕吐咖啡样物、血便或大便潜血阳性、肠鸣音消失、腹部压痛阳性;②体温不升或发热、呼吸暂停、代谢性酸中毒或血小板减少;③肠充气或功能性肠梗阻、肠壁积气、气腹;④肠壁增厚、肠蠕动消失、肠壁积液。根据修正的Bell标准对入选患儿进行分期[9]。
纳入标准:①确诊为NEC者;②在了解研究目的后自愿参与本研究者。排除标准:①诊断不明确或疑似NEC者;②合并其他消化道疾病(如腹泻、巨结肠小肠结肠炎)者;③其他感染性疾病者。按照病例对照设计原则,另选取同期诊断为由一般感染导致脓毒血症(非NEC)的新生儿36例作为对照组。所有患儿血液标本的留取均征得患儿家属知情同意。
二、研究方法分别于发病后1 h、6 h、12 h取患儿静脉血2 mL,室温放置2 h后置于离心管中,2 000 r/min离心10 min,吸取上层血清置于EP管并保存在-80℃低温环境中待测。按照仪器及试剂使用说明书进行操作,其中PCT、IL-6试剂购自瑞士罗氏诊断试剂公司,检测仪器为罗氏E170,检测方法为电化学发光定量法;CRP试剂购自美国贝克曼试剂公司,检测仪器为贝克曼IAMMGE,检测方法为速率散射比浊法。
NEC患儿按治疗方式分为手术组、非手术组。收集患儿临床表现及腹部X线检查结果,根据改良Bell分期标准分为Bell(Ⅰ)期、Bell(Ⅱa)期、Bell(Ⅱb)期及Bell(Ⅲ)期。分别计算手术组、非手术组及对照组三组患儿PCT、IL-6、CRP诊断NEC的灵敏度、特异度、Youden指数。
三、统计方法采用SPSS 19.0进行统计学分析。由于本研究中计量资料大多服从或近似服从正态分布,因此采用(x±s)进行描述,组间比较采用单因素方差分析,两两间的比较采用SNK法并对显著性水准进行校正;计数资料用率、构成比进行描述,组间比较采用χ2检验,两两间率的比较采用卡方分割法并对显著性水准进行校正。通过重复测量方差分析对比不同Bell分期下PCT、IL-6、CRP在不同时间点的变化情况。治疗方案的影响因素分析采用非条件Logistic回归,对进入回归方程的影响因素采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析其最佳临界值,以评估NEC最佳手术时机对应的指标截点。采用(x±1.96s)描述95%医学参考值范围。以P < 0.05为差异有统计学意义。
结 果 一、临床资料三组患儿胎龄差异有统计学意义(P < 0.05),其中手术组胎龄最低,其后依次为非手术组、对照组;手术组出生体重显著低于非手术组和对照组,差异有统计学意义(P < 0.05),但非手术组与对照组出生体重差异没有统计学意义;三组间性别比例、发病时间差异无统计学意义(P>0.05)。合并症主要为低血糖、新生儿肺炎、低体重及窒息,三组间新生儿肺炎发生率及死亡率差异有统计学意义(P < 0.05)。详见表 1。
|
|
表 1 三组患儿临床资料比较 Table 1 Clinical and demographic characteristics of three groups |
三组患儿确诊时,手术组血清PCT、IL-6、CRP水平均显著高于非手术组和对照组(P < 0.05),详见表 2。同一监测时点组内,Bell分期从(Ⅰ)到(Ⅲ)期血清PCT、IL-6、CRP水平均呈现出逐渐升高的趋势(P < 0.05);同一Bell分期组内,发病后1 h、6 h、12 h血清PCT、IL-6、CRP水平均呈现出逐渐升高的趋势(P < 0.05);Bell分期与检测时间不存在交互效应(P>0.05),其中PCT、IL-6、CRP最高值均出现在发病后12 h组内Bell分期为(Ⅲ)期的亚组中,最低值均出现在发病后1 h组内Bell分期为(Ⅰ)期的亚组中,详见表 3。
|
|
表 2 三组患儿确诊时血清PCT、IL-6、CRP水平比较 Table 2 PCT, IL-6 and CRP serum levels of three groups at a definite diagnosis |
|
|
表 3 不同Bell分期下PCT、IL-6、CRP在不同时间点的均值比较 Table 3 Mean comparisons of PCT, IL-6 and CRP at different timepoints and Bell stages |
将不同的治疗方案设为因变量,将性别、治疗方式、胎龄以及PCT、IL-6、CRP在发病1 h、6 h、12 h的浓度值设为自变量进行非条件Logistic回归分析,入选标准α入=0.10,剔除标准α出=0.15,选择backward法对自变量进行筛选。结果显示发病后6 h血清PCT(OR=2.612,95%CI:1.725~4.781)、发病后6 h血清IL-6(OR=1.896,95%CI:1.439~3.234)及发病后12 h血清CRP(OR=1.330,95%CI:1.004~2.314)水平是NEC患儿是否选择手术治疗的主要影响因素,详见表 4。
|
|
表 4 治疗方案影响因素的Logistic回归分析结果 Table 4 Logistic regression analysis of major influencing factors for selecting NEC treatments |
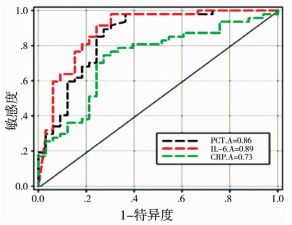
手术组NEC患儿以术后病理结果为金标准绘制ROC曲线,对Logistic回归分析结果中纳入的3个影响因素进行诊断效能分析,求得PCT 6 h、IL-6 6 h、CRP 12 h三个指标的ROC曲线下面积分别为0.854(95%CI:0.768~0.934)、0.889(95%CI:0.803~0.967)、0.732(95%CI:0.652~0.806)。考虑到手术指征的严谨性,每项检查结果需结合95%医学参考值范围,因此最佳临界点分别为0.62(0.38~0.86)ng/mL、145.85(137.70~154.01)pg/mL、8.35(7.27~9.43)mg/L。对ROC曲线下面积进行两两间比较,发现PCT 6 h与IL-6 6 h的ROC曲线下面积没有统计学差异(Z=0.960,P=0.470),PCT 6 h与CRP 12 h的ROC曲线下面积有统计学差异(Z=2.215,P=0.008),IL-6 6 h与CRP 12 h的ROC曲线下面积有统计学差异(Z=2.852,P=0.001)。详见表 5和图 1。
|
|
表 5 PCT、IL-6、CRP对NEC手术时机选择诊断效能的比较 Table 5 Comparison of PCT, IL-6 and CRP for diagnostic efficiency of managing NEC by operative timing |
|
Download:
|
| 图 1 PCT、IL-6、CRP的ROC曲线 Fig. 1 ROC curves of PCT, IL-6 and CRP | |
NEC为新生儿常见的感染性疾病之一,具有起病急、病情进展快、诊断困难、内科治疗效果有限、外科手术时机难以判断、死亡率高等特点。目前NEC的诊断方法主要包括临床表现、影像学检查、非特异性和特异性的炎症标志物测定、基因标志物测定及蛋白质组学分析等。国内外学者多选择Bell分级来作为NEC手术时机的判定依据,以临床表现和腹部X线检查结果作为NEC的诊断依据,这些指标的敏感性及特异性普遍不高,为临床外科手术干预方式的选择带来了一定的困惑[10, 11]。但从目前临床检验的学科发展上看,应用较多的还是非特异性的炎症标志物(如PCT、IL-6、CRP等),大量研究发现NEC患儿会出现相应炎症标志物的改变[12, 13]。因此本研究选取检测重复性较好、检测周期短、检测费用较低的PCT、IL-6、CRP作为检测指标,评价三者对手术时机判定的应用价值。
PCT是一种无活性的血清降钙素前体物质,为细菌感染所特有,可用于判断炎症的严重程度,与其他非特异性感染区分开来。机体侵入性感染(如应激、缺血、局部细菌感染等)后2~3 h PCT可出现轻度升高。研究发现,NEC早期PCT处于较低水平,当肠道细菌产物(如脂多糖,血小板活化因子)穿透受损的肠道黏膜层,引起未成熟的肠黏膜屏障发生异常的免疫反应后,PCT会出现急剧上升并维持6~24 h[14]。因此在NEC发病进入Bell(Ⅱb)期和Bell(Ⅲ)期时,及时的PCT检测有助于NEC诊断,并为下一步治疗措施的选择提供参考依据[15]。Cetinkaya等[6]发现PCT诊断早产儿NEC的最佳诊断点为0.24 ng/mL,灵敏度达92.5%,特异度达98.1%,明显优于CRP、IL-6和SAA。本研究中,手术组NEC患儿的PCT浓度明显高于非手术组,随着NEC患病时间的延长,其浓度逐渐升高。研究还发现部分患儿在早期干预(如抗生素的应用、禁食等)后PCT值逐渐下降,保守治疗成功。但部分患儿(特别是早产儿)诊断为NEC后,PCT浓度值逐渐上升,最终出现腹膜炎,需外科手术干预。本研究通过ROC曲线分析得出PCT非手术组与手术组之间的临界点为0.62 ng/mL,诊断效能总体优于CRP。
IL-6与肠道炎症及循环中促炎因子的大量释放有关。由于促炎细胞因子的释放可导致肠道缺血,因此在某些特殊情况下,即使肠道未发生细菌感染也可能导致败血症性休克。小鼠感染肠道耶尔森菌后,由于IL-6的中和作用,造成感染局部和循环中的抑炎因子IL-1ra水平显著降低。此外,IL-6可被TNFα、IL-1等促炎因子激活,导致淋巴细胞活化并分化成细胞毒性T细胞,败血症新生儿的脐带血中,IL-6水平高出对照组近30倍。本研究发现,IL-6浓度较对照组明显增高,手术组显著高于非手术组,非手术组与手术组之间的临界点为145.85 pg/mL,高于此临界点推荐手术治疗。其诊断效能与PCT无显著差异,但优于CRP。有研究报道IL-6的主要作用是放大和催化炎症反应,也是临床上诊断急慢性炎症常用的炎症标志物,其含量越高代表感染越严重[17]。因此,我们可根据IL-6的浓度范围评估NEC的炎症程度,降低NEC患儿术后并发症发生率。
CRP是一种急性时相反应蛋白,但机体出现感染或组织损伤引起炎症时,炎症细胞因子会刺激肝脏的上皮细胞分泌大量CRP。早期研究发现NEC中83%的患儿会出现CRP升高,一般新生儿CRP水平低于2 mg/L,高于此值即认为患儿可能出现细菌感染,但病毒感染、心血管疾病、肿瘤等因素也可导致CRP升高[18]。Pourcyrous[19]等发现,BellⅡ期时CRP多落在正常值范围内,但Ⅲ期时可出现持续升高。本研究中发现,NEC患儿CRP水平显著高于对照组,但由于部分NEC患儿病情进展较快,因此早期CRP处于正常水平。在诊断效能的评价中,其特异性及敏感性均低于PCT和IL-6,这可能是因为NEC患儿如同时合并肺炎、肠道感染、局部细菌感染时也可能出现CRP的升高,故特异性较差,因此不建议CRP单独作为NEC早期诊断及手术时机判定的指标。
Bell分期为评估NEC严重程度的一个常用临床分期标准,本研究将患儿按照Bell分期进行了分组,进一步比较不同Bell分期与对照组脓毒血症患儿PCT、IL-6、CRP水平。结果显示,NEC(Ⅰ)期与一般的脓毒血症无法通过PCT、IL-6、CRP水平进行鉴别,需借助患儿病史、体格检查、大便常规化验结果等作出判断;但对于NEC (Ⅱ)、(Ⅲ)期患儿,PCT、IL-6水平会随着患病时间延长逐渐升高。有研究报道NEC(Ⅱ)期患儿死亡率高达15%,NEC(Ⅲ)期因多出现腹膜炎、肠坏死、肠穿孔,死亡率高达60%[20]。由此可见,在NEC(Ⅰ)期提高对NEC的认识,做到早期禁食、胃肠减压并应用益生菌和抗生素可有效延缓NEC的进程;(Ⅱ)期若保守治疗无效,对血清PCT、IL-6浓度持续升高的患儿应进行早期外科干预,腹腔引流、剖腹探查、肠造瘘、坏死肠管切除均会在一定程度上降低NEC死亡率及术后短肠综合征、严重脓毒血症、多发肠狭窄的发生率。PCT、IL-6及CRP虽然均为NEC的非特异性指标,但通过Logistic回归分析发现三者均为治疗方式选择的影响因素。总之,PCT、IL-6和CRP三者均具有检测重复性好、周期短、费用低以及可实施该检测项目的医疗机构多等优点,对于NEC外科手术时机的选择具有一定的指导意义。
| 1 |
Lin PW, Stoll BJ. Necrotising enterocolitis[J]. Lancet, 2006, 368(9543): 1271-1283. DOI:10.1016/S0140-6736(06)69525-1. |
| 2 |
Coombs RC. The prevention and management of necrotizing enterocolitis[J]. Curr Paediatr, 2003, 13(3): 184-189. DOI:10.1016/S0957-5839(03)00025-3. |
| 3 |
史婧奕, 吕志宝. 双歧杆菌三联活菌散预防早产儿坏死性小肠结肠炎的临床初探[J]. 临床小儿外科杂志, 2016, 15(1): 72-75. DOI:10.3969/j.issn.1671-6353.2016.01.021. Shi JY, Lv ZB. The clinical study of preventing necrotizing enterocolitis in premature infants by bifido triple viable powder supplementation[J]. J Clin Ped Sur, 2016, 15(1): 72-75. DOI:10.3969/j.issn.1671-6353.2016.01.021. |
| 4 |
Bradshaw WT. Necrotizing enterocolitis:etiology, presentation, management, and outcomes[J]. J Perinat Neonatal Nurs, 2009, 23(1): 87-94. DOI:10.1097/JPN.0b013e318196fefb. |
| 5 |
陈明祥, 金先庆. 新生儿坏死性小肠结肠炎手术治疗进展[J]. 临床小儿外科杂志, 2012, 11(4): 298-301. DOI:10.3969/j.issn.1671-6353.2012.04.020. Chen MX, Jin XQ. Advances in surgeries for neonatal necrotizing enterocolitis[J]. J Clin Ped Sur, 2012, 11(4): 298-301. DOI:10.3969/j.issn.1671-6353.2012.04.020. |
| 6 |
Cetinkaya M, Ozkan H, Köksal N, et al. Comparison of the efficacy of serum amyloid A, C-reactive protein, and procalcitonin in the diagnosis and follow-up of necrotizing enterocolitis in premature infants[J]. J Pediatr surg, 2011, 46(8): 1482-1489. DOI:10.1016/j.jpedsurg.2011.03.069. |
| 7 |
Turner D, Hammerman C, Rudensky B, et al. Low levels of procalcitonin during episodes of necrotizing enterocolitis[J]. Dig Dis Sci, 2007, 52(11): 2972-2976. DOI:10.1007/s10620-007-9763-y. |
| 8 |
Lodha A, Howlett A, Ahmed T, et al. The Role of Interleukin-6 and Interleukin-8 Circulating Cytokines in Differentiating between Feeding Intolerance and Necrotizing Enterocolitis in Preterm Infants[J]. Am J Perinatol, 2017, 34(13): 1286-1292. DOI:10.1055/s-0037-1603329. |
| 9 |
许笑南, 何少茹, 郑曼利, 等. 新生儿坏死性小肠结肠炎各期危险因素差异分析[J]. 中华实用儿科临床杂志, 2013, 28(19): 1483-1486. DOI:10.3969/cma.j.issn.2095-428X.2013.19.013. Xu XN, He SR, Zheng ML, et al. Analysis of the difference of risk factors between each stage of necrotizing enterocolitis[J]. Chin J Appl Clin Pediatr, 2013, 28(19): 1483-1486. DOI:10.3969/cma.j.issn.2095-428X.2013.19.013. |
| 10 |
牟廷刚, 金先庆. 早产儿肠道因素对新生儿坏死性小肠结肠炎发病机制的影响[J]. 临床小儿外科杂志, 2011, 10(2): 142-144. DOI:10.3969/j.issn.1671-6353.2011.02.024. Geng TG, Jin XQ. Effect of intestinal factors in premature infants on the pathogenesis of neonatal necrotizing enterocolitis[J]. J Clin Ped Sur, 2011, 10(2): 142-144. DOI:10.3969/j.issn.1671-6353.2011.02.024. |
| 11 |
Terrin G, Stronati L, Cucchiara S, et al. Serum Markers of Necrotizing Enterocolitis:A Systematic Review[J]. J Pediatr Gastroenterol Nutr, 2017, 65(6): 120-132. DOI:10.1097/MPG.0000000000001588. |
| 12 |
Zhang H, Chen J, Wang Y, et al. Predictive factors and clinical practice profile for strictures post-necrotising enterocolitis[J]. Medicine, 2017, 96(10): 6273-6281. DOI:10.1097/MD.0000000000006273. |
| 13 |
Reisinger KW, Kramer BW, Van der Zee DC, et al. Non-invasive serum amyloid A (SAA) measurement and plasma platelets for accurate prediction of surgical intervention in severe necrotizing enterocolitis (NEC)[J]. PLoS One, 2014, 9(6): 90834-90840. DOI:10.1371/journal.pone.0090834. |
| 14 |
Liu Y, Qingjuan S, Gao Z, et al. Circulating fibrocytes are involved in inflammation and leukocyte trafficking in neonates with necrotizing enterocolitis[J]. Medicine, 2017, 96(26): 7400-7408. DOI:10.1097/MD.0000000000007400. |
| 15 |
Köksal N, Harmanci R, Cetinkaya M, et al. Role of procalcitonin and CRP in diagnosis and follow-up of neonatal sepsis[J]. Turk J Pediatr, 2007, 49(1): 21-29. |
| 16 |
Benkoe T, Baumann S, Weninger M, et al. Comprehensive evaluation of 11 cytokines in premature infants with surgical necrotizingenterocolitis[J]. PLoS One, 2013, 8(3): e58720. DOI:10.1371/journal.pone.0058720. |
| 17 |
Hackam DJ, Afrazi A, Good M, et al. Innate immune signaling in the pathogenesis of necrotizing enterocolitis[J]. Clin Dev Immunol, 2013, 54(32): 215-225. DOI:10.1155/2013/475415. |
| 18 |
Isaacs D, North J, Lindsell D, et al. Serum acute phase reactants innecrotizing enterocolitis[J]. Acta Paediatr Scand, 1987, 76(6): 923-927. DOI:10.1111/apa.1987.76.issue-6. |
| 19 |
Zangari A, Noviello C, Nobile S, et al. Surgical management of Necrotizing Enterocolitis in an Incredibly Low Birth Weight infant and review of the Literature[J]. Clin Ter, 2017, 168(5): 297-299. DOI:10.7417/T.2017.2024. |
| 20 |
Pourcyrous M, Korones SB, Yang W, et al. C-reactive protein in the diagnosis, management and prognosis of neonatal necrotizing enterocolitis[J]. Pediatrics, 2005, 116(5): 1064-1069. DOI:10.1542/peds.2004-1806. |
 2019, Vol. 18
2019, Vol. 18


