朗格汉斯组织细胞增生症(Langerhans cell histiocytosis, LCH)是朗格汉斯细胞在多种组织器官内病理性增生聚集引起的罕见疾病,可累及多系统,好发于颅骨,临床容易误诊、漏诊。患儿常因发现局部肿块而就诊于外科。在儿童诊疗过程中,超声检查具有经济、方便和无辐射的特征,从而成为外科医师的首选检查方法。本文旨在通过对2008年1月1日至2017年12月31日经病理证实的颅骨朗格汉斯组织细胞增生症患儿的超声图像进行分析,发现其超声图像特征,并与CT、MRI表现进行比较,为该病的诊断提供参考依据。
材料与方法 一、临床资料回顾性收集2008年1月1日至2017年12月31日由浙江大学附属儿童医院因发现局部肿块首诊于外科的颅骨朗格汉斯组织细胞增生症患儿19例,所有患儿经病理活检确诊,其中男童12例,女童7例;年龄8个月至9岁7个月,中位年龄30个月。16例为偶然发现局部肿块,3例为外伤后发现局部肿块。合并局部压痛4例,白细胞增高2例,发热1例,合并尿崩症1例。
二、研究方法患儿就诊时均先进行超声检查。超声检查仪器为GE公司LOGIQ 5和PHILIPS公司的IU22 ELITE。使用高频线阵探头。先进行二维灰阶显像,清晰显示局部软组织肿块和颅骨的连续性,随后使用彩色多普勒显示肿块内的血流信号。经超声怀疑为朗格汉斯组织细胞增生症后均行CT检查,其中4例行MRI检查。
结 果 一、病变部位19例患儿中15例为单发部位,4例为多发部位。超声发现颅骨病变25个部位。其中颞部12个,顶部7个,枕部5个,颊部1个。
二、超声表现颅骨膨胀性破坏,颅骨内外板分离,外板破坏显著,内板破坏较小,呈斜坡状(图 1)或阶梯形(图 2),破坏的骨质边缘锐利,形态不规则。3个部位可见残留骨片(图 3)。所有病变均同时伴有软组织低回声肿块,2例内见无回声区(图 4)。肿块大小:最大4.7cm×4.5 cm×3.6 cm,最小1.8 cm×1.6 cm×0.7 cm。肿块内可见较丰富的短棒状血流信号(图 5)。

|
Download:
|
| 图 1 朗格汉斯组织细胞增生症患儿颅骨破坏呈斜坡状 Fig. 1 Slope-like skull destruction | |
|
Download:
|
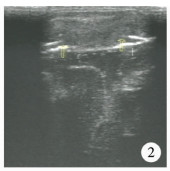
| 图 2 朗格汉斯组织细胞增生症颅骨破坏呈阶梯形,破坏的骨质边缘锐利,形态不规则 Fig. 2 Ladder-shaped skull destruction with sharp and irregular bone edges | |
|
Download:
|
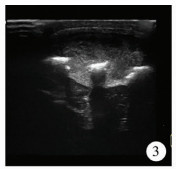
| 图 3 朗格汉斯组织细胞增生症超声显示残留骨片 Fig. 3 Ultrasound shows residual bone | |
|
Download:
|
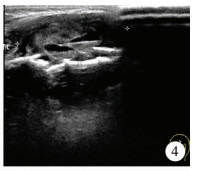
| 图 4 朗格汉斯组织细胞增生症超声显示软组织低回声肿块,内见无回声区 Fig. 4 Ultrasound showed soft tissue hypoechoic mass with echo-free zone | |
|
Download:
|
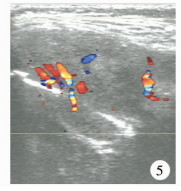
| 图 5 朗格汉斯组织细胞增生症超声显示低回声肿块内可见较丰富的血流信号 Fig. 5 CDFI showed abundant blood flow signal in a hypoechoic mass | |
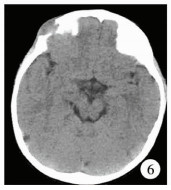
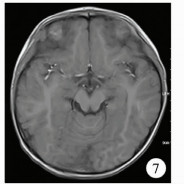
19例患儿均行CT检查,发现病灶25个。CT表现为肿瘤起源于颅骨板障并侵犯颅骨内外板(图 6),可见边界清楚的“梯形”骨质破坏区,病灶呈“葫芦状”软组织密度影,3个部位可见残留骨片。CT发现胸椎椎体病变1例。4例患儿进行MRI检查,肿瘤呈低-等信号(图 7)。
|
Download:
|
| 图 6 朗格汉斯组织细胞增生症CT显示颅骨破坏呈阶梯形,破坏的骨质边缘锐利,形态不规则 Fig. 6 CT showed ladder-shaped skull destruction with sharp and irregular bone edges | |
|
Download:
|
| 图 7 朗格汉斯组织细胞增生症MRI显示病变呈低-等信号 Fig. 7 MRI showed lesions with low-equal signals | |
朗格汉斯细胞组织细胞增生症指原因不明的单核巨噬细胞系统和树突状细胞系统增生的一组疾病,可累及全身各个系统,多见于1~4岁儿童[1]。由于儿童主诉不清等原因,临床上常以浅表肿块为首发症状而就诊于外科,而明确诊断也需外科进行活检。因此,对于外科医师来说,了解这一疾病并且选择合适的检查方法是很有必要的。
一、朗格汉斯组织细胞增生症病变部位由于朗格汉斯组织细胞增生症是多系统疾病,影响肝脏、脾脏以及造血功能旺盛的骨髓,因此骨骼也是好发部位之一,全身骨骼均可发病,以扁平骨多发,又以颅骨最为常见。由于朗格汉斯组织细胞的异常增生,引起骨骼的溶骨性骨质破坏,单发常见,也可多发。本研究中15例为单发肿块,4例为多发肿块;1例并发尿崩症,1例并发胸椎椎体病变,该结果与文献报道相符[2]。
二、朗格汉斯组织细胞增生症颅骨病变的超声表现朗格汉斯组织细胞增生症颅骨病变在超声上可显示颅骨的溶骨性骨质破坏,并且呈现为阶梯形或呈喇叭口样的图像特征,破坏的骨质边缘锐利,形态不规则,合并有软组织低回声肿块。本组中有3个部位显示内部有骨片残留,同时骨质的破坏合并有软组织的低回声伴或不伴无回声的肿块。由于朗格汉斯组织细胞增生症的颅骨破坏呈膨胀性破坏,颅骨内外板分离,以外板破坏显著,内板破坏较小, 骨质不均匀的溶骨性破坏导致内部还可有骨片残留[3]。而软组织肿块常常提示病变处于活跃增殖阶段, 因此超声图像中可见丰富的短棒状血流信号,并且可合并有局部疼痛。
本组中有1例位于颞部的软组织肿块内见大量无回声区,首次诊断误诊为淋巴水瘤伴出血。1例颞部肿块初诊时有明显的肿痛伴有发热,白细胞增高,首次诊断误诊为炎症性包块。经抗炎治疗1周后复查,症状及声像图均无明显变化。经回顾分析,发现这2例患儿的超声图像显示其深部的骨质呈典型阶梯形破坏。朗格汉斯组织细胞增生症颅骨病变的演变过程可能是:发病初期头皮表面局部隆起,硬而有轻压痛;病变蚀穿颅骨后肿块变软,触及有波动感,缺损边缘锐利;此后肿块渐被吸收,局部下陷。就诊时,患儿表现为局部肿块,超声图像可表现为低回声或者无回声肿块[4]。可见,在不同的阶段,软组织肿块可有不同的回声。
三、不同影像学检查对朗格罕斯组织细胞增生症的诊断价值一直以来,国内外均以CT作为朗格汉斯组织细胞增生症的骨损害的首选诊断方法,但有时也进行MRI检查。CT能清楚显示受累骨界限,发现更多病灶,如结构复杂的颅底区以及椎骨病变[5]。本组中发现1例椎骨损害的患儿。MRI能清楚显示颅骨骨质破坏、软组织肿块、硬脑膜增厚等形态变化[6]。然而,CT的局限性在于其放射性和对软组织的显示有限。MRI可以清晰显示软组织,但是由于其昂贵的价格限制了其应用。
虽然超声在骨科的应用存在局限性,然而正是由于骨平面的强回声,反而更能清晰地显示骨质的回声中断和缺损。有文献报道,对于颅骨朗格汉斯组织细胞增生症,超声在诊断和随访中能发挥重大作用[7]。本研究发现:由于朗格汉斯组织细胞增生症的骨质破坏呈膨胀性和溶骨性特征,在超声检查时可表现出特征性的图像。超声对局部的软组织肿块的回声和血流信号的显示对于诊断也有很大帮助。同时,超声可以同时对腹部实质性脏器如对肝脏、脾脏的影响进行进一步评价。另外,超声还可以发现腹部及后腹膜的肿瘤,以进行转移性颅骨肿瘤的鉴别。
四、朗格汉斯组织细胞增生症鉴别诊断由于朗格汉斯组织细胞增生症的颅骨病变合并的软组织肿块为低回声,内可见无回声,并且可以合并疼痛、丰富血流信号,因此要与淋巴水瘤伴出血、炎性病变以及局部血肿进行鉴别。只要在检查时仔细扫查,注意观察深部骨质是否完整,并且注意破坏的骨质的边缘形态,结合病史,即可鉴别。
婴幼儿肌纤维瘤病是一种少见的以良性肌纤维母细胞瘤样变为特征的间质性肿瘤,被认为是婴儿期最常见的纤维性肿瘤类型。好发于头颈部[8]。虽为良性病变,但有浸润性生长的特点,当侵犯骨组织时可造成病理性骨折或溶骨性病变。在影像学上也表现为骨质的破坏合并软组织肿块。但是这种骨质破坏为从外向内的浸润性破坏,与朗格汉斯组织细胞增生症的骨质破坏呈膨胀性不同。
神经母细胞瘤属于现阶段儿童比较常见的肿瘤之一,且肿瘤的恶性程度相对较高,在患病早期就会发生颅骨转移。部分儿童神经母细胞瘤患儿主要是以头痛以及眶周肿块等转移性肿瘤的症状为首发症状,进而来医院就诊的。病变显示颅眶骨的骨质破坏并且伴有周围软组织出现肿块,患儿多发病变主要以双侧的颅眶骨交界处为著。对于神经母细胞瘤颅骨转移的患儿,CT和MRI的诊断作用明确,但是超声的图像特征及对这一疾病的诊断作用尚未见报道,还有待于进一步研究[9, 10]。
本文通过对颅骨朗格汉斯组织细胞增生症的超声图像分析,发现其具有典型的声像图特征。对以头面部肿块就诊的患儿,超声检查可以明确肿块部位、深度以及颅骨的完整性。由于超声具有无放射性、经济、方便的特点,可以把超声作为小儿头面部肿块首选的检查方法,并且可以根据超声检查结果选择进一步的检查方法。同时,对于超声医生来说,对进行超声检查的所有因浅表肿块就诊的患儿,都应该仔细进行肿块的血流信号和深部骨质回声延续性的探查,以免造成漏诊和误诊。
| 1 |
Bakry OA, Samaka RM, Kandil MA, et al. Indeterminate cell histiocytosis with naive cells[J]. Rare Tumors, 2013, 5(1): e13. DOI:10.4081/rt.2013.e13. |
| 2 |
Shinsaku I, Naoko K, Akinobu M, et al. Langerhans cell histiocytosis with multifocal bone lesions:comparative clinical features between single and multi-systems[J]. Int J Hematol, 2009, 90(14): 506-512. DOI:10.1007/s12185-009-0420-4. |
| 3 |
Wang HX, Nie P, Dong C, et al. Computed tomography and magnetic resonance imaging features of solitary Langerhans cell histiocytosis in calvaria[J]. Int J Clin Exp Med, 2017, 2(10): 3139-3146. |
| 4 |
张斯佳, 皇甫幼田, 弓莉. 颅骨郎格罕斯细胞组织细胞增生症的CT和MRI诊断[J]. 临床放射学杂志, 2010, 29(3): 320-322. DOI:10.13437/j.cnki.jcr.2010.03.013. Zhang SJ, Huangfu YT, Gong Li. CT and MRI diagnosis of Langerhans' cell histocytosis in skull[J]. J Clin Radiol, 2010, 29(3): 320-322. DOI:10.13437/j.cnki.jcr.2010.03.013. |
| 5 |
Zhang LH, Jiang L, Yuan HS, et al. Atlantoaxial Langerhans cell histiocytosis radiographic characteristics and corresponding prognosis analysis[J]. J Craniovert Jun Spine, 2017, 8(3): 199-204. DOI:10.4103/jcvjs.JCVJS_21_16. |
| 6 |
Lan ZG, Richard SA, Lei CF, et al. Thoracolumbar Langerhans cell histiocytosis in a toddler[J]. JPS Case Reprots, 2018, 28(1): 62-67. DOI:10.1016/j.epsc.2017.09.024. |
| 7 |
Wojciech K, Maceij P, Dominik S, et al. Sonographic diagnosis and monitoring of localized Langerhans cell histiocytosis of the skull[J]. J Clic Ultrasound, 2013, 41(3): 134-139. DOI:10.1002/jcu.21988. |
| 8 |
葛莉, 冀园琦, 齐翔, 等. 婴幼儿肌纤维瘤病复发1例[J]. 临床小儿外科杂志, 2007, 6(4): 78. DOI:10.3969/j.issn.1671-6353.2007.04.035. Ge L, Ji YQ, Qi X, et al. Reucrrence of myofibromatosis in infants and toddlers[J]. J Clin Ped Sur, 2007, 6(4): 78. DOI:10.3969/j.issn.1671-6353.2007.04.035. |
| 9 |
陈利军, 陈士新, 赵志友, 等. 儿童颅面骨转移性神经母细胞瘤的CT和MRI诊断[J]. 临床放射学杂志, 2013, 32(3): 399-402. DOI:10.13437/j.cnki.jcr.2013.03.030. Chen LJ, Chen SX, Zhao ZY, et al. CT and MRI diagnosis of craniofacial bone metastases of neuroblastoma in children[J]. J Clin Radiol, 2013, 32(3): 399-402. DOI:10.13437/j.cnki.jcr.2013.03.030. |
| 10 |
杜艳生. 儿童神经母细胞瘤颅面骨转移的CT与磁共振成像表现分析[J]. 实用医学影像杂志, 2016, 17(5): 450-451. DOI:10.16106/j.cnki.enl4-1281/r.2016.05.031. Du YS. CT and MRI manifestations of craniofacial bone metastases of neuroblastoma in children[J]. JPMI, 2016, 17(5): 450-451. DOI:10.16106/j.cnki.enl4-1281/r.2016.05.031. |
 2019, Vol. 18
2019, Vol. 18


