新生儿舌部畸胎瘤是一类围产期先天性肿瘤,源于胚胎的生殖细胞层。由于该病通常在出生后才被发现,因此围产期病死率较高。随着产前诊断技术的发展,对畸胎瘤的管理重点时段已经从出生后转移至产前。本文对武汉市妇女儿童医疗保健中心新生儿外科收治的2例新生儿舌部畸胎瘤病例资料进行分析,并结合近年国内外文献探讨其临床特点,旨在提高诊断质量,改善患儿预后。
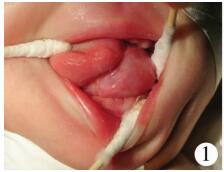
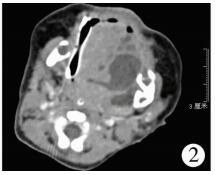
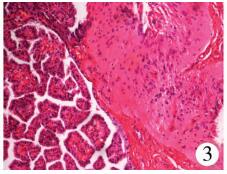
病例1:患儿,女,20 d龄,3.05 kg,因“阵发性咳嗽、鼻塞5 d,呼吸困难加重2 d”入院,系第1胎第1产,足月剖宫产;母孕期情况良好,产前超声检查未见异常,否认窒息难产史,生后即发现左侧舌下有一包块,但不影响进食,因此未及时就诊。入院查体:神志清楚,哭闹时面色发绀,张口呼吸,有鼻翼扇动,左侧舌下可见约4 cm×4 cm×3 cm大小的囊性包块,随舌运动部分移出口外,舌体被推移偏向右侧口角(图 1)。甲胎蛋白59.99 IU/mL(正常值<63.910 IU/mL),口咽部增强CT诊断为口咽部舌左下方混杂密度肿块影,考虑畸胎瘤(图 2)。在全身麻醉鼻气管插管下,经舌左旁侧入路行舌下瘤体切除术。术中见瘤体位于左侧舌根部,灰白色,类圆形,为大小不一多房囊性包块;囊壁稍厚,有包膜,与舌根部肌组织粘连紧密,界限不清,囊肿近口咽处浸润较深,与舌下神经及血管粘连;内含白色乳汁样粘稠液体约3 mL。顺瘤体边缘分离,对浸润舌根较深处瘤体采取分块切除,改善视野后再逐步分离,最终完整切除瘤体。术后10 d患儿自行吃奶可,舌部偏斜改善,发音、呼吸、进食均正常,术后病理检查:切面呈灰白色,囊实性。镜下见实性区域主要由弥漫的分化良好神经胶质细胞及脂肪组织组成。囊性区域部分内衬单层柱状上皮,呈乳头状;部分内衬单层及假复层纤毛柱状上皮(图 3、图 4);局部可见皮肤及附属器成分,未见未成熟的胚胎组织和神经管成分。免疫组化神经组织蛋白质S100(S-100)阳性。病理诊断:成熟性囊性畸胎瘤。门诊随访6个月无复发(图 5)。
|
Download:
|
| 图 1 图为1例舌部畸胎瘤新生儿,可见左侧舌下囊实性包块,舌体被推移偏向右侧 Fig. 1 1 case of neonatal tongue teratoma, visible left sublingual capsule solid mass, tongue is deflected to the right side | |
|
Download:
|
| 图 2 增强CT显示多房囊性团块状混杂密度肿块影,深达舌根部 Fig. 2 Enhanced CT showed multi-atrial cystic mass-like dense density mass shadow, deep tongue root | |
|
Download:
|
| 图 3 病理切片图:左侧:囊壁内衬单层柱状上皮,呈乳头状排列;右侧弥漫的分化良好的神经胶质细胞(苏木精-伊红染色, ×100) Fig. 3 Pathological section:, Left side:the wall of the capsule is lined with a single columnar epithelium, arranged in a papillary shape; diffuse well-differentiated glial cells on the right side (hematoxylin-eosin, ×100) | |

|
Download:
|
| 图 4 病理切片图:囊壁内衬单层及假复层纤毛柱状上皮(苏木精-伊红染色, ×400) Fig. 4 Pathological section Figure:The lining of the wall and the pseudo-stratified ciliated columnar epithelium (hematoxylin-eosin, ×400) | |

|
Download:
|
| 图 5 舌部畸胎瘤新生儿术后六月复查照片 Fig. 5 The retrospective photo of the newborn after surgery for the teratoma of the tongue | |
病例2:女,出生后6 h入院。因出生后发现一暗红色肿物突出于口腔外,呼吸及喂养困难就诊。系第2胎第2产,足月顺产,头胎正常,出生体重2.8 kg。生后有窒息,Aparg评分7分。体检:发育正常,神志清楚,呼吸困难,口唇微绀,自口腔内突出一囊性肿物,表面光滑,基底位于舌背左侧,约3.3 cm×3 cm×1.5 cm大小,充盈口腔,部分突出于口外,可随舌体运动而移出。产前超声诊断为足月妊娠、胎儿口内囊肿。口咽部CT提示:舌体部可见多房囊性低密度影,肿块内见小片状高密度影,增强扫描囊性内容物未见强化。诊断为舌部肿物。于全身麻醉气管插管下行舌部肿物切除术,术中见肿物囊实性,基底位于舌体左侧,与舌部肌层紧密相连,边界不清。自肿物边缘作切口,游离边缘,于肿物基底部完整摘除。患儿恢复顺利,术后第7天痊愈出院。肿物病理检查结果:舌部成熟性畸胎瘤,成分包括鳞状上皮、脂肪、角化物、腺管等,考虑为畸胎瘤。随访1年未见复发。
讨 论新生儿畸胎瘤是一组来源于多胚层组织的异位先天性肿瘤,多见于躯体中线及其两旁,好发于骶尾部、纵隔、腹膜后以及卵巢、睾丸等部位。新生儿中发病率为0.25/10 000~0.5/10 000[1]。可累及面部、咽部、鼻部、眼眶、硬腭、颈部等,口咽部畸胎瘤发生率约占畸胎瘤总数的2%,占所有儿童口腔颌面部肿瘤的2.4%[2]。代礼等[3]收集了国内新生儿畸胎瘤238例,以单发形式多见,占83.2%,其中16.8%合并其他畸形,产前诊断率为26.9%。文献综述表明, 儿童头颈部畸胎瘤的发生率男女比例均等[2]。按畸胎瘤的组成及组织成熟与否将畸胎瘤分为:良性畸胎瘤、含未成熟(胚胎性)组织的混合性畸胎瘤、恶性畸胎瘤。良性及混合性畸胎瘤有恶性倾向,恶性率随年龄呈上升趋势。
新生儿舌部畸胎瘤临床多表现为喂养困难或呼吸窘迫,症状严重程度取决于瘤体大小及病变部位。喂养困难是其首要表现,Subraj[4]收集文献报道的20例新生儿舌部畸胎瘤,其中喂养困难15例(75%),呼吸困难只有7例(35%),这可能是因为新生儿通过鼻呼吸改善了呼吸窘迫。若瘤体巨大,部位深,位于舌后部,亦容易压迫气道引起呼吸道梗阻。本组病例1瘤体位于舌根部,出生后喂养困难不明显,但呼吸困难逐渐加重,入院时已继发新生儿感染性肺炎,最终需上呼吸机辅助通气。病例2瘤体位于舌体背侧,呼吸困难并不明显,但影响进食而生后较早就诊。若肿瘤较小且生长缓慢,常因无自觉症状而延误诊治。瘤体可位于口腔黏膜下,不带蒂突出于病变部位,随舌部活动而移动改变,穿刺囊肿有时可抽出淡黄色液体而缓解临床症状。
新生儿出生时舌部畸胎瘤压迫气道,导致出生后窒息和脑损伤甚至死亡,因此产前诊断非常重要。于胎儿期超声检查发现并诊断舌部肿物者可见报道[5]。例2产前超声发现胎儿口内囊肿,我们体会到若瘤体较大突出于口外,超声检查易于发现,若瘤体部位较深(如例1位于舌根部),产前超声就未能发现。产前超声检查是发现胎儿舌部畸胎瘤必要而可靠的方法,三维彩超可以明确肿瘤与口腔空间之间的相关性,Chiang等[6]运用三维超声检查诊断出1例在怀孕第30周时的舌部畸胎瘤,Gull[7]等报道运用超声可发现早至孕期15周左右的口腔内畸胎瘤。先天性头颈部畸胎瘤患者多存在羊水过多,尤其在巨大的颈部和鼻咽部畸胎瘤患儿中产前发现羊水过多更为常见。我们推测,这些患儿可能是由于肿瘤压迫阻塞咽及食管,阻止了胎儿吞咽所致。MRI技术在产前诊断中的应用越来越多,MRI能准确诊断胎儿解剖学畸形,明确肿瘤大小、具体部位,了解肿块与气管、食管之间的解剖关系,为评估胎儿分娩风险、早期精心策划手术方案、判断预后提供必要的依据[8]。产前检测羊水甲胎蛋白水平有利于识别舌部畸胎瘤,但采用这一辅助检查的情况较少,目前产前诊断的主要手段仍然是B超。舌部畸胎瘤应与舌淋巴管瘤、血管瘤、异位甲状腺,唾液腺瘤、舌下囊肿等鉴别,术前进行口咽部CT检查有助于鉴别诊断和确定肿瘤范围,明确肿瘤与周围神经血管的关系,有利于制定周密的治疗方案。当CT检查发现厚壁囊肿,其内密度不均、结构混杂,特别是囊肿内伴有脂肪、钙化,增强扫描软组织呈轻至中度强化,可做出初步诊断,最终诊断仍需依靠病理组织学检查。
产前诊断出口咽部肿瘤的胎儿首选剖宫产术分娩。因为肿瘤可以引起严重气道阻塞,出生后可立即经口或鼻气管插管,甚至行气管切开术,改善患儿通气。有时口咽部巨大畸胎瘤可引起完全的气道阻塞,胎儿在宫内胎盘循环下氧合状态不受影响,分娩时脐带结扎可能是致命性的。分娩时子宫外产时处理(ex-utero intrapartum treatment,EXIT)能够延长胎盘循环时间,从而给临床医生充足的时间确保气道开放,挽救患儿生命[9, 10]。应用EXIT在剖宫产的同时行肿瘤切除术似乎是可行的,尽管EXIT下胎盘循环维持时间可能不足60 min[11],患儿生存率虽然可能不高于30% ~40%[11, 12]。但EXIT下切除口咽部肿瘤仍然有着巨大的潜在价值,值得为此付出更多的努力。Said等[13]报道应用EXIT成功救治了一例产前诊断有舌部巨大畸胎瘤的胎儿。Kontopoulos等[12]报道应用胎儿镜在宫内成功切除胎儿鼻咽部畸胎瘤。围产期有效的干预和及时手术改善了患儿预后,提高了生存率。
新生儿舌部畸胎瘤虽然多数为良性,但随着年龄的增长,恶性程度会逐步增高,因此一旦确诊,需尽早手术切除[2]。手术的目的是彻底清除瘤体组织,改善吮吸困难及气道梗阻。在例1中,舌根部瘤体暴露困难,手术采用经鼻腔插管麻醉;瘤体较大、部位深,与舌下神经、血管粘连紧密,手术采用舌旁侧进路,有利于控制手术出血量和肿瘤的完整切除;同时术中尽量避免损伤舌下神经,防止术后舌体萎缩和运动功能受限等后遗症发生。例2瘤体位于舌体背侧,与舌部肌层有浸润,采取从肿物基底部完整摘除的手术方式。当瘤体与周围组织有浸润、穿破难以完整切除时,可先行分块切除,改善视野后再尽可能完整清除瘤体组织,防止术后复发,残留的肿瘤组织复发有恶变的可能。值得注意的是术中术后需保持呼吸道通畅,术后伤口渗血、舌部肿胀等易造成呼吸道梗阻,需紧急处理。术后结合甲胎蛋白值变化判断预后,如急速下降恢复至正常,说明病变切除彻底;若术后甲胎蛋白值继续上升或下降之后又升高,预示肿瘤出现复发或转移。本组2例依据组织分化程度,均属于成熟型畸胎瘤,术后复查甲胎蛋白值正常,尽管完整切除瘤体,但术后仍需密切随访。
通过对2例病例的分析及相关文献复习发现,新生儿舌部畸胎瘤虽然罕见,但通常多为成熟性良性肿瘤,建议早期手术干预,尤其是对有气道阻塞的畸胎瘤。胎儿期三维超声和MRI可提高产前诊断的准确性,分娩时剖宫产、多学科协作及EXIT可提高胎儿出生后的生存机会,改善患儿预后。
| 1 |
Bergè SJ, von Lindern JJ, Appel T, et al. Diagnosis and management of cervical teratomas[J]. Br J OralMaxillofac Surg, 2004, 42(1): 41-45. DOI:10.1016/S0266-4356(03)00174-8. |
| 2 |
Mustafa Celik, Hampar Akkaya, Irfan Serdar Arda, et al. Congenital teratoma of the tongue:a case report and review of the literature[J]. Journal of Pediatric Surgery, 2006, 41(1): E25-E28. DOI:10.1016/jpedsurg.2006.08.039. |
| 3 |
代礼, 吴艳乔, 朱军, 等. 中国围产儿畸胎瘤的流行病学特征[J]. 华西医大学报, 2002, 33(1): 111-114. DOI:10.3969/j.issn.1672-173X.2002.01.033. Dai L, Wu YQ, Zhu J, et al. An Epidemiological Investigation of Perinatal Teratomas in China[J]. Journal of West China University of Medical Sciences, 2002, 33(1): 111-114. DOI:10.3969/j.issn.1672-173X.2002.01.033. |
| 4 |
Subraj j, Shetty, Shivani Bansal, Sandip R.Kulkarni, et al. Benign Teratoma of the Tongue in a Neonate:A Case Report and Review of the literature[J]. Pediatric dentistry, 2009, 32(3): 245-249. |
| 5 |
展新风, 刘韶平, 程琳, 等. 胎儿舌底畸胎样囊肿超声表现1例[J]. 中华超声影像学杂志, 2006, 15(4): 306. DOI:10.3760/j.issn:1004-4477.2006.04.029. Zhan XF, Liu SP, Chen L, et al. Preliminary study on the indications and effectiveness of laparoscopic treatment of neonatal sputum[J]. Chinese Journal of Ultrasonography, 2006, 15(4): 306. DOI:10.3760/j.issn:1004-4477.2006.04.029. |
| 6 |
Chiang Y.C., Shih J.C., Peng S.S.S., et al. Tongue teratoma-a rare form of fetal extragonadal teratoma diagnosed at 30 weeks' gestation[J]. Ultrasound Obstet Gynecol, 2006, 28(7): 735-741. DOI:10.1002/uog.3824. |
| 7 |
Gull I. Antenatal sonographic diagnosis of epignathus at 15 weeks gestation[J]. Ultrasound Obstet Gynecol, 1999, 13(3): 271-273. DOI:10.1046/j.1469-0705.1999.13040271.x. |
| 8 |
Gabriele Tonni C., De Felice, Centini G., et al. Cervical and oral teratoma in the fetus:a systematic review of etiology, pathology, diagnosis, treatment and prognosis[J]. Arch Gynecol Obstet, 2010, 282(4): 355-361. DOI:10.1007/s00404-010-1500-7. |
| 9 |
Ducloy-Bouthors AS, Marciniak B, Vaast P, et al. Maternal and fetal anaesthesia for ex utero intrapartum treatment (EXIT)procedure (French)[J]. Annales Francaises D'anesthe'sie et de Re'animation, 2006, 25(7): 638-643. DOI:10.1016/j.annfar.2006.02.023. |
| 10 |
Marwan A, Crombleholme TM. The EXIT procedure:Principles, pitfalls and progress[J]. Seminar Pediatric Surgery, 2006, 15(2): 107-115. DOI:10.1053/j.sempedsurg.2006.02.008. |
| 11 |
Cardesa-Salzman TM, Mora-Graupera J, Claret G. Congenital cervical neuroblastoma[J]. Pediatr Blood Cancer, 2004, 43(8): 785-787. DOI:10.1002/pbc.20190. |
| 12 |
Eftichia V.Kontopoulos, Marc Gualtieri, Rubén A. Successful in utero treatment of an oral teratoma via operative fetoscopy:case report and review of the literature[J]. American Journal of Obstetrics & Gynecology, 2012, 7(1): e12-e13. DOI:10.1016/j.ajog.2012.04.008. |
| 13 |
Said S., Breathanch F., Fleming A., et al. Prenatal diagnosis of massive fetal tongue teratoma followed by successful, ex-utero intra-partum treatment[J]. J Obstet Gynaecol, 2009, 29(1): 55-57. DOI:10.1080/01443610802484328. |
 2019, Vol. 18
2019, Vol. 18


