DSD(disorders of sex development,DSD)是指因染色体、性腺、性别解剖结构和性心理等诸多方面发育异常而导致的一种先天性异常。根据2006年芝加哥会议共识,按照染色体核型可将DSD分为性染色体DSD(主要与性染色体核型异常有关)、46,XY DSD(主要与睾丸分化发育异常及雄激素合成、利用障碍有关)和46,XX DSD(与SRY基因易位、雄激素过量有关)三大类[1, 2]。不同病因和类别的DSD可有相同或相似的临床表型,但如果病因相同,由于发生时间或影响程度不同所致的临床表型差异则非常大。因此,如何明确诊断并合理治疗DSD仍无统一标准,而错误的临床干预将直接影响患儿的治疗策略及其预后。DSD患儿治疗的关键是确定患儿的抚养性别,并最大限度地取得相应的功能和外观(功能应比外观更重要)[3]。十多年前,由于DSD患儿的诊治涉及外生殖器矫形,往往需要由小儿泌尿外科医师接手,故一度将外生殖器表型及手术矫形的难易作为决定抚养性别的关键[4]。但临床上也出现过不少已确定的外生殖器和内生殖器不相符的情况,或者从影像上及内分泌检查上无法确定内生殖器状况,这给医者造成了一定的困惑。因此对部分DSD患儿进行性腺探查及病理活检是明确DSD患儿内生殖器情况的重要方法,也是其后期治疗和性别分配的基础。本文将回顾性分析DSD患儿的性腺病理学结果,总结DSD患儿的性腺病理学特征,并初步分析其临床意义。
材料与方法 一、研究对象回顾性分析2010年8月至2018年1月间106例在浙江大学医学院附属儿童医院就诊的DSD患儿资料。纳入标准: ①参照芝加哥共识诊断为DSD者;②临床资料中含有性腺病理结果者。排除标准:①术前诊断已明确者;②未行性腺病理学检查的DSD者;③失访者。
二、研究方法入组患儿根据染色体结果分为性染色体DSD、46,XX DSD、46,XY DSD共3组。收集各组患儿的一般资料,包括:染色体、双侧性腺是否可及,外生殖器雄性化评分(external masculinization score,EMS),性腺探查或活检结果。随访时间至少为1年。
三、统计学方法采用SPSS22.0进行统计学分析,由于EMS等计量资料多呈偏态分布,因此用M(P25,P75)进行统计描述,组间比较采用独立样本秩和检验不同DSD中病理类型分布比例的对比采用Fisher精确概率法。以P<0.05为差异有统计学意义。
结 果本研究共收集到164例DSD患儿,其中性染色体DSD 29例;46,XX DSD 43例;46,XY DSD 92例。39例因临床资料不全或基因诊断已明确病因而未行病理检查;2例因探查过程中未找到疑似性腺样组织,未获得病理结果;17例因失访而未入组。最终获得病理学结果(活检+切除)的患儿共106例,接受腹腔镜手术者93例,接受开放手术者13例。就诊年龄3 d至18岁,中位年龄5.5岁。随访时间至少1年以上。性染色体DSD组21例中卵睾型DSD 10例(图 1、图 2),原始性腺7例,发育不良卵巢1例,发育不良睾丸3例(图 3)。46,XX DSD组25例中卵睾型DSD 11例,原始性腺3例,发育不良卵巢9例,发育不良睾丸2例。46,XY DSD组60例中卵睾DSD 2例,有原始性腺7例,发育不良卵巢5例,发育不良睾丸44例,性腺母细胞瘤2例(图 4、图 5)。两例肿瘤患儿的年龄分别为6岁和12岁。在部分卵睾切片中可发现具有双向分化功能的性母细胞(图 6)。DSD患儿的EMS评分结果见表 1,DSD患儿的病理结果分布见表 2。
|
|
表 1 3组DSD患儿的EMS评分 Table 1 EMS score of DSD children a mong 3 groups |
|
|
表 2 3组DSD患儿的病理结果分布[n(%)] Table 2 Distribution of pathological results in DSD children a mong 3 groups[n(%)] |
|
Download:
|
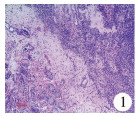
| 图 1 卵睾病理切片:基质两侧可见两种不同的性腺结构,原始卵巢组织和睾丸曲细精管(×50) Fig. 1 Ovotestis:Two different gonadal structures were present at both sides of stroma, original ovarian tissue and seminiferous tubules of testis.(×50) | |
|
Download:
|
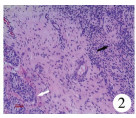
| 图 2 卵睾病理切片:白色箭头所指处为睾丸曲细精管,黑色箭头所指处为原始卵巢组织(×100) Fig. 2 Ovotestis:White arrow indicated seminiferous tubule of testis while black arrow denoted original ovarian tissue.(×100) | |

|
Download:
|
| 图 3 睾丸发育不良病理切片:纤维组织内见少量精曲小管(×50) Fig. 3 Dysplastic testis:few seminiferous tubules of testis were seen in fibrous tissue.(×50) | |
|
Download:
|
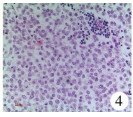
| 图 4 性腺母细胞瘤病理切片:可见大量弥漫分布的细胞较大、胞浆透亮的性腺母细胞瘤细胞(×200) Fig. 4 Gonoblastoma:a condensed mass of diffuse, large, cytoplasmic clear gonoblastoma cells.(×200) | |
|
Download:
|
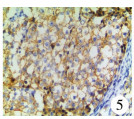
| 图 5 性腺母细胞瘤病理切片:可见性腺母细胞瘤CD117组化染色细胞膜阳性(×200) Fig. 5 Gonadoblastoma:histochemical staining (CD117) of positive cell membrane in gonadoblastoma.(×200) | |
|
Download:
|
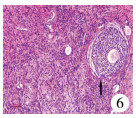
| 图 6 性母细胞病理切片:箭头指示为具有双向分化功能的性母细胞(×100) Fig. 6 Gonial cell:arrow indicated gonial cell with bidirectional differentiation.(×100) | |
目前,人类性别发育过程可大致划分为性别确定和性别分化两个独立但连续的步骤,其中性别确定是指一系列与性别选择相关的基因表达已经发生,但分化暂未出现,且性腺具有双向分化潜能,可向睾丸或卵巢发展。性别分化则是指一旦睾丸或卵巢已经形成,其分泌的激素将促使机体的性别分化,睾丸分泌的激素对于男性内外生殖器的发育是必需的[5]。正常性腺分化发育主要取决于3个方面功能是否正常[6]:①性染色体(XY和XX);②宫内调节性器官分化发育的相关因子;③下丘脑-垂体-性腺轴功能。其中涉及性别导向决定的调控及其性腺分化发育的一系列级联程序是涉及多种相关基因参与的复杂过程,已经明确的基因超过200个[7]。任何环节发生异常均可导致性腺及性器官出现异常发育分化,继而形成DSD。诊治过程中需要对每一个DSD患儿进行个体化评估,需要综合考虑的因素包括:病史、家族史、体检结果、EMS评分[8]、染色体检查结果及相应的内分泌、基因检查结果等。本研究显示DSD患儿染色体核型与性腺病理结果并无明显的对应关系,这提示DSD患儿的个体化评估需要结合临床上多种诊断途径。
以往,DSD患儿往往由小儿泌尿外科医生接手并制定后续的治疗方案,因此外生殖器的表型及手术矫形的难易曾一度被认为是性别分配决定的关键[4]。但后来认识到DSD患儿的外生殖器表型可能与大脑性别不一致,成年后可能因性焦虑而需要接受再次性别分配,通过再次手术修改表型。性腺组织病理曾被认为是确定抚养性别的主要依据[9],近年来,随着遗传分子生物技术的提高(尤其是染色体微阵列和高通量基因测序技术的应用),DSD的许多病因能快速准确地被检测出,改变了以往许多DSD只能通过临床表现和激素水平变化来推测病因的局面,因此性染色体及相关基因检测作为一线评估方案,在抚养性别确定的过程中重要性越来越高[10]。目前,46,XX DSD患儿可通过内分泌检查和基因检测明确先天性肾上腺皮质增生(CAH)的诊断,某些医疗机构甚至在新生儿期就可以将这部分患儿筛查出来,使其尽早接受治疗。在46,XY DSD患儿中,雄激素受体缺陷引起的CAIS、PAIS、5α还原酶缺乏DSD、17β羟类固醇脱氢酶缺乏DSD等也可以通过内分泌检查及基因检测获得明确诊断。也有内分泌医师认为可以通过激素激发试验和基因检测明确内生殖器状况,从而代替性腺活检,避免不必要的手术。笔者认为,对于内分泌检查和基因检测结果明确的部分DSD患儿(如CAH、CAIS、5α还原酶缺乏DSD等)可进行腹腔镜检查或腹股沟探查,性腺符合预期的可以不进行活检。激素激发试验未必能明确内生殖器状况,因为性腺如果为卵睾则无法通过激发试验判断,此时如果性腺发育不良也可能存在假阴性结果。由于不同地区各单位能进行的各种激素水平检测及基因分子诊断常有较大差异,因此目前来看,进行性腺活检从而获得确切的病理诊断对相应的性别分配仍具有重要的决定作用[3]。
卵睾体的存在是性腺畸形中较为常见的类型,它包括3种形式[11, 12]:①双侧型(即两侧均为卵睾),约占30%;②单侧型(即一侧为卵睾,另一侧为睾丸或卵巢),约占50%;③片侧型(即一侧为睾丸,另一侧为卵巢),约占20%。本研究中性染色体DSD、46,XX DSD、46,XY DSD三组患儿中发现卵睾体的比例分别是47.6%、44%、3.3%。而性腺的病理检查是发现卵睾体的金标准,典型的切片中可发现同一性腺中同时含有睾丸和卵巢组织,一般两种组织间存在明显分界(图 2)。虽然有的学者[13]认为此类患者多遵循卵巢多在左侧、睾丸或卵睾多在右侧的规律,但存在卵睾体的处理要根据患儿的性别分配来决定,涉及相应的性腺保留或切除,任何没有病理依据的处理都存在一定的风险。有学者认为腹腔内卵睾体的睾丸部分往往发育不良,存在较大的恶变风险,建议均应全部切除[14]。但也有学者持不同意见,认为目前缺乏足够的证据支持在儿童期或者青少年期进行卵睾性腺切除[15]。
本研究中仅发现2例患儿的病理结果为性腺母细胞瘤(图 4、图 5),且这2例患儿均没有明显的肿瘤临床症状,均于切除发育不良的性腺后发现。此外,这2例患儿年龄分别为6岁和12岁,提示即使在青春发育期前也可发生性腺恶性肿瘤。众所周知,性腺在胚胎期具有双向分化潜能,可向卵巢、睾丸分化(图 6)。性腺发育不全(gonadal dysgenesis)[16]是指由于性腺脊中的生殖细胞迁移受阻和(或)大量生殖细胞机化而导致性腺分化不全,这是发生性腺恶性肿瘤的基础。形态学上包含渐进不断发育分化的广泛谱系性腺表型:从性腺不发育、未分化性腺组织到经典条索状性腺的出现。目前,对于性腺发育不全尚缺乏统一的命名和分类,根据性发育异常患者的性腺活检形态学基本病变特征分为以下几种: ①性腺不发育(true agonadism)。②未分化性腺组织(undifferentiated gonadal tissue)。③条索状性腺(streak gonad)。④条索状性腺伴上皮索样结构(streak gonad with epithelial cord-like structures)。⑤发育不良睾丸(dysgenetic testis):体积较小,常为隐睾患者性腺。发育不良睾丸表面白膜胶原化不明显,生精小管密集排列在睾丸的中央区[16]。性腺发育不全尤其是未分化性腺易发展为性腺母细胞瘤[17]。据统计,发育不良的性腺发展为肿瘤的风险为15% ~30%[18],最常见的是性腺母细胞瘤[19]。因此,对于临床上相对多见的条索状性腺,目前比较一致的观点是建议性腺肿瘤的高危患儿在幼年期将其切除[3];而对于CAIS和PAIS性别分配为女性的患儿,为防止发生恶变,目前的主流观点是等到青少年时期再切除[8]。
DSD患儿的外科干预主要应用在两方面:性腺探查及重建手术。性腺探查及病理活检是明确性发育障碍患儿内生殖器情况的两个重要方法,而腹腔镜手术是目前最常用的探查方法。依据术前的诊断和评估,术中应仔细寻找异常性腺可能藏匿的位置。如果术前考虑为睾丸,则应重点寻找腹股沟管内口处,尝试牵拉通入其内的韧带,往往能够成功。如果考虑为条索状性腺,则仔细寻找纤细的输卵管和发育不全的始基子宫,与输卵管平行相伴的鱼白色细条索很可能就是异常的性腺[20]。准确认识性腺病理将为将来的重建手术打下良好的基础。同时,有关DSD患儿任何的医学决定都需要家属的参与。医生需要在取得病理结果的基础上告知家属医学选择,家属需根据自身家庭、社会及宗教文化背景做出慎重的决定[4]。本研究中有2例病理结果为卵睾的患儿未确定抚养性别,目前仍在等待家属的决定。
总体来说,儿童时期发生性腺肿瘤概率较低。虽然近年来有关DSD患儿的内分泌检查和基因检测得到快速发展,但对大部分患儿来说,性腺病理结果仍是非常重要的临床诊断依据,也是为这类患儿制定个体化治疗方案的基础,同时对性别选择、手术干预、长期治疗策略制定等都具有重要意义。
| 1 |
Mouriquand PD, Gorduza DB, Gay CL, et al. Surgery in disorders of sex development (DSD) with a gender issue:If why, when, and how?[J]. J Pediatr Urol, 2016, 12(3): 139-149. DOI:10.1016/j.jpurol.2016.04.001. |
| 2 |
Meyer-Bahlburg HF, Baratz Dalke K, Berenbaum SA, et al. Gender assignment, reassignment and outcome in disorders of sex development:Update of the 2005 Consensus Conference[J]. Horm Res Paediatr, 2016, 85(2): 112-118. DOI:10.1159/000441386. |
| 3 |
唐达星, 付君芬. 性别发育异常的新认识及外科选择[J]. 中华小儿外科杂志, 2016, 37(7): 481-484. DOI:10.3760/cma.j.issn.0253-3006.2016.07.001. Tang DX, Fu JF. New concepts and surgical options of sex development disorder[J]. Chinese Journal of Pediatric Surgery, 2016, 37(7): 481-484. DOI:10.3760/cma.j.issn.0253-3006.2016.07.001. |
| 4 |
郭盛, 李嫔. 性发育异常儿童抚养性别再认识[J]. 中华实用儿科临床杂志, 2017, 32(20): 1526-1529. DOI:10.3760/cma.j.issn.2095-428X.2017.20.002. Guo S, Li B. Recognition of rearing sex in children with disorders of sex development[J]. Chinese Journal of Applied Clinical Pediatrics, 2017, 32(20): 1526-1529. DOI:10.3760/cma.j.issn.2095-428X.2017.20.002. |
| 5 |
Barseghyan H, Délot E, Vilain E. New Genomic Technologies:An Aid for Diagnosis of Disorders of Sex Development[J]. Hormone and Metabolic Research, 2015, 47(5): 312-320. DOI:10.1055/s-0035-1548831. |
| 6 |
Houk CP, Lee PA. Intersexed states:diagnosis and management[J]. Endocrinol Metab Clin North Am, 2005, 34(3): 791-810. DOI:10.1016/j.ecl.2005.04.014. |
| 7 |
Witchel SF. Disorders of sex development[J]. Best Pract Res Clin Obstet Gynaecol, 2018, 48(1): 90-102. DOI:10.1016/j.bpobgyn.2017.11.005. |
| 8 |
Fisher AD, Ristori J, Fanni E, et al. Gender identity, gender assignment and reassignment in individuals with disorders of sex development:a major of dilemma[J]. J Endocrinol Invest, 2016, 39(11): 1207-1224. DOI:10.1007/s40618-016-0482-0. |
| 9 |
Hatzimouratidis K, Eardley I, Giuliano F, et al. EAU guidelines on penile curvature[J]. Eur Urol, 2012, 62(3): 543-552. DOI:10.1016/j.eururo.2012.05.040. |
| 10 |
Larson A, Nokoff NJ, Travers S. Disorders of sex development:clinically relevant genes involved in gonadal differentiation[J]. Discovery Medicine, 2012, 14(78): 301-309. DOI:10.2310/7290.2012.00022. |
| 11 |
Krob G, Braun A, Kuhnle U. True hermaphroditism:Geographical distribution, clinical findings, chromosomes and gonadal histology[J]. European Journal of Pediatrics, 1994, 153(1): 2-10. DOI:10.1007/BF02000779. |
| 12 |
Hewitt J, Zacharin M. Hormone replacement in disorders of sex development:Current thinking[J]. Best Pract Res Clin Endocrinol Metab, 2015, 29(3): 437-447. DOI:10.1016/j.beem.2015.03.002. |
| 13 |
Bush N, Villanueva C, Snodgrass W. Glans size is an independent risk factor for urethroplasty complications after hypospadias repair[J]. J Pediatr Urol, 2015, 11(6): 355.e1-5. DOI:10.1016/j.jpurol.2015.05.029. |
| 14 |
Sajjad Y. Development of the genital ducts and external genitalia in the early human embryo[J]. J Obstet Gynaecol Res, 2010, 36(5): 929-937. DOI:10.1111/j.1447-0756.2010.01272.x. |
| 15 |
Deans R, Creighton SM, Liao LM, et al. Timing of gonadectomy in adult women with complete androgen insensitivity syndrome:patient preferences and clinical evidence[J]. Clin Endocrinol (Oxf), 2012, 76(6): 894-898. DOI:10.1111/j.1365-2265.2012.04330.x. |
| 16 |
Elzinga-Tinke JE, Sirre ME, Looijenga LH, et al. The predictive value of testicular ultrasound abnormalities for carcinoma in situ of the testis in men at risk for testicular cancer[J]. Int J Androl, 2010, 33(4): 597-603. DOI:10.1111/j.1365-2605.2009.00997.x. |
| 17 |
Cools M, Stoop H, Kersemaekers AM, et al. Gonadoblastoma arising in undifferentiated gonadal tissue within dysgenetic gonads[J]. J Clin Endocrinol Metab, 2006, 91(6): 2404-2413. DOI:10.1210/jc.2005-2554. |
| 18 |
Lifshitz F. Pediatric endocrinology[M]. Pediatric endocrinology, 2003.
|
| 19 |
Finlayson C, Fritsch MK, Johnson EK, et al. Presence of germ cells in disorders of sex development:implications for fertility potential and preservation[J]. J Urol, 2017, 197(3): 937-943. DOI:10.1016/j.juro.2016.08.108. |
| 20 |
梁海燕, 张潍平, 孙宁, 等. 74例46, XX性发育异常患儿性腺探查结果及分析[J]. 中华小儿外科杂志, 2016, 37(7): 517-521. DOI:10.3760/cma.j.issn.0253-3006.2016.07.008. Liang HY, Zhang WP, Sun N, et al. Results and analysis of exploring gonads of children with 46, XX DSD:a report of 74 cases[J]. Chinese Journal of Pediatric Surgery, 2016, 37(7): 517-521. DOI:10.3760/cma.j.issn.0253-3006.2016.07.008. |
 2019, Vol. 18
2019, Vol. 18


