2. 浙江大学医学院附属儿童医院泌尿外科(浙江省杭州市, 310052)
2. Department of Urology, Affiliated Children's Hospital, Zhejiang University School of Medicine, Hangzhou 310052, China
性发育异常(disorders of sex development,DSD)是指由于染色体、性腺或性别解剖结构的异常发育而出现的一种先天性异常,其发生率为0.1% ~0.5%[1, 2]。根据染色体核型可将DSD分为性染色体DSD、46,XX DSD和46,XY DSD[3]。长期以来,临床上对于46,XY DSD的分型诊断主要依靠HCG刺激试验及内分泌激素测定结果,但仍有超过50%的病例无法被精确诊断[4]。基因诊断是针对人类固有的遗传信息进行检测,能够找到疾病发生的本原,目前已成为各类遗传代谢病精准分型诊断的最有力依据[5, 6]。研究表明,46,XY DSD的遗传背景复杂,涉及数十个基因,进行分子分型诊断的工作极具挑战性[7]。关于46,XY DSD的基因检测,既往多采用Sanger测序进行单基因层面的研究。但Sanger测序技术无法满足同时对多个基因进行快速、准确、高效检测的要求,并且其通量的限制以及居高不下的测序成本极大地阻碍了检测效率的提高。而基于靶向基因捕获与高通量测序技术是针对感兴趣的特定基因外显子区域定制探针,并与基因组DNA进行杂交,经富集后利用高通量测序技术进行数据分析。由于测序的目标区域只占全基因组的一小部分,因此在保证获得足量目标基因变异信息的前提下极大地降低了测序成本。靶向基因捕获与高通量测序技术的组合应用既保留了信息自动化分析的优势,又避免检测过多冗余内含子区域,从而大大地提高了遗传缺陷疾病的检测效率[8, 9]。但遗憾的是在46,XY DSD基因检测领域,基于新一代基因测序技术(NGS,next generation sequencing)同时检测上百个基因的报道较少,不同表型46,XY DSD与单基因变异的相关性尚不明确。因此,该研究将着重探讨不同表型46,XY DSD与单基因变异的相关性,以期为临床管理和决策提供参考依据。
材料与方法 一、研究材料收集浙江大学医学院附属儿童医院2018年2月至2018年11月间137例临床诊断为46,XY DSD的病例,平均年龄(50±51)个月;社会性别男125例,社会性别女12例。在知情同意原则下由患者法定监护人签署知情同意书,采集患者及其父母静脉血各2.0 mL,EDTA抗凝处理后于4℃环境下保存备用。
二、研究方法1. DNA提取 采用QIAamp DNA Blood Mini Kit,按照说明书提取全血基因组DNA,采用Invitrogen Qubit dsDNA检测试剂盒与紫外分光光度计检测DNA浓度和纯度。
2.建库及测序 采用安捷伦公司SureSelect临床医学外显子序列捕获试剂盒,通过多重探针杂交方法靶向富集目标区域序列;Agencourt AMPure XP磁珠(Beckman Coulter)纯化捕获产物。按照TruePrepTM DNA Library Prep Kit V2 for Illumina (Vazyme)建库试剂盒操作说明书处理纯化产物,建库过程中对每个样本加上特殊标签(True-PrepTM Index Kit V2 for Illumina,Vazyme)。文库经Qubit及2100 Bioanalyzer (Agilent High Sensitivity DNA Kit,Agilent)进行浓度及片段大小质检分析确定合格后,利用定量试剂盒(IlluminaDNA Standa ds and Primer Premix Kit,kapa)进行文库精确定量并确定上机样本量,最后在HiSeq 2 500 (Illumina)平台进行测序反应。测序数据总量大于4G,目标区覆盖度大于99.90%,目标区平均测序深度大于180次。
3.数据处理 将高通量基因靶向测序数据Fastq进行低质量过滤,以人类基因组hg19为参考序列,通过BWM、Picard等生物信息软件进行序列比对与重复标记。采用GATK、Samtools进行变异位点的识别[10]。采用Annovar注释软件将突变位点注释到公共突变数据库,根据突变位点在正常人群中的频率、序列保守性、突变引起的氨基酸改变以及在蛋白质结构中所处的位置进行结果分析,并通过SIFT、Polyphen及MutationTaster等11个生物信息软件预测突变对蛋白功能的影响程度[11]。
4.遗传来源检测 取20 ng DNA,使用待测位点的特异性引物,按照TaKaRa LA PCRTM Kit Ver.2.1操作流程进行PCR反应,并使用NucleoSpin® Gel and PCR Clean-up切胶回收纯化。回收产物按照BigDye® Terminator v3.1Cycle Sequencing Kit操作流程进行测序PCR反应及纯化。纯化产物于ABI 3500XL平台进行测序。测序结果采用SeqMan软件进行序列比对分析。
5. DSD基因变异的致病性判读 检索HPO、OMIM、PubMed等数据库,确定SureSelect临床医学外显子序列捕获试剂盒覆盖了242个DSD相关基因。参考ACMG分类标准对上述方法检出的可疑变异进行致病性评估,具体分为“致病的、可能致病的、意义未明的、可能良性的、良性的”5个级别[12]。其中评估级别为“致病的、可能致病的、意义未明的”的DSD相关基因的变异将被纳入本次研究。
6.结果分析 将测试病例按临床表型分为“隐睾或小睾丸、尿道下裂、小阴茎或隐匿性阴茎”、多种DSD表型(表现为“隐睾或小睾丸、尿道下裂、小阴茎或隐匿性阴茎”中的2种以上表型)、性别模糊、综合征型DSD(合并有非DSD的其它表型)共6组。对各病例组的阳性检出率(DSD相关基因检出意义未明、可能致病、致病变异的病例数之和占患儿总人数比例)、辅助诊断率(DSD相关基因检出可能致病与致病变异并符合遗传模式的病例数之和占患儿总人数比例)及基因变异与表型进行统计。辅助诊断率计算公式:(可能致病变异例数+致病变异例数)/总例数×100%。
结 果 一、基因变异137例46,XY DSD中包括隐睾或小睾丸13例、尿道下裂38例、小阴茎或隐匿性阴茎31例、多种DSD表型27例、性别模糊22例、综合征型DSD 6例。共检出62例具备临床参考价值的变异,涉及23个基因,详见表 1。62例中36例检出具备辅助诊断价值的变异,涉及10个基因,详见表 2。
|
|
表 1 具备临床参考价值的基因变异检出情况(单位:例) Table 1 Detection of gene mutations with clinical reference value (unit:case) |
|
|
表 2 具备辅助诊断价值的基因变异检出情况(单位:例) Table 2 Detection of gene mutations with diagnostic value (unit:case) |
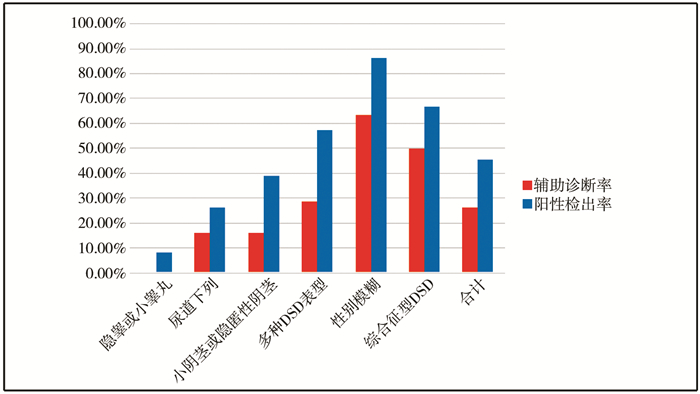
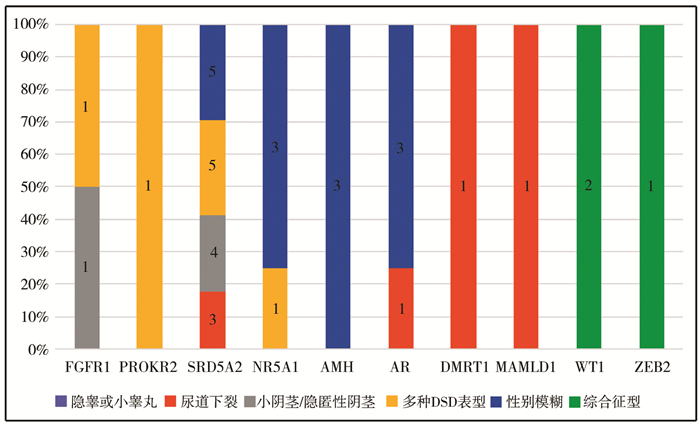
隐睾或小睾丸、尿道下裂、小阴茎或隐匿性阴茎、多种DSD表型、性别模糊、综合征型DSD的阳性检出率分别为8.33%、26.32%、38.71%、57.14%、86.36%、66.67%,其辅助诊断率分别为0.00%、15.79%、16.13%、28.57%、63.64%、50.00%。各病例组的阳性检出率与辅助诊断率结果见图 1,确诊病例基因变异与表型结果见图 2。
|
Download:
|
| 图 1 各病例组的阳性检出率与辅助诊断率 Fig. 1 Positive detection rate and auxiliary diagnostic rate of each case group | |
|
Download:
|
| 图 2 确诊病例的基因变异与表型(柱状图中数字代表基因确诊病例的例数,纵轴的百分比代表同一基因突变出现不同表型的比例) Fig. 2 Gene variations and phenotypes of confirmed cases | |
46,XY DSD可影响患者的生殖功能,更重要的是可能造成患儿出现心理、行为偏差,处理不当可能引起社会问题。明确其遗传学病因能更好地指导临床干预和再生育。近年来,高通量测序(NGS)技术取得了飞速的发展,在遗传缺陷疾病的分子遗传学检测领域已成为继Sanger测序后的新一代测序方法。当前国际上46,XY DSD的分子研究基础已经逐步明晰,并已尝试采用NGS技术进行多个46,XY DSD相关基因的同步检测。综合多篇报道结果[7, 13, 14],与46,XY DSD相关的基因至少有60个,但不同中心纳入检测的基因数目及检测效能均不相同。该研究纳入了2 742个遗传性疾病相关基因,涉及非综合征型DSD和综合征型DSD相关的242个基因,并覆盖90%以上46,XY DSD相关基因,增加了检测的适用性。
Berglund A等报道的46,XY DSD病例基因检测的阳性检出率约为57.14%,辅助诊断率约为34.29%[13];Eggers S等报道的阳性检出率约为57%,辅助诊断率约为43%[14]。而本研究的阳性检出率为45.26%,辅助诊断率为26.28%,接近于Yanjie Fan等[15]的报道水平。同时,本研究发现不同临床表型46,XY DSD的阳性检出率和辅助诊断率均存在显著差异,不同病例组之间可相差10倍左右,其阳性检出率和辅助诊断率均与表型的严重程度及多样性呈正相关。性别模糊与综合征型DSD的辅助诊断率分别为63.64%和50.00%,提示其遗传相关性高,其中单基因变异是主要病因,更适合进行基因检测。但本研究也发现基因检测结果对尿道下裂、小阴茎或隐匿性阴茎、多种DSD表型的辅助诊断率分别为15.79%、16.13%、28.57%,这提示单基因变异虽然是诱发DSD的关键因素之一,但并非主要因素,环境因素也不容忽视。而单纯性隐睾或小睾丸的辅助诊断率为0%,提示其遗传因素尚不明确,故不推荐进行分子遗传学检测。
多数学者认为AR变异是导致46,XY DSD的最常见病因,其次为SRD5A2变异[16, 17]。本研究结果显示SRD5A2、AR和NR5A1是46,XY DSD的主要相关基因。在确诊病例中,SRD5A2变异者占47.22%,AR与NR5A1变异者均占11.11%。这提示46,XY DSD的遗传学病因存在种族间差异,SRD5A2可能是导致本地区46,XY DSD的最重要热点基因。
据报道,在单基因变异以外约15%的DSD是由于基因组拷贝数变异所致,其中综合征型DSD占20% ~30%,孤立性DSD为5% ~18%[18, 19]。46,XY DSD的基因组拷贝数变异可涉及NROB1(DAX1)的重复、SOX9上游565kb处增强子13的缺失、SOX8基因座的染色体重排等。因此对于基因检测未明确病因的46,XY DSD病例(尤其是综合征型DSD)可以使用染色体微阵列芯片等技术继续查找遗传学病因。
综上所述,基于NGS技术同时检测多个DSD相关基因对明确46,XY DSD的遗传学病因具有一定的临床意义,可考虑作为一线临床检测手段。但需要注意不同表型46,XY DSD的诊断率存在显著差异,建议在签署检测知情同意书时将检查结果的临床参考价值正确告知被检者(特别是对于某些诊断效率较差的单纯性隐睾或小睾丸病例)。
| 1 |
Lee PA, CP Houk, SF Ahmed, et al. Consensus statement on management of intersex disorders[J]. International Consensus Conference on Intersex.Pediatrics, 2006, 118(2): e488-500. DOI:10.1016/j.jpurol.2006.03.004. |
| 2 |
Arboleda VA, Lee H, Sánchez FJ, et al. Targeted massively parallel sequencing provides comprehensive genetic diagnosis for patients with disorders of sex development[J]. Clin Genet, 2013, 83(1): 35-43. DOI:10.1111/j.1399-0004.2012.01879.x. |
| 3 |
Hull CL, Fausto-Sterling A. How Sexually Dimorphic Are We? Review and Synthesis[J]. American Journal of Human Biology the Official Journal of the Human Biology Council, 2003, 15(1): 112. DOI:10.1002/ajhb.10122. |
| 4 |
Hughes IA1, Nihoul-Fékété C, Thomas B, et al. Consequences of the ESPE/LWPES guidelines for diagnosis and treatment of disorders of sex development[J]. Best Pract Res Clin Endocrinol Metab, 2007, 21(3): 351-365. DOI:10.1016/j.beem.2007.06.003. |
| 5 |
Wertheim-Tysarowska K, Gos M, Sykut-Cegielska J, et al. Genetic analysis in inherited metabolic disorders-from diagnosis to treatment.Own experience, current state of knowledge and perspectives[J]. Dev Period Med, 2015, 19(4): 413-431. |
| 6 |
Ghosh A, Schlecht H1, Heptinstall LE, et al. Diagnosing childhood-onset inborn errors of metabolism by next-generation sequencing[J]. Arch Dis Child, 2017, 102(11): 1019-1029. DOI:10.1136/archdischild-2017-312738. |
| 7 |
Jeon YK, Yoon SO, Paik JH, et al. Molecular Testing of Lymphoproliferative Disorders:Current Status and Perspectives[J]. Journal of Pathology & Translational Medicine, 2017, 51(3): 224-241. DOI:10.4132/jptm.2017.04.09. |
| 8 |
Ku CS, Cooper DN, Polychronakos C, et al. Exome sequencing:dual role as a discovery and diagnostic tool[J]. Ann Neurol, 2012, 71(1): 5-14. DOI:10.1002/ana.22647. |
| 9 |
Bamshad MJ, Ng SB, Bigham AW, et al. Exome sequencing as a tool for Mendelian disease gene discovery[J]. Nat Rev Genet, 2011, 12(11): 745-755. DOI:10.1038/nrg3031. |
| 10 |
Nielsen R, Paul JS, Albrechtsen A, et al. Genotype and SNP calling from next-generation sequencing data[J]. Nature Reviews Genetics, 2011, 12(6): 443-451. DOI:10.1038/nrg2986. |
| 11 |
Yang Y, Muzny DM, Reid JG, et al. Clinical whole-exome sequencing for the diagnosis of mendelian disorders[J]. New England Journal of Medicine, 2013, 369(16): 1502-1511. DOI:10.1056/NEJMoa1306555. |
| 12 |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:ajoint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genetics in Medicine:Official Journal of the American College of Medical Genetics, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30. |
| 13 |
Berglund A, Johannsen T H, Stochholm K, et al. Incidence, prevalence, diagnostic delay, and clinical presentation of female 46, XY disorders of sex development[J]. J Clin Endocrinol Metab, 2016, 101(12): 4532. DOI:10.1210/jc.2016-2248. |
| 14 |
Eggers S, Sadedin S, Vanden Bergen JA, et al. Disorders of sex development:insights from targeted gene sequencing of a large international patient cohort[J]. Genome Biol, 2016, 17(1): 243. DOI:10.1186/s13059-016-1105-y. |
| 15 |
Yanjie F, Xia Z, Lili W, et al. Diagnostic Application of Targeted Next-Generation Sequencing of 80 Genes Associated with Disorders of Sexual Development[J]. Sci Rep, 2017, 15(7): 44536. DOI:10.1038/srep44536. |
| 16 |
Li SP, Li LW, Sun MX, et al. Identification of a novel mutation in the SRD5A2 gene of one patient with 46, XY disorder of sex development[J]. Asian J Androl, 2018, 20(5): 518-519. DOI:10.4103/aja.aja_34_18. |
| 17 |
Hughes IA, Davies JD, Bunch TI, et al. Androgen insensitivity syndrome[J]. Seminars in Reproductive Medicine, 2012, 30(5): 432-442. DOI:10.1055/s-0032-1324728. |
| 18 |
Croft B, Ohnesorg T, Sinclair H. The role of copy number variants in disorders of sex development[J]. Sex Dev, 2018, 12(1-3): 19-29. DOI:10.1159/000481896. |
| 19 |
Ledig S, Hiort O, Scherer G, et al. Array-CGH analysis in patients with syndromic and nonsyndromic XY gonadal dysgenesis:evaluation of array CGH as diagnostic tool and search for new candidate loci[J]. Hum Reprod, 2010, 25(10): 2637-2646. DOI:10.1093/humrep/deq167. |
 2019, Vol. 18
2019, Vol. 18


