性别发育分化包括染色体性别确定、性腺分化与形成、内外生殖管道的发育及性心理分化等内容,这个高度有序过程中的任何一个步骤出现异常都会导致性别发育异常。而性别发育异常(或)差异(disorders/differences of sex development,DSD)是一种先天性染色体、性腺和表型性别的发育异常或不匹配,包含一系列先天代谢异常和畸形(主要表现为外生殖器的异常)。根据2006年芝加哥会议达成的共识,性别发育异常可分为3类:46,XX DSD、46,XY DSD和性染色体DSD。其中,46,XY DSD的染色体核型为46,XY,可有苗勒氏管结构,外生殖器既可表现为正常男性生殖器、也可表现为模糊外生殖器,甚至完全女性化。由于46,XY DSD发病机制复杂,表现多样,其分类和处理一直是临床工作的重点和难点。本研究旨在针对46,XY DSD患儿的临床特点、病因、诊断及治疗方案进行探讨,以进一步提高小儿泌尿外科医生对该疾病的认识。
材料与方法 一、研究对象收集2011年9月至2018年11月间就诊于中国医科大学附属盛京医院小儿泌尿外科,诊断为46,XY DSD且SRY基因阳性的41例患儿为研究对象。
二、研究方法本研究收集的资料包括:患儿一般情况、家族史、临床查体结果、腹股沟会阴区及盆腔彩超结果、电解质水平、各项激素(皮质醇、促肾上腺皮质激素、促性腺激素、睾酮、双氢睾酮、雄烯二酮等)水平、部分HCG激发试验前后激素水平、内生殖器探查所见内容、性腺活检病理结果及部分基因筛查结果。41例中35例行HCG激发试验,采用3 d短期试验方案,人绒毛膜促性腺激素500~1 500 IU/d,根据年龄调整HCG用量,每日肌肉注射1次,共3次;肌注第3次后于次日抽血检测血清睾酮、雄烯二酮、双氢睾酮(dihydrotestosterone,DHT)、FSH及LH水平;HCG激发前后ΔT>1 ng/mL为正常反应,判定为HCG激发试验阳性;ΔT < 1 ng/mL为低弱反应,提示可能存在原发性睾丸功能低下,判定为部分阳性;刺激后睾酮完全不升高判定为阴性。按照欧洲儿科内分泌学会和劳森-威尔金斯儿科内分泌学会发表的DSD诊断标准对本研究纳入的DSD患儿进行分类[1, 2]。经过多学科联合会诊,对6岁以上患儿进行心理评估,所有外生殖器整形手术均通过伦理道德委员会批准,术后进行随访,并及时进行性激素替代治疗;当发现各种心理紊乱或异常时,由专业心理医师及时进行疏导和干预。
结 果本组41例患儿初诊年龄3个月至15岁,中位年龄15个月。社会性别男28例,女13例;2例患儿同父同母,家族中其他成员有不孕不育病史。因外生殖器外观异常就诊者19例,因阴茎发育小合并(或)阴囊空虚就诊者17例,其他就诊原因包括高血压、阴蒂肥大、小阴唇粘连、双侧腹股沟包块及原发性闭经等。外生殖器完全女性化3例,外生殖器明显男性化17例,外生殖器表现模糊21例。除苗勒氏管永存综合征外,35例行HCG激发试验辅助诊断;为进一步明确诊断,23例行性别发育相关基因筛查,8例通过性腺活检行组织学检查。41例DSD患儿的详细临床资料及部分基因筛查结果见表 1及表 2。
|
|
表 1 41例DSD患儿临床信息 Table 1 Clinical profiles of 41 children |
|
|
表 2 基因筛查结果 Table 2 Results of genetic screening |
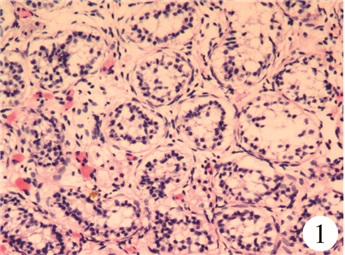
部分性腺发育不全5例(ID:1~5),均外生殖器表现模糊;3例(ID:1、4、5)阴囊(或大阴唇、腹股沟)部位可扪及睾丸;2例(ID:2、3)腹腔见睾丸组织和苗勒管组织残留,睾丸长度0.5~1.0 cm,宽度0.3~0.5 cm;HCG激发试验部分阳性4例,阴性1例,NR5A1基因突变5例。性腺探查及活检结果均提示为发育不良睾丸组织(图 1),均无性腺肿瘤发生。2例(ID:1、5)维持男性性别,双侧腹股沟区睾丸固定至阴囊;2例(ID:2、3)社会性别女性的患儿选择女性性别后,因腹腔内睾丸无法降入阴囊,予双侧性腺切除,保留子宫,并行阴蒂阴唇整形手术;目前患儿年龄3~5岁,心理稳定,家庭适应性良好。1例(ID:4)社会性别女性患儿双侧睾丸位于大阴唇处,行组织学检查后暂未接受进一步治疗。
|
Download:
|
| 图 1 病理镜检图片:发育不良曲细精管(HE染色,×100倍) Fig. 1 Microscopic examination of pathological specimens: immature hypoplastic seminiferous tubules and persistent stroma resembling | |
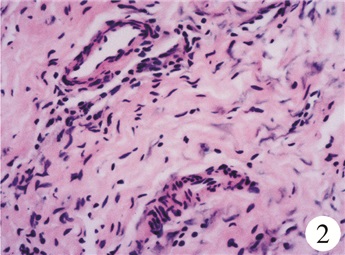
混合性腺发育不全3例(ID:6~8),外生殖器表现模糊,其中2例(ID:6、8)单侧阴囊可触及性腺,盆腔彩超提示一侧性腺为睾丸组织,另一侧未见明确性腺组织,HCG激发试验结果均为阳性。性腺探查及活检结果提示一侧性腺未见卵泡,仅包含卵巢基质,为条纹性腺(图 2);另一侧发育不良睾丸均见残余苗勒氏管结构;双侧均无性腺肿瘤发生。2例(ID:6、8)患儿维持男性性别,行条纹性腺切除、左睾丸固定、阴茎弯曲矫正及尿道成形手术;目前患儿年龄2~5岁,心理稳定,家庭适应性良好。1例(ID:7)患儿社会性别女,行左侧条纹性腺切除术,暂未接受进一步治疗。
|
Download:
|
| 图 2 病理镜检图片:条纹性腺(HE染色,×100倍) Fig. 2 Microscopic examination of pathological speci-mens: streak gonad | |
双侧睾丸消失综合征9例(ID:9~17),社会性别均为男性,表现为小阴茎、阴囊空虚,腹股沟区未触及睾丸,盆腔彩超亦未及睾丸组织;2例(ID:9、11)患儿腹股沟区彩超探及0.5 cm×0.3 cm结节,激素检测可见FSH异常升高(33.12~145.88 IU/L),HCG激发试验均为阴性。性腺探查精索末端未见睾丸组织,2例精索盲端软组织膨大予以切除,病理检查提示为纤维脂肪血管及输精管组织。其中1例(ID:9)患儿13岁后于内分泌科接受进一步治疗。
雄激素合成障碍10例(ID:18~27),双侧性腺均为睾丸,无苗勒氏管结构,HCG激发试验阳性6例(ID:22~27),部分阳性2例(ID:20、21),阴性2例(ID:18、19),均通过基因检测明确诊断。其中细胞色素P450侧链裂解酶缺乏1例(ID:18),合并CYP11A1基因突变,社会性别女,激素检查ACTH升高,皮质醇、孕酮和17-羟孕酮降低,醛固酮、血浆肾素活性和电解质未见异常,ACTH激发试验提示肾上腺功能不全;患儿现于内分泌科接受进一步治疗。17α-羟化酶缺乏1例(ID:19),CYP17A1基因突变,社会性别女,高血压、既往低钾血症,幼稚女性外生殖器,盲端阴道,激素检测ACTH、FSH、LH、孕酮升高,皮质醇、雌二醇、睾酮降低,骨龄延迟;性腺探查及病理检查提示双侧睾丸组织发育不良,并予以切除,维持女性性别。17β-类固醇脱氢酶缺乏3例(ID:20~22),合并HSD17B3基因突变,社会性别女性,其中2例为同父同母姐妹,姐姐出生时为女性外生殖器外观,青春期发生男性化,心理评估为女性,选择维持女性性别,行双侧性腺切除术及女性外生殖器整形术,术后接受雌激素替代治疗;其余2例暂未接受进一步治疗。5α-还原酶缺乏5例(ID:23~27),SRD5A2基因突变,社会性别男性,阴茎短小,双睾丸位于阴囊,均维持男性性别,行男性外生殖整形手术。
雄激素不敏感综合征6例(ID:28~33),单侧或双侧腹腔型隐睾,无苗勒氏管结构,内分泌检查结果提示睾酮和促性腺激素均达到正常男性水平,T/DHT及T/雄烯二酮比值正常,HCG激发试验阳性。其中完全雄激素不敏感综合征2例,社会性别女,分别因“双侧腹股沟包块”、“原发性闭经”就诊,完全女性外生殖器,盲端阴道,AR基因纯合突变,暂未接受进一步治疗。4例部分雄激素不敏感患儿,外生殖器模糊,其中3例为AR基因突变;其余1例社会性别女性患儿,选择男性性别后行睾丸固定术。
苗勒氏管永存综合征(persistent müllerian duct syndrome,PMDS)6例(ID:34~39),社会性别男性,其中4例睾丸异位至对侧阴囊,2例双侧隐睾。腹腔镜探查见双侧输卵管伞及痕迹子宫。保留部分阴道以避免损伤输精管,切除苗勒氏管残余组织后行睾丸固定术。
Kallmann综合征2例(ID:40、41),社会性别男,表现为小阴茎、双睾丸发育不良及促性腺激素分泌低下;PROKR2基因突变1例,KAL1基因突变1例。现于小儿内分泌科继续接受激素治疗。
讨 论随着对疾病认识的不断深化,46,XY DSD的诊断方法也在不断改进。除性腺发育异常及睾丸消失综合征外,雄激素合成、功能的缺失及苗勒氏管永存综合征最终都需通过基因检测明确诊断[3]。HCG激发后分别检测睾酮与双氢睾酮、睾酮与雄烯二酮的比值变化虽然对5α-还原酶缺乏和17β-羟类固醇脱氢酶缺乏患者的辅助诊断有一定价值,但最终确诊仍需基于基因测序的结果。本组病例发生突变的基因主要包括CYP11A1、CYP17A1、HSD17B3、SRD5A2、AR等,它们可导致雄激素合成过程中的重要酶类出现缺乏,也可造成雄激素受体数量或质量等出现异常。双侧睾丸消失综合征的诊断主要依靠内分泌检测,典型结果包括睾酮水平极低、LH及FSH升高、MIS检测不到等;彩超提示精索残端存在软组织膨大时通常予以切除,但没有充分的证据表明残留生精细胞及曲细精管组织具有恶性潜能,故是否需要切除仍存在争议[4]。
此外,部分及混合性腺发育不全需要通过性腺活检以明确诊断(特别是当性腺位于腹腔内时)。本组中5例部分性腺发育不全患儿活检病理结果均提示双侧睾丸组织发育不良,3例混合性腺发育不全患儿活检病理结果提示一侧为仅含卵巢基质的条纹性腺,另一侧为发育不良的睾丸组织。需要注意的是,典型混合性腺发育不全患者多为45,X/46,XY核型,也曾有过46,XY核型的报道,可能是因为这些患者的45XO细胞系比例太低,所以需要同时行外周血染色体嵌合型检查。本组中3例混合性腺发育不全患儿行外周血染色体嵌合型检查均未见45,X核型,不排除未检测到或遗漏的可能。
对46,XY DSD患者行性腺活检并非常规操作,只有当怀疑存在性腺发育不全、条纹性腺、卵睾及可疑性腺恶变等情况需要通过组织学信息明确诊断时才会进行。标准活检通常需要纵向切取深部组织,以避免遗漏性腺深部组织成分。当出现生殖细胞癌、(预期)性腺分泌激素有反向作用、患者自检或影像监测性腺恶变的依从性差、患者主动要求切除性腺、存在Y染色体物质的条纹性腺(Turner综合征、46,XY完全性腺发育不全、混合性腺发育不全)等情况时需要切除性腺[5]。除此之外,功能良好的腹腔内性腺需要移出腹腔,如果可能最好降至阴囊内,以便监测恶变;如不能移出腹腔则需切除。本组中3例患儿性腺位于腹腔,无法降至阴囊甚至腹股沟区,最终予以切除,其余性腺降至便于监测恶变的体表位置。虽然睾酮合成障碍的性腺恶变风险较低,但对于46,XY DSD睾酮合成障碍的完全女性外生殖器且选择女性性别的患儿,仍然建议儿童期切除睾丸以防止恶变;本组中1例17α-羟化酶缺乏患儿确诊后切除睾丸组织,病理检查未见恶变。针对CAIS患儿,建议保留性腺至青春期之后,因为睾丸分泌的雄激素可以转化为雌激素促进女性化[6],可待青春期之后根据个人意愿进行选择。下图为作者自行绘制的46,XY DSD诊断图,供临床参考。

|
Download:
|
| 图 3 46,XY DSD诊断图 Fig. 3 Diagnostic flowchart of 46, XY DSD | |
46,XY DSD处理难点在于性别的认定、选择及其最佳决策时间。性别认定的主要目标是使性别认定与选定的性别保持一致,避免增加性焦虑风险。获得确定诊断后,关于性别认定要和患儿家属进行全面、客观的讨论,包括正常性功能潜能、生育能力、性腺恶变风险及各种潜在的选择,并结合患儿的实际情况给予建议[7]。同时应告知患儿父母,大多数DSD目前缺乏关于性别认定的高质量的长期社会心理随访数据。解决与性别认同有关的问题,需要医者与患儿及其家属建立积极的伙伴关系,以确定最佳干预方案[8, 9]。
双侧睾丸消失综合征和苗勒氏管永存综合征患儿因外生殖器明显男性化,故维持男性性别。据报道PMDS患儿残余苗勒氏管结构有恶变风险(恶变率3% ~8%),因此建议行睾丸固定手术的同时切除苗勒氏管结构,但要注意避免损伤输精管,本组中患儿处置与之相符。因5α-还原酶缺乏、17β-羟类固醇氧化还原酶(3型)缺乏、NR5A1突变的部分性腺发育不全及部分雄激素不敏感这4类患儿青春期均可出现自发男性化[10-13], 因此推荐男性性别选择,不可逆的干预最好推迟至患者本人可以参与决定后再进行[14, 15]。本组病例中细胞色素P450侧链裂解酶缺乏及17α-羟化酶缺乏患儿因睾酮合成障碍,为完全女性外生殖器表现。由于睾酮生成不足,雄激素印迹对于这些患者并不重要,故维持女性性别。针对部分及混合性腺发育不全患儿,如睾丸有功能可选择男性性别,睾丸需降至阴囊,严密监测性腺肿瘤发生(定期体检及超声检查);睾丸功能不良且不能降至阴囊,可行预防性性腺切除[5];性别选择需根据睾丸功能及大小、内外生殖器发育情况(是否存在子宫)、生殖潜能等诸多因素决定。本组8例患儿中,4例功能良好者睾丸降至阴囊。2例部分性腺发育不全患儿存在女性化外生殖器,PraderⅡ~Ⅲ级,HCG激发试验结果为部分阳性;由于受到风俗习惯、父母受教育程度、社会生活压力等多方面因素影响,家属选择早期接受性腺切除及阴蒂阴唇整形手术;随着对疾病认识的不断提升,现多主张选择男性。同时NR5A1突变的部分性腺发育不全患儿青春期可发生自发男性化。所以,术后定期社会心理随访、及时的心理疏导与干预尤为重要。
综上所述,性别选择是46,XY DSD治疗的关键,需要综合考虑优势性腺、外生殖器发育情况、性腺恶变可能、患者意愿、心理性别等多方面因素进行慎重选择,其中性心理发育过程受到胚胎期大脑印迹、小青春期及青春期共同影响。最好让患儿自己参与性别选择,避免进行不可逆的性腺切除及外生殖器手术。此外,有必要在国内建立多中心合作的数据库对患者进行长期社会心理随访,不断探索并建立46,XY DSD的诊疗指南。
| 1 |
Lee PA, Houk CP, Ahmed SF, et al. Consensus statement on management of intersex disorders.International Consensus Conference on Intersex[J]. Pediatrics, 2006, 118(2): e488-500. DOI:10.1542/peds.2006-0738. |
| 2 |
Hughes IA, Houk C, Ahmed SF, et al. Consensus statement on management of intersex disorders[J]. J Pediatr Urol, 2006, 2(3): 148-162. DOI:10.1016/j.jpurol.2006.03.004. |
| 3 |
Gobikrushanth M, Purfield DC, Colazo MG, et al. The relationship between serum anti-Müllerian hormone concentrations and fertility, and genome-wide associations for anti-Müllerian hormone in Holstein cows[J]. Journal of Dairy Science, 2018, 101(8): S0022030218303990. |
| 4 |
Nataraja RM, Yeap E, Healy CJ, et al. Presence of viable germ cells in testicular regression syndrome remnants:Is routine excision indicated? A systematic review[J]. Pediatr Surg Int, 2018, 34(3): 353-361. DOI:10.1007/s00383-017-4106-0. |
| 5 |
Wolffenbuttel KP, Hersmus R, Stoop H, et al. Gonadal dysgenesis in disorders of sex development:Diagnosis and surgical management[J]. J Pediatr Urol, 2016, 12(6): 411-416. DOI:10.1016/j.jpurol.2016.08.015. |
| 6 |
Deans R, Creighton SM, Liao LM, et al. Timing of gonadectomy in adult women with complete androgen insensitivity syndrome (CAIS):patient preferences and clinical evidence[J]. Clin Endocrinol (Oxf), 2012, 76(6): 894-898. DOI:10.1111/j.1365-2265.2012.04330.x. |
| 7 |
Fisher AD, Ristori J, Fanni E, et al. Gender identity, gender assignment and reassignment in individuals with disorders of sex development:a major of dilemma[J]. J Endocrinol Invest, 2016, 39(11): 1207-1224. DOI:10.1007/s40618-016-0482-0. |
| 8 |
McCauley E. Challenges in educating patients and parents about differences in sex development[J]. Am J Med Genet C Semin Med Genet, 2017, 175(2): 293-299. DOI:10.1002/ajmg.c.31563. |
| 9 |
Witchel SF. Disorders of sex development[J]. Best Pract Res Clin Obstet Gynaecol, 2018, 48(1): 90-102. DOI:10.1016/j.bpobgyn.2017.11.005. |
| 10 |
Sobel V, Imperato-McGinley J. Gender identity in XY intersexuality[J]. Child Adolesc Psychiatr Clin N Am, 2004, 13(3): 609-622. DOI:10.1016/j.chc.2004.02.014. |
| 11 |
Adachi M, Hasegawa T, Tanaka Y, et al. Spontaneous virilization around puberty in NR5A1-related 46, XY sex reversal:additional case and a literature review[J]. Endocr J, 2018, 65(12): 1187-1192. DOI:10.1507/endocrj.EJ18-0218. |
| 12 |
Bramble MS, Lipson A, Vashist N, et al. Effects of chromosomal sex and hormonal influences on shaping sex differences in brain and behavior:Lessons from cases of disorders of sex development[J]. J Neurosci Res, 2017, 95(1-2): 65-74. DOI:10.1002/jnr.23832. |
| 13 |
Meyer-Bahlburg HF, Baratz Dalke K, Berenbaum SA, et al. Gender assignment, reassignment and outcome in disorders of sex development:Update of the 2005 Consensus Conference[J]. Horm Res Paediatr, 2016, 85(2): 112-118. DOI:10.1159/000441386. |
| 14 |
Lee PA, Nordenstrom A, Houk CP, et al. Global disorders of sex development update since 2006:perceptions, approach and care[J]. Horm Res Paediatr, 2016, 85(3): 158-180. DOI:10.1159/000441975. |
| 15 |
Mouriquand PD, Gorduza DB, Gay CL, et al. Surgery in disorders of sex development (DSD) with a gender issue:If why, when, and how?[J]. J Pediatr Urol, 2016, 12(3): 139-149. DOI:10.1016/j.jpurol.2016.04.001. |
 2019, Vol. 18
2019, Vol. 18


