肝母细胞瘤是儿童最常见的肝脏恶性实体瘤,约占儿童肝脏恶性肿瘤的2/3[1]。手术完整切除肿瘤仍然是治愈肝母细胞瘤最主要的手段。肿瘤的部位和切除范围主要依靠术前影像学检查、术中肉眼观察、扪诊或超声定位来确定[2, 3]。但已有的这些检查对微小病灶的识别和切缘的界定仍然存在不足,往往不能达到肿瘤R0切除,容易造成肿瘤术后的复发,影响预后。吲哚菁绿(indocyanine green, ICG)是一种近红外荧光染料,自2009年Izhizawa[4]等首次将ICG分子荧光影像技术应用到肝癌切除术中以来,该技术在肝脏肿瘤诊断、肝储备功能评估和手术导航中的应用越来越广泛[5, 6]。儿童肝脏肿瘤的疾病谱与成人有很大区别,目前对于儿童使用ICG荧光计算指导肝肿瘤切除的文献报道有限[7-9]。本研究通过术前注射ICG,术中观察儿童良、恶性肿瘤的显影特征,并总结其在微小病灶的识别、切缘的界定和手术导航中的价值。
材料与方法 一、临床资料回顾性分析2018年1月至2018年6月由复旦大学附属儿科医院收治的8例肝母细胞瘤患儿的临床资料。所有患儿术前通过腹部超声、肝脏增强CT+三维重建或MRI检查确定肿瘤部位和范围。8例患儿中,男童和女童各4例,年龄5~132个月,平均年龄33个月。术后病理检查均证实为肝母细胞瘤(图 1),其中1例肝母细胞瘤伴乙型肝炎的患儿病理提示肝脏存在轻度结节性肝硬化。所有病例中,术后复发再次手术1例,术前活检化疗后再手术1例,术前经验性化疗后再手术4例。2例一期行肝肿瘤切除术(表 1)。所有患儿在注射ICG后未出现过敏、发热、皮疹等不适反应。
|
Download:
|
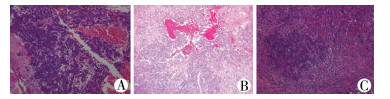
| 图 1 典型病例肝母细胞瘤病理切片 注 A:病例1为纯胎儿型肝母细胞瘤(×200);B:病例6为混合性胎儿上皮和胚胎上皮型肝母细胞瘤(×200); C:病例4为复发后的肝母细胞瘤(×200) Fig. 1 Pathological slide of hepatoblastoma for a typical case | |
|
|
表 1 ICG荧光显像特征及切缘和病理结果 Table 1 ICG fluorescent imaging characteristics, cutting edges and pathological results |
术前24~48 h,按0.5 mg/kg外周静脉注射ICG。术中暴露肝脏后,距离肝脏约10~15 cm应用近红外探头检查肝脏,依照实时显示的荧光图像对肿瘤进行定位。在荧光结节边缘外约1.5~2 cm处画肿瘤R0切除线,保证规则或不规则肝脏及肿瘤切除至少位于R0切除线的外缘。在切开肝脏组织的同时,联合使用ICG荧光显像实时显示病灶的位置和大小,根据切除过程中肝脏断面的荧光情况来修正原切除线。切除肿物后,用近红外探头对标本和切缘进行扫描。
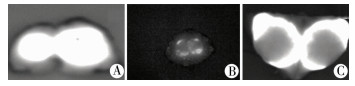
三、荧光结节分类根据荧光显像的特征,将荧光结节分为全荧光型、部分荧光型和环形荧光型3类(图 2)。
|
Download:
|
| 图 2 肝肿瘤荧光结节典型特征 A:全荧光型;B:部分荧光型;C:环形荧光型(图片引自文献[10]) Fig. 2 Typical nodular fluorescent characteristics of hepatic tumors | |
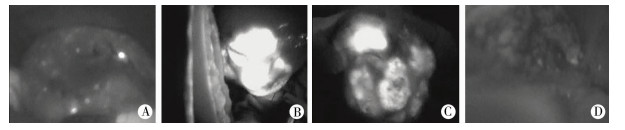
术中8例患儿肿瘤都能呈现明亮荧光显影,与正常肝脏组织边界清晰。1例肝母细胞瘤的复发病例(病例4),虽然术前MRI发现微小转移灶(1.0 cm),但由于位置较深(距离肝脏表面>1.5 cm),肉眼观察、扪诊和ICG荧光显像均未能发现,规则切除肝叶后,ICG识别出复发病灶,同时该患儿术中发现肝脏弥漫性小结节影(图 3A),术中取部分结节送病理,提示为肝脏硬化结节,而非肿瘤,其余7例均未发现额外病灶。
|
Download:
|
| 图 3 肝母细胞瘤ICG荧光显像分类及切缘界定 A:可见肝脏均匀弥漫性小结节样显影,为肝硬化小结节(病例4);B:一期行肿瘤切除术,术中可见肿瘤呈全荧光显像(病例5);C:化疗后行肿瘤切除术,术中可见肿瘤呈部分荧光显像(病例6);D:术后切缘可见无荧光显影,病理证实为切缘阴性(病例8) Fig. 3 ICG fluorescent imaging classifications and margin definitions of hepatoblastoma | |
根据荧光显影类型,全荧光型4例,其中2例肝母细胞瘤为一期行肿瘤切除术(图 3B),1例术前有活检和化疗史,1例为肝母细胞瘤复发病例,伴有肝炎和肝轻度硬化病史,同时伴有肝脏弥漫性小结节样显影;部分荧光4例(图 3C),均为术前无活检而有化疗史的病例。结合肝母细胞瘤的病理分类,胎儿型7例,其中荧光显像为全荧光型3例,部分荧光型4例;混合性胎儿上皮和胚胎上皮型1例,其荧光显像为部分荧光型(表 1)。
二、肿瘤切缘界定ICG分子荧光边界定界,切除肿瘤后,经荧光再测,所有病例的切缘荧光显像均为阴性(图 3D),术后病理证实切缘未发现肿瘤细胞,所有病例获得了肿瘤R0切除。
讨 论ICG是一种水溶性、惰性化合物,其与血浆蛋白结合物只能通过肝脏代谢,排泄于胆汁, 并且无肠肝循环,利用ICG的这一特性可以用于肝功能的评估和肝切除术的导航[11]。目前,ICG荧光显像技术已广泛运用于肝细胞肝癌的术中肿瘤识别、切缘界定和手术导航,但对于儿童肝脏肿瘤切除术运用ICG荧光显像技术的文献报道有限,且多为个案报道,缺乏不同病理类型和肝脏肿瘤显像特征的比较[7, 8]。最近,国内有学者报道了1例肝母细胞瘤患儿成功应用ICG荧光染色引导下的解剖性右半肝切除术[9]。本研究回顾性分析8例肝母细胞瘤行肿瘤切除术患儿的临床资料,评估儿童肝母细胞瘤的ICG荧光显像特点,以及该技术对术中微小病灶识别、肿瘤切缘界定和术中导航的价值。
ICG荧光显像在正常肝脏组织、恶性肿瘤组织、良性肿瘤组织中存在着不同表现[12]。对于成人肝脏肿瘤,特别是肝癌的研究发现,当肿瘤分化差或为转移病灶时,由于几乎完全丧失肝细胞的正常功能,因而不能摄取ICG,而肿瘤周边的正常肝脏组织因受压迫常导致ICG延迟排泄,所以表现为环绕肿瘤的环形荧光[13];高分化肝脏肿瘤组织能摄入ICG,但不能正常排泄ICG至胆道,因而可较长时间显示荧光;中分化肝脏肿瘤中部分细胞丧失摄取ICG功能,因而显示为不均匀荧光[14];肝硬化结节内肝细胞排列紊乱,缺乏规则有序的毛细胆管系统,致使ICG排泄障碍,则表现为均匀的荧光[15]。因而,对于肝癌患者,依据肝细胞分化程度不同,ICG荧光显像特征亦不相同,因而术中可初步鉴别肿瘤分化程度。本研究也分析了肝母细胞瘤病理分类与显像的关系,由于肝母细胞瘤以胎儿型为主,因而往往具有较好的分化特征,所以荧光类型也以全部或部分显像为主,与高分化肝细胞肝癌的特征相似。至于对于未分化型或其它类型的肝母细胞瘤显影特征,后续需要积累更多的病例进行研究和分析。
通过进一步分析肝脏荧光显像类型与术前活检和化疗的关系,我们发现部分荧光型的病例术前均有化疗史,而全荧光与术前活检和化疗无明显的相关性。这一方面提示儿童肿瘤具有较好的分化,从而能够较好地显示肿瘤,有利于肿瘤切缘的界定和手术导航;另一方面,肝母细胞瘤患儿经过化疗后,部分肿瘤组织可能出现坏死、出血或瘢痕,可以部分影响肿瘤组织摄取ICG,从而表现为部分荧光显像。本研究有1例肝母细胞瘤复发患儿有乙肝病史,术中荧光显像为肝脏弥漫性结节样均匀荧光,符合肝硬化表现,术中及术后病理均证实存在轻度肝硬化。
在肝脏手术过程中,如何精确、客观地显示肿瘤边界信息是精准医学领域极具挑战性的问题[16, 17]。目前儿童肝脏肿瘤手术过程中,更多依靠术中触诊、超声及术前三维影像分析来确定肿瘤的边界,但存在一定的局限性。ICG分子荧光显像技术已证实能够实现肿瘤组织与正常肝组织精准的实时对比成像,可在术中划定肿瘤边界与肝切除范围,而且肝切除后可以进行残留肿瘤病灶的检测[18]。本研究中,我们运用ICG荧光显像术中界定肿瘤边界并检测术后切缘,术后病理均证实了R0切缘,与ICG荧光显像结果一致,这说明ICG荧光显像能够协助判断肝脏切缘是否有肿瘤残留,提高和保证了肿瘤R0切除。
ICG成像介质已经在临床使用超过50年,不良反应发生率低于0.01%[19]。本研究所有患儿术前静脉注射ICG后未出现过敏、发热、皮疹等不良反应,这说明其在儿童中使用也是安全可靠的。对于成人,Ishizawa建议在手术前至少2 d,ICG以0.5 mg/kg的剂量静脉使用,以减少背景的干扰,从而获得更好的肿瘤与正常肝脏组织的对比度[4]。考虑到儿童往往很少存在肝硬化或其他肝脏基础疾病,同时肿瘤分化程度往往较高,因而我们把注射时间提前至24~48 h,术中肿瘤显影明亮,病灶与正常肝脏组织边界清晰,也获得较好的对比效果。因此,我们认为对于儿童使用ICG荧光显影时,术前1 d以上注射ICG就可获得较好的显像效果。
ICG荧光显像技术也有一定的局限性,其发出的荧光信号仅能穿透10 mm以内的肝脏实质[20]。在本研究中,1例肝母细胞瘤复发患儿的病灶较小(1.0 cm)且位置较深(距离肝脏表面>1.5 cm),未能显示荧光,规则切除肝叶劈开肝脏后发现肿瘤组织呈强荧光显像,可见ICG在人体组织穿透能力受限制。同时,该例患儿有乙肝病史,肝脏可见弥漫性均匀荧光显像,术中冰冻提示肝硬化结节,导致了假阳性率的发生,也影响了真正肿瘤结节的发现。Gotoh等[21]研究发现,对于肝硬化结节、肝脏不良结节增生等可以显示较强的荧光,假阳性率为40% ~50%,准确率为65%。因而对于存在肝病或肝硬化的患儿,如果在术中发现的阳性结节需要持谨慎的态度,并配合术中冰冻明确结节性质,以减少误差。
总之,ICG荧光显影技术在儿童肝母细胞瘤中有较好的显影效果,显影类型与术前有无化疗有一定关系。ICG荧光显像在确定肿瘤边界和保证肿瘤R0切除具有一定优势和重要价值。但ICG荧光显像对深部肿瘤灶的识别和在肝硬化病例中的运用存在一定的局限性。
| 1 |
Litten JB, Tomlinson GE. Liver tumors in children[J]. On- cologist, 2008, 13(7): 812-820. DOI:10.1634/theoncolo-gist.2008-0011. |
| 2 |
Busweiler LA, Wijnen MH, Wilde JC, et al. Surgical treat- ment of childhood hepatoblastoma in the Netherlands (1990- 2013)[J]. Pediatr Surg Int, 2017, 33(1): 23-31. DOI:10.1007/s00383-016-3989-8. |
| 3 |
Shi Y, Commander SJ, Masand PM, et al. Vascular invasion is a prognostic indicator in hepatoblastoma[J]. J Pediatr Surg, 2017, 52(6): 956-961. DOI:10.1016/j.jpedsurg.2017.03.017. |
| 4 |
Ishizawa T, Fukushima N, Shibahara J, et al. Real-time iden- tification of liver cancers by using indocyanine green fluores-cent imaging[J]. Cancer, 2009, 115(11): 2491-2504. DOI:10.1002/cncr.24291. |
| 5 |
Narasaki H, Noji T, Wada H, et al. Intraoperative real-time assessment of liver function with near-infrared fluorescence imaging[J]. Eur Surg Res, 2017, 58(5-6): 235-245. DOI:10.1159/000477347. |
| 6 |
Liberale G, Bourgeois P, Larsimont D, et al. Indocyanine green fluorescence-guided surgery after IV injection in meta- static colorectal cancer:A systematic review[J]. Eur J Surg Oncol, 2017, 43(9): 1656-1667. DOI:10.1016/j.ejso.2017.04.015. |
| 7 |
Yamamichi T, Oue T, Yonekura T, et al. Clinical application of indocyanine green (ICG) fluorescent imaging of hepato- blastoma[J]. J Pediatr Surg, 2015, 50(5): 833-836. DOI:10.1016/j.jpedsurg.2015.01.014. |
| 8 |
Kitagawa N, Shinkai M, Mochizuki K, et al. Navigation using indocyanine green fluorescence imaging for hepatoblastoma pulmonary metastases surgery[J]. Pediatr Surg Int, 2015, 31(4): 407-411. DOI:10.1007/s00383-015-3679-y. |
| 9 |
彭宇明, 尹强, 高红强, 等. 吲哚菁绿荧光染色引导下解剖性右半肝切除治疗儿童肝脏肿瘤[J]. 临床小儿外科杂志, 2018, 17(8): 597-599. DOI:10.3969/j.issn.1671-6353.2018.201805057. Peng YM, Yin Q, Gao HQ, et al. Anatomic right-half of indo- cyanine green fluorescent staining hepatectomy for children with liver tumors[J]. J Clin Ped Sur, 2018, 17(8): 597-599. DOI:10.3969/j.issn.1671-6353.2018.201805057. |
| 10 |
方驰华, 梁洪玻, 迟崇巍, 等. 吲哚氰绿介导的近红外光技术在微小肝脏肿瘤识别、切缘界定和精准手术导航的应用[J]. 中华外科杂志, 2016, 54(6): 444-450. DOI:10.3760/cma.j.issn.0529-5815.2016.06.011. Fang CH, Liang HB, Chi CW, et al. Application of indocya- nine green fluorescent imaging technique in planning resec- tion line and real-time surgical navigation in small hepato- cellular carcinoma[J]. Chin J Surg, 2016, 54(6): 444-450. DOI:10.3760/cma.j.issn.0529-5815.2016.06.011. |
| 11 |
Landsman ML, Kwant G, Mock GA, et al. Light-absorbing properties, stability and spectral stabilization of indocyanine green[J]. J Appl Physiol, 1976, 40(4): 575-583. DOI:10.1152/jappl.1976.40.4.575. |
| 12 |
van der Vorst JR, Schaafsma BE, Hutterman M, et al. Near- infrared fluorescenceguided resection of colorectal liver me- tastasis[J]. Cancer, 2013, 119(18): 3411-3418. DOI:10.1002/cncr.28203. |
| 13 |
de Graaf W, Häusler S, Heger M, et al. Transporters in- volved in the hepatic uptake of (99m) Tc-mebrofenin and indocyanine green[J]. J Hepatol, 2011, 54(4): 738-745. DOI:10.1016/j.jhep.2010.07.047. |
| 14 |
Satou S, Ishizawa T, Masuda K, et al. Indocyanine green flu- orescent imaging for detecting extrahepatic metastasis of hepatocellular carcinoma[J]. J Gastroenterol, 2013, 48(10): 1136-1143. DOI:10.1007/s00535-012-0709-6. |
| 15 |
Kaibori M, Matsui K, Ishizaki M, et al. Evaluation of fluo- rescence imaging with indocyanine green in hepatocellular carcinoma[J]. Cancer Imaging, 2016, 16: 6. DOI:10.1186/s40644-016-0064-6. |
| 16 |
Meyers RL, Tiao G, de Ville de Goyet J, et al. Hepatoblasto- ma state of the art:pre-treatment extent of disease, surgical resection guidelines and the role of liver transplantation[J]. Curr Opin Pediatr, 2014, 26(1): 29-36. DOI:10.1097/MOP.0000000000000042. |
| 17 |
儿童肝母细胞瘤多学科诊疗专家共识(CCCG-HB-2016)[J]. 中华小儿外科杂志, 2017, 38(10): 733-739. DOI:10.3760/cma.j.issn.0253-3006.2017.10.003. Expert Con- sensus for Multidisciplinary Management of Hepatoblastoma (CCCG-HB-2016)[J]. Chin J Pediatr Surg, 2017, 38(10): 733-739. DOI:10.3760/cma.j.issn.0253-3006.2017.10.003. |
| 18 |
Vahrmeijer AL, Hutteman M, van der Vorst JR, et al. Im-age-guided cancer surgery using near-infrared fluorescence[J]. Nat Rev Clin Oncol, 2013, 10(9): 507-518. DOI:10.1038/nrclinonc.2013.123. |
| 19 |
Speich R, Saesseli B, Hoffmann U, et al. Anaphylactoid re- actions after indocyanine-green administration[J]. Ann In- tern Med, 1988, 109(4): 345-346. |
| 20 |
Lim C, Vibert E, Azoulay D, et al. Indocyanine green fluo- rescence imaging in the surgical management of liver canc- ers:current facts and future implications[J]. J Visc Surg, 2014, 151(2): 117-124. DOI:10.1016/j.jviscsurg.2013.11.003. |
| 21 |
Yang JY, Lee HJ, Kim TH, et al. Short-and long-term out- comes after gastrectomy in elderly gastric cancer patients[J]. Ann Surg Oncol, 2017, 24(2): 469-477. DOI:10.1245/s10434-016-5482-y. |
 2019, Vol. 18
2019, Vol. 18


