2. 江西省儿童医院普外科(江西省南昌市,330006)
2. Department of General Surgery, Jiangxi Children's Hospital, Nanchang 330006, China
胆道闭锁(biliary atresia, BA)是新生儿先天畸形中相对常见的一种类型。据不完全统计,我国胆道闭锁的发病率为1/8 000~1/15 000,如不及时治疗,短期内可引起胆汁性肝硬化,患儿平均生存时间仅19个月。目前,Kasai手术是治疗BA最有效的方法,但大部分患儿在接受手术后,肝纤维化仍不断进展,其进行性发展的机制目前尚不清楚。上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞丢失上皮特征而获得间质特征的变化过程,主要表现为:E-钙粘蛋白(E-cadherin)表达下调,N-钙粘蛋白(N-cadherin)、平滑肌肌动蛋白(α-SMA)、波形蛋白(vimentin)表达上调。上述过程有可能会导致肝细胞和胆管细胞发生上皮间质转化,促使肝纤维化进程加快,最终导致肝硬化发生。因此,本研究对BA患儿的肝组织标本进行EMT相关蛋白检测,并与对照组结果进行比较,初步探讨EMT与BA病理特征的关系和发病机制。
材料与方法 一、材料收集江西省儿童医院2012年1月至2015年12月经胆道造影和肝组织病理检查证实为BA的肝组织标本共34例,同期选取胆总管囊肿肝组织标本13例作为对照组。于术中取0.5 cm×0.5 cm×0.5 cm大小肝组织进行病理检查。剔除甲型及乙型病毒性肝炎的患儿。临床资料来源于病历记录。
二、方法免疫组织化学采用SP法。N-cadherin、E-cadherin阳性表达的典型特征为棕黄色颗粒定位于细胞膜;Vimentin、SMA、CK19阳性表达的典型特征为棕黄色颗粒定位于细胞质。
三、结果判读BA病理组织形态学诊断标准参照2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的病毒性肝炎防治方案[1]。肝纤维化程度分为5个等级,0级:无肝纤维化;1级:汇管区纤维化范围扩大,局限在窦周及小叶内;2级:汇管区周围纤维化,纤维间隔形成,小叶结构保留;3级:纤维间隔伴小叶结构紊乱,无肝硬化;4级:早期肝硬化。
汇管区及汇管区周围小胆管增生的程度分为5个等级。0级:无增生的小胆管;1级:汇管区出现少量增生、畸形的小胆管;2级:汇管区及小叶间出现较多增生、畸形的小胆管,且轻度向小叶间延伸;3级:汇管区小胆管出现明显增生、畸形或萎缩,且明显向小叶间延伸;4级:汇管区小胆管出现增生或减少、萎缩,并包绕肝小叶。
免疫组化结果采用半定量分析法。每张切片随机选取5个高倍视野,分别计算其阳性细胞百分数和着色强度。按阳性细胞百分比计分:阳性细胞百分数≤5%计0分,6% ~25%计1分,26% ~50%计2分,51% ~75%计3分,>75%计4分;按着色强度计分:无色计0分,浅棕色计1分,棕色计2分,深棕色计3分。将两项得分结果相乘:0分判定为阴性(-),1~4分判定为弱阳性(+),5~8分判定为阳性(++),9~12分判定为强阳性(+++)。由两位病理医师进行双盲法阅片并判定病理诊断结果及其对应得分,取二者平均值作为最终结果。
四、统计学分析采用SPSS23.0进行统计学分析,病例组与对照组间抗体不同表达等级构成比的比较采用Fisher精确概率法,以P<0.05为差异具有统计学意义。
结 果 一、临床资料BA组共34例,其中男18例,女16例,手术时患儿日龄25~120 d。血清总胆红素(TBIL)96.5~ 384.4 μmol/L,血清直接胆红素(DBIL)77.3~292.5 μmol/L,谷丙氨酸(ALT)35~338 μmol/L,谷草氨酸(AST)98~584 μmol/L,γ-谷氨酰转肽酶(GGT)128~1345 μmol/L。对照组共13例,男2例,女11例,手术时患儿年龄5个月至10岁;血清总胆红素(TBIL)5.1~264.9 μmol/L,血清直接胆红素(DBIL)1.9~194.9 μmol/L,谷丙氨酸(ALT)10~359 μmol/L, 谷草氨酸(AST)17~392 μmol/L,γ-谷氨酰转肽酶(GGT)12~1229 μmol/L。
二、病理学特征34例BA标本均显示不同程度的肝纤维组织增生、小胆管增生及炎症细胞浸润。不同肝纤维化程度(F1~F4)例数分别为:0例、10例、22例、2例;不同炎症程度(G1~G4)例数分别为:12例、22例、0例、0例。13例胆总管囊肿患儿中,不同肝纤维化程度(F1~F4)例数分别为:3例、7例、3例、0例;不同炎症程度(G1~G4)例数分别为:9例、4例、0例、0例。
三、免疫组化表达N-cadherin主要表达在汇管区增生的小胆管上皮和肝细胞(图 1),E-cadherin主要表达在汇管区增生的小胆管上皮和肝细胞(图 2),Vimentin、SMA在汇管区间叶组织各区域均呈阳性表达(图 3、图 4),CK19在胆管上皮各区域均呈阳性表达(图 5)。实验组与对照组间,N-cadherin、E-cadherin、vimentin、SMA、CK19抗体不同表达等级的构成比存在统计学差异(P < 0.05),具体结果见表 1。
|
Download:
|
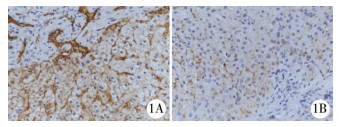
| 图 1 A.胆道闭锁患儿肝组织汇管区胆管(N-cadherin强阳性, SP法×200); B.胆总管囊肿患儿肝组织汇管区胆管(N-cadherin弱阳性或阴性, SP法×200) Fig. 1 A.A high expression of N-cadherin in hepatic portal area of BA child; B.A low expression of N-cadherin in hepatic portal area of common bile duct cyst | |
|
Download:
|
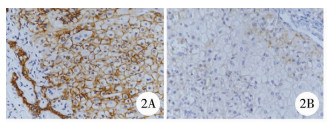
| 图 2 A.胆道闭锁患儿肝组织汇管区胆管E-cadherin强阳性(SP法×200); B.胆总管囊肿患儿肝组织汇管区胆管E-cadherin弱阳性或阴性(SP法×200) Fig. 2 A.A high expression of E-cadherin in hepatic portal area of BA; B.A low expression of E-cadherin in hepatic portal area of common bile duct cyst | |
|
Download:
|
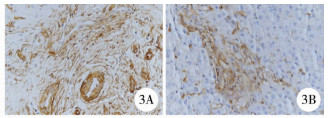
| 图 3 A.胆道闭锁患儿肝组织汇管区纤维组织Vimentin阳性(SP法×200); B.胆总管囊肿患儿肝组织汇管区纤维组织Vimentin阳性(SP法×200) Fig. 3 A.A high expression of Vimentin in hepatic portal area of BA; B.A low expression of Vimentin in hepatic portal area of common bile duct cyst | |
|
Download:
|
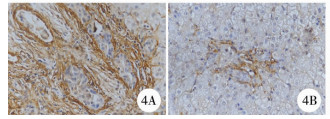
| 图 4 A.胆道闭锁患儿肝组织汇管区纤维组织SMA阳性(SP法×200); B.胆总管囊肿患儿肝组织汇管区纤维组织SMA阳性(SP法×200) Fig. 4 A.A high expression of SMA in hepatic portal area of BA; B.A low expression of SMA in hepatic portal area of common bile duct cyst | |

|
Download:
|
| 图 5 A.胆道闭锁患儿肝组织汇管区纤维组织CK19阳性(SP法×200); B.胆总管囊肿患儿肝组织汇管区纤维组织CK19阳性(SP法×200) Fig. 5 A.A high expression of CK19 in hepatic portal area of BA; B.A low expression of CK19 in hepatic portal area of common bile duct cyst | |
上皮间质转化(epithetial-to-mesenchymal transition, EMT)参与胚胎的发育过程,并在成熟组织器官损伤修复、重塑过程中发挥重要作用[2]。在特异性肝脏E-cadherin基因敲除小鼠模型中,E-cadherin缺失可诱导胆管上皮细胞产生炎症及周围组织纤维化。此外,E-cadherin基因敲除小鼠肿瘤上皮间质转型相关的侵袭过程明显加速,其中少数能产生自发性肝癌[3]。胆管结扎模拟胆道闭锁的大鼠模型中,可检测到肝脏中上皮标记物减少,而间质标记物增加,提示部分上皮可能发生了上皮间质表型转化[4]。在肝内胆管结石的患者中,EMT相关蛋白在小型胆管的表达量高于中型或大型胆管,且表达量与胆管程度纤维化相关,这有可能是促进肝内胆管结石形成的途径之一[5]。胆管癌患者在某些情况下可表现出上皮间质转化相关的功能发生变化(包括E-cadherin和CK19表达量降低)[6]。采用胆囊癌细胞株体外试验也检测出TGF-β能诱导上皮间质转化[7],另有体外试验表明,肝炎病毒能诱导人原代肝细胞上皮间质转化[8],肝癌细胞的侵袭性也与上皮间质转化有关[9]。
|
|
表 1 N-cadherin、E-cadherin、vimentin、SMA、CK19抗体在BA组与胆总管囊肿组的表达差异对比 Table 1 Expressions of N-cadherin, E-cadherin, vimentin, SMA and CK19 in BA group and common bile duct cyst group |
N-cadherin有促进和保护细胞粘附等功能,在肿瘤进展过程中,N-cadherin蛋白表达增强,与肿瘤侵袭性增强和预后不良有关。本研究临床资料显示,BA患儿解除肝外梗阻后纤维化过程仍在继续,而胆总管囊肿患儿手术后肝纤维化基本不再进展,提示BA患儿肝脏出现EMT可能是导致预后不佳的危险因素[10]。因此,N-cadherin可能是涉及EMT调控的重要标志物之一,并主要作用于胆管。
CK19、E-cadherin作为上皮细胞标志物,在胆道闭锁患儿的肝组织中表达量并未降低,反而显著升高,这可能是因为在肝脏病变早期,机体激发了代偿机制以对抗纤维化发生。有研究显示在纤维化程度达S2~S3时,可以观察到新形成的小胆管明显增生,随着病程进一步发展,当纤维化程度达S4时,胆管管径常常变得很小,甚至看不到管腔,纤维组织中胆管分布也并不十分密集,而肝界面处胆管明显增多[11]。究其原因,一方面可能是纤维组织增生压迫了新生的胆管;另一方面,胆管上皮及肝细胞本身可能存在持续的EMT现象,导致机体自身修复的能力无法对抗纤维化的进展,造成胆管逐渐萎缩,转化成纤维细胞和肌纤维细胞,进一步加重了纤维化程度[12-13]。
由于BA患儿接受手术治疗后远期效果欠佳,因此许多患儿家属选择放弃治疗。困扰胆道闭锁治疗的主要原因是:经手术通畅肝外胆道后,肝脏纤维化仍可不断进展,因此通畅肝内胆道系统、解决胆汁淤积是治疗本病的关键。此外,EMT在胆道闭锁患儿肝纤维化过程中可能起到影响肝内胆管增生、代偿的作用。抑制甚至逆转EMT可能是改善BA预后的新途径之一。
| 1 |
中华医学会传染病与寄生虫病学分会、肝病学分会联合修订. 病毒性肝炎防治方案[J]. 中华内科杂志, 2001, 40(1): 62-68. DOI:10.3760/j.issn:0578-1426.2001.01.034. Infectious Diseases and Parasitology Branch of Chinese Medical Association. Viral Hepatitis Control Programme[J]. Chinese Journal of Internal Medicine, 2001, 40(1): 62-68. DOI:10.3760/j.issn:0578-1426.2001.01.034. |
| 2 |
Thiery JP, Acloque H, Huang RY, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5): 871-890. DOI:10.1016/j.cell.2009.11.007. |
| 3 |
Nakagawa H, Hikiba Y, Hirata Y, et al. Loss of liver E-cadherin induces sclerosing cholangitis and promotes carcinogenesis[J]. Proc Natl Acad Sci USA, 2014, 111(3): 1090-1095. DOI:10.1073/pnas.1322731111. |
| 4 |
黄珊, 张文雍, 潘春球, 等. 胆管结扎诱导的肝纤维化大鼠肝脏上皮间质表型的变化[J]. 南方医科大学学报, 2012, 32(2): 173-176. Huang S, Zhang WY, Pan CQ, et al. Epithelial-to-mesenchymal phenotype transition in liver of rats with bile duct ligation[J]. Journal of Southern Medical University, 2012, 32(2): 173-176. |
| 5 |
Sung R, Lee SH, Ji M, et al. Epithelial-mesenchymal transition-related protein expression in biliary epithelial cells associated with hepatolithiasis[J]. J Gastroenterol Hepatol, 2014, 29(2): 395-402. DOI:10.1111/jgh.12349. |
| 6 |
Clapéron A, Guedj N, Mergey M, et al. Loss of EBP50 stimulates EGFR activity to induce EMT phenotypic features in biliary cancer cells[J]. Oncogene, 2012, 31(11): 1376-1388. DOI:10.1038/onc.2011.334. |
| 7 |
Zhang Z, Zhu F, Xiao L, et al. Side population cells in human gallbladder cancer cell line GBC-SD regulated by TGF-β-induced epithelial-mesenchymal transition[J]. J Huazhong Univ Sci Technolog Med Sci, 2011, 31(6): 749-755. DOI:10.1007/s11596-011-0671-1. |
| 8 |
Sandip K, Bose K, Meyer AM, et al. Hepatitis C virus induces epithelial-mesenchymal transition in primary human hepatocytes[J]. Journal of virology, 2012, 86(24): 13621-13628. DOI:10.1128/JVI.02016-12. |
| 9 |
黄涛, 马超, 丁月超, 等. 肝癌SMMC-7721细胞中侧群细胞侵袭性与上皮-间充质转化的关系[J]. 中华实验外科杂志, 2014, 31(1): 84-86. DOI:10.3760/cma.j.issn.1001-9030.2014.01.028. Huang T, Ma C, Ding YC, et al. Association of epithelial-mesenchymal transition with invasiveness of side populations in hepatoma SMMC-7721 cells[J]. Chinese Journal of Experimental Surgery, 2014, 31(1): 84-86. DOI:10.3760/cma.j.issn.1001-9030.2014.01.028. |
| 10 |
吴晔明, 施诚仁, 洪莉, 等. 88例儿童胆总管囊肿肝脏病理临床分析[J]. 肝胆外科杂志, 2001, 9(4): 264-265. DOI:10.3969/j.issn.1006-4761.2001.04.011. Wu YM, Shi CR, Hong L, et al. Clinical analysis of pathological changes of liver in 88 children with choledochal cyst[J]. J Hep Sur, 2001, 9(4): 264-265. DOI:10.3969/j.issn.1006-4761.2001.04.011. |
| 11 |
杨文萍, 吴艳, 张守华, 等. 胆道闭锁患者肝脏组织病理改变的综合评价[J]. 临床小儿外科杂志, 2015, 14(1): 10-15. DOI:10.3969/j.issn.1671-6353.2015.01.004. Yang WP, Wu Y, Zhang SH, et al. Comprehensive evaluations of pathological changes in liver tissue of biliary atresia[J]. J Clin Ped Sur, 2015, 14(1): 10-15. DOI:10.3969/j.issn.1671-6353.2015.01.004. |
| 12 |
Nakanuma Y, Sasaki M, Harada K. Autophagy and senescence in fibrosing cholangiopathies[J]. J Hepatol, 2015, 62(4): 934-945. DOI:10.1016/j.jhep.2014.11.027. |
| 13 |
Harada K, Nakanuma Y. Cholangiopathy with respect to biliary innate immunity[J]. Int J Hepatol, 2012, 2012: 793569. |
 2018, Vol. 17
2018, Vol. 17


